Навигация
Анемия (малокровие) - уменьшение в крови общего количества гемоглобина, которое, за исключением острых кровопотерь, характеризуется снижением уровня гемоглобина в единице объема крови. В большинстве случаев при анемии падает и уровень эритроцитов в крови. Однако при железодефицитных состояниях, анемиях, связанных с нарушением синтеза порфиринов, талассемии содержание эритроцитов в крови может оставаться нормальным (при талассемии - нередко повышенным) при низком уровне гемоглобина. При острых кровопотерях (массивное кровотечение или острый гемолиз) в первые часы уровень гемоглобина и эритроцитов в крови остается нормальным, хотя есть очевидные признаки малокровия - бледность кожных покровов, конъюнктив, славшиеся вены, сердцебиение и одышка при небольшой нагрузке, а в тяжелых случаях и падение артериального давления.
Анемии всегда вторичны, т. е. являются одним из симптомов какого-то общего заболевания. Наряду с часто встречающимися и легко диагностируемыми формами анемии имеются и очень редкие анемические синдромы, требующие для диагностики сложных методических приемов. Некоторые формы анемии можно диагностировать лишь в специализированных учреждениях.
Классификация.
Из многочисленных классификаций, строившихся по этиологическому, патогенетическому и клиническому принципу, наиболее удачными оказались патогенетические.
I. Дефицитные анемии
Преимущественно белково-дефицитные
Преимущественно витамино-дефицитные
Преимущественно железодефицитные
II. Постгеморрагические анемии
Анемии вследствие острых кровопотерь
Анемии вследствие хронических кровопотерь
III. Гипо-и апластические анемии
А. Врожденные формы
1. С поражением эритро-, лейко- и тромбоцитопоэза:
а) с врожденными аномалиями развития (тип Фанкони);
б) без врожденных аномалий развития (тип Эстрена-Дамешека)
2. С парциальным поражением гемопоэза:
а) избирательная эритроидная аплазия (тип Блекфена-Даймонда)
Б. Приобретенные формы
1.С поражением эритро-, лейко- и тромбоцитопоэза: а) острая апластическая;
б) подострая гипопластическая; в) хроническая гипопластическая;
г) хроническая гипопластическая с гемолитическим компонентом на почве аутоиммунизации
2.Парциальная гипопластическая анемия с избирательным поражением эритропоэза
IV. Гемолитические анемии
А. Наследственные
1.Мембранопатии (микросфероцитоз, элиптоцитоз, пиропойкилоцитоз, стоматоцитоз, ксероцитоз, пароксизмальная ночная гемоглобинурия и др.);
2.Ферментопатии (дефекты цикла Эмбдена - Мейергофа, пентозофосфатного цикла, обмена нуклетотидов, метгемоглобинемия)
3.Дефекты структуры и синтеза гемоглобина (серповидноклеточная болезнь и другие гемоглобинозы с аномальными гемоглобинами; талассемии, эритропорфирии).
Б. Приобретенные
1.Иммунные и иммунопатологические (изоиммунные - переливание несовместимой крови, гемолитическая болезнь новорожденных; утоиммунные, гаптеновые медикаментозные и др.);
2.Инфекционные (цитомегаловирусная и другие вирусные инфекции, бактериальные инфекции - менингококковая и др.);
3.Витаминодефицитные (Е-витаминодефицитная анемия недоношенных) и анемии, обусловленные отравлениями тяжелыми металлами, ядом змей.
4.ДВС-синдром разной этиологии.
Анемия постгеморрагическая острая - малокровие вследствие острой кровопотери в течение короткого срока. Минимальная кровопотеря, представляющая опасность для здоровья взрослого человека, -500 мл.
Этиология. Причиной кровопотери могут быть травмы, хирургическое вмешательство, кровотечение при язве желудка или двенадцатиперстной кишки, из расширенных вен пищевода, при нарушении гемостаза, внематочной беременности, заболеваниях легких и т. п.
Патогенез складывается из явлений острой сосудистой недостаточности, обусловленной в первую очередь острым опустошением сосудистого русла, потерей плазмы; при массивной кровопотере наступает и гипоксия из-за потери эритроцитов, когда эта потеря уже не может быть компенсирована ускорением циркуляции за счет учащения сердечных сокращений.
Клиническая картина. Сосудистые нарушения: сердцебиение, одышка, падение артериального и венозного давления, бледность кожных покровов и слизистых оболочек. Выраженность этих изменений не находится в четкой связи только со степенью кровопотери, так как нередко коллапс появляется и в ответ на боль, травму, вызвавшую кровопотерю. Существенный признак внутреннего кровотечения - внезапная сухость во рту. Тяжесть клинической картины определяется не только количеством потерянной крови, но скоростью кровопотери. Определенное значение имеет и источник кровопотери: кровотечение в желудочно-кишечный тракт может сопровождаться повышением температуры тела, картиной интоксикации, повышением уровня мочевины в крови (при нормальном уровне креатинина); полостные кровотечения могут даже при небольшом количестве излившейся крови вызывать симптомы сдавления органов и т. п.
Лечение начинают с остановки кровотечения. Быстрое снижение содержания гемоглобина ниже 80 г/л (8 г%) гематокрита ниже 25%, белков плазмы ниже 50 г/л (5 г%) является основанием для трансфузионной терапии, при этом потерю эритроцитов достаточно восполнить на 1/3; первоочередная задача - восстановление объема циркулирующей крови путем переливания коллоидных растворов (альбумин плацентарный или кровяной, свежезамороженная плазма или протеин), полиглюкина или желатиноля. При отсутствии полиглюкина и желатиноля можно перелить 1000 мл 10% раствора глюкозы, а затем 500 мл 5% раствора; глюкозу переливают со скоростью 0,5 г/ (кг Ђ ч). Реополиглюкин и его аналоги как дезагреганты (т. е. препараты, снижающие свертывающую способность крови) не должны применяться в условиях возможного возобновления (или продолжающегося) кровотечения. Для возмещения потери эритроцитов используют эритроцитную массу. Показанием к переливанию эритроцитов является очевидная массивность кровопотери (более 1 л), сохранение бледности кожи и слизистых оболочек, тахикардии и одышки, несмотря на восстановление объема циркулирующей крови с помощью плазмозаменителей.
Ни в коем случае нельзя стремиться к восполнению кровопотери по эритроцитам "капля за каплю"; свежезамороженную плазму вместе с плазмозаменителями приходится вливать в большем объеме, чем было потеряно, а эритроциты- существенно в меньшем. Наступающая в результате итого гемодилюция обеспечивает улучшение микроциркуляции, в то время как массивные трансфузии цельной крови или эритроцитов усиливают образование микростазов, обусловленное шоком, способствуют развитию ДВС-синдрома.
Небольшие кровопотери восполняют введением солевых растворов, альбумина. Цельную кровь переливают при отсутствии эритроцитной массы, а если нет консервированной крови, переливают свежецитратную кровь (теплую, только что заготовленную) или осуществляют прямое переливание (весьма нежелательное без крайней необходимости из-за наличия микросгустков в такой крови). При операционных крововоте-рях менее 1 л переливание эритроцитной массы обычно не используют.
Наследственные анемии, связанные с нарушением синтеза порфиринов (сидероахрестические анемии), характеризуются гипохромией эритроцитов, повышением уровня сывороточного железа, отложением железа с картиной гемоссидероза органов.
Патогенез наиболее частой формы связан с нарушением синтеза протопорфирина, что ведет к нарушению связывания железа и накоплению его в организме при резко нарушенном образовании гемоглобина.
Клиническая картина. Умеренная анемия с резко сниженным цветовым показателем. Трофических нарушений, свойственных железодефицитным состояниям, не наблюдается. Жалобы отсутствуют или отмечаются небольшая слабость, утомляемость. Чаще страдают мужчины. Болезнь наследуется по рецессивному типу, наследование сцеплено с Х-хромосомой. В начале болезни иногда отмечается небольшое увеличение селезенки, в дальнейшем в связи с повышенным отложением железа в органах развивается гемосидероз печени (печень увеличивается и становится плотной), поджелудочной железы (появляется картина сахарного диабета). Накопление железа в сердечной мышце приводит к тяжелой недостаточности кровообращения, гемосидероз яичек сопровождается развитием евнухоидизма. Иногда кожа приобретает серый оттенок.
Картина крови: выраженная гипохромия эритроцитов (цветовой показатель 0,4-0,6), уровень гемоглобина снижен, в меньшей степени изменено число эритроцитов, повышен уровень сывороточного железа. Морфологически отмечаются анизоцитоз, пойкилоцитоз, иногда небольшое количество мишеневидных форм. Содержание ретикулоцитов обычно нормальное. Другие показатели крови нормальные.
Диагноз устанавливают на основании гипохромной анемии без каких-либо признаков железодефицитного синдрома (отсутствуют выраженная астенизация, сухость кожи, выпадение волос, ломкость и деформация ногтей и т. п. ), повышенного уровня сывороточного железа. Следует иметь в виду, что железодефицитные анемии чаще встречаются у женщин, а данная форма - почти исключительно у мужчин. При исследовании костного мозга в отличие от железодефицитных анемий отмечается высокий процент кольцевых сидеробластов (практически все эритрокариоциты -кольцевые сидеробласты).
Лечение. Назначают пиридоксин (витамин B6) no 1 мл 5% раствора в/м 2 раза в день. При эффективной терапии через 1,5 нед резко возрастает содержание ретикулоцитов, а затем повышается и уровень гемоглобина. При нарушении активности фермента пиридоксалькиназы эффект дает применение кофермента витамина B6-пиридоксальфосфата (по 2 мг 3 раза в день в таблетках). Для лечения гемосидероза как такового, сопровождающегося патологией печени, поджелудочной железы и других органов, а также для лечения форм, устойчивых к витамину B12 (ими болеют как мужчины, так и женщины; наследование рециссивное, не сцепленное с полом), применяют дефероксамин (десферал) курсами не менее месяца по 500 мг в/м ежедневно. Таких курсов может быть 4-6 в год. Повышенное выведение из организма железа с помощью дефероксамина не только способствует нормализации функций, нарушенных из-за гемосидероза органов, но и уменьшает степень анемии, улучшая деятельность блокированного избытком железа костного мозга.
Анемия при свинцовом отравлении обусловлена нарушением синтеза порфиринов и гема
Патогенез определяется блокадой свинцом ферментов, участвующих в синтезе гема. В результате развивается гипохромная анемия при высоком уровне сывороточного железа. Кроме того, свинец повреждает оболочку эритроцитов, вызывая повышенный гемолиз. В результате нарушения синтеза гема повышается выведение из организма порфиринов, и, что патогномонично для свинцового отравления, дельта-аминолевулиновой кислоты, уровень которой в моче повышается в десятки раз.
Клиническая картина складывается из общих признаков анемического синдрома без явлений дефицита железа, полиневрита, приступообразной боли в животе. При исследовании крови выявляется гипохромная анемия, повышение содержания ретикулоцитов до 10% вследствие гемолиза, базофильная пунктация в эритроцитах, высокий уровень сывороточного железа. В костном мозге высокий процент сидеробластов. Диагноз подтверждается существенным повышением в моче дельта-аминолевулиновой кислоты. Другой важный признак свинцового отравления - повышенное выделение свинца с мочой при введении в организм комплексонов (тетацин-кальций, оксатиол и др. ). Определенную помощь в диагностике оказывают анамнестические сведения о контакте со свинцом (например, литье дроби, игрушек, употребление молока или квашеных овощей, хранившихся в глиняной посуде кустарного производства, глазурь которых нередко содержит свинец).
Лечение проводят комплексонами под контролем уровня выводимого свинца и дельта-аминолевулиновой кислоты в моче. При эффективной терапии ее содержание в моче нормализуется.
Мегалобластные анемии - группа анемий, общим признаком которых служит обнаружение в костном мозге своеобразных эритрокариоцитов со структурными ядрами, сохраняющими эти черты на поздних стадиях дифференцировки (результат нарушения синтеза ДНК и РНК в клетках, называемых мегалобластами), в большинстве случаев мегалобластная анемия характеризуется цветовым показателем выше единицы. Поскольку синтез нуклеиновых кислот касается всех костномозговых клеток, частыми признаками болезни являются уменьшение числа тромбоцитов, лейкоцитов, увеличение числа сегментов в гранулоцитах.
Анемии, связанные с дефицитом витамина B12 независимо от причин этого дефицита характеризуются появлением в костном мозге мегалобластов, внутрикостномозговым разрушением эритроцитов, гаперхромной макроцитарной анемией, тромбоцитопенией и нейтропенией, атрофическими изменениями слизистой оболочки желудочно-кишечного тракта и изменениями нервной системы в виде фуникулярного миелоза.
Этиология, патогенез. Идиопатическая форма B12-дефицитной анемии (пернициозная анемия) развивается в результате недостаточного поступления в организм экзогенного цианокобаламина (витамина В12), встречается преимущественно у лиц пожилого возраста. Патогенез дефицита витамина В12 чаще связан с нарушением выработки гликопротеина, соединяющегося с пищевым витамином В12 и обеспечивающего его всасывание (внутренний фактор). Нередко первые признаки заболевания появляются после перенесенного энтерита, гепатита. В первом случае это связано с нарушением всасывания витамина В,, в тонкой кишке, во втором - с расходованием его запасов в печени, являющейся основным депо витамина B12. Однако и тот и другой провоцирующий момент может играть роль пускового механизма лишь при уже ранее имевшемся скрытом дефиците этого витамина за счет нарушения секреции внутреннего фактора. Развитие В12-дефицитной анемии после тотальной гастрэктомии (когда полностью ликвидируется секреция внутреннего фактора) происходит через 5-8 лет и более после операции. В течение этого срока больные живут запасами витамина в печени при минимальном пополнении его за счет незначительного всасывания в тонкой кишке не соединенного с внутренним фактором витамина.
Весьма редкой формой В .12-дефицитной анемии является нарушение ассимиляции витамина при инвазии широким лентецом, когда паразит поглощает большое количество витамина В12. Причинами нарушенного всасывания витамина В12 при поражении кишечника могут быть тяжелый хронический энтерит, терминальный илеит, дивертикулез тонкого кишечника, возникновение слепой петли тонкой кишки после операции на ней.
В возникновении дефицита витамина в последних случаях важную роль играет его поглощение избыточно развившейся кишечной микробной флорой.
К редкой форме дефицита витамина В12 относится рецессивно наследуемый синдром Имерслунд- Гресбека с поражением эпителия кишечника, почек, кожи. Болезнь развивается у детей и характеризуется сочетанием мегалобластной анемии с поражением почек. Изредка болезнь бывает у взрослых.
Одной из причин нарушенного выделения внутреннего фактора может быть хроническая алкогольная интоксикация, когда она сопровождается токсическим поражением слизистой оболочки желудка. Причина возникновения наиболее распространенной идиопатической формы болезни не совсем ясна, хотя для многих случаев может быть доказана наследственная природа (рецессивное наследование).
Симптомы, течение, диагноз. Клиническая картина дефицита витамина В12 характеризуется поражением кроветворной ткани, пищеварительной и нервной систем. Отмечаются слабость, утомляемость, сердцебиение при физической нагрузке. Один из характерных признаков -фуникулярный миелоз. Желудочная секреция угнетена, возможна стойкая ахлоргидрия. Нередко наблюдаются признаки глоссита - "полированный" язык, ощущение жжения в нем. Кожа больных иногда слегка желтушна, в сыворотке крови увеличен уровень непрямого билирубина (за счет повышенной гибели гемоглобинсодержащих мегалобластов костного мозга). Определяется небольшое увеличение селезенки, реже печени.
Картина крови: резко выраженный анизоцитоз эритроцитов наряду с очень крупными (более 12 мкм в диаметре) клетками-мегалоцитами, резчайший пойкилоцитоз, повышенное насыщение эритроцитов гемоглобином - гиперхромия, появление полисегментированных нейтрофилов, гиперхромный, реже нормохромный характер анемии, тромбоцитопения, лейкопения. Степень цитопении может быть различной, редко отмечается параллелизм в снижении уровня всех трех форменных элементов крови. Решающее значение в диагностике принадлежит исследованию костного мозга, которое обнаруживает резкое увеличение в нем числа элементов эритроидного ряда с преобладанием мегалобластов. Описанная картина относится кдалеко зашедшим состояниям.
Часто В12-дефицитная анемия определяется лишь по картине крови у больных без каких-либо жалоб: отмечаются умеренная, обычно гиперхромная анемия, лейкопения, тромбоцитопения (иногда либо тромбоцитопения, либо лейкопения). Полисегментация ядер нейтрофилов, резко выраженные изменения формы эритроцитов могут отсутствовать. В костном мозге во всех случаях находят большой процент мегалобластов. Однако если больной за несколько дней до пункции костного мозга получил инъекцию витамина В12 то ме-галобластоз костного мозга может либо оказаться не очень резко выраженным, либо отсутствовать вовсе. Следовательно, во всех случаях нормохромной или гиперхромной анемии, сопровождающейся лейко- и тромбоцитопенией (признак необязательный), необходимо помнить важнейшее правило: проводить пункцию костного мозга до назначения витамина В. ,,.
Клетки красного ряда, очень напоминающие мегалобласты, могут встречаться при остром эритромиелозе, который, как и В12-дефицитная анемия, сопровождается небольшой желтушностью, часто сочетается с лейко- и тромбоцитопенией. Однако при этом лейкозе нет столь выраженного анизо- и пойкилоцитоза, как при В12-дефицитной анемии, а главное-в костном мозге наряду с мегалобластоподобными клетками встречаются в большом количестве миелобласты или недифференцируемые бласты. В сомнительных случаях следует после пункции костного мозга начать терапию витамином В12, которая при В12-дефицитной анемии через 8-10 дней приведет к резкому возрастанию в крови процента ретикулоцитов (рецикулоцитарный криз), подъему уровня гемоглобина, исчезновению в крови выраженного анизоцитоза, а в костном мозге - мегалобластов. При остром эритромиелозе введение витамина В12 не может изменить ни картину крови, ни состояние больного.
Установление причины дефицита витамина В12-следующий этап диагностики. Надо иметь в виду, что иногда дефицит витамина В12 сочетается с раком желудка, так как рак желудка несколько чаще возникает у лиц, страдающих этой формой анемии. Наряду с проведением всех обязательных исследований (для исключения инвазии широким лентецом, энтерита и т. п. ) необходимо убедиться с помощью гастрокопии или рентгенологического исследования в отсутствии рака желудка.
Лечение. Цианокобаламин (витамин В12) вводят ежедневно п/к в дозе 200-500 мгк 1 раз в день в течение 4-6 нед. После нормализации кроветворения и состава крови, наступающей через 1,5-2 мес, витамин вводят 1 раз в неделю в течение 2-3 мес, затем в течение полугода 2 раза в месяц (в тех же дозах, что и в начале курса). В дальнейшем больных следует поставить на диспансерный учет; профилактически им вводят витамин В12 1-2 раза в год короткими курсами по 5-6 инъекций. Эта рекомендация может быть изменена в зависимости от динамики показателей крови, состояния кишечника, функции печени.
Диагностику заболевания, самым сложным элементом которой является костномозговая пункция, и лечение витамином В12 можно провести в амбулаторных условиях. Длительность нетрудоспособности определяется выраженностью анемии и неврологическими нарушениями. Стойкой утраты трудоспособности при этом заболевании практически не бывает. Опасным, угрожающим жизни осложнением дефицита витамина В12 является развитие комы. Чаще это состояние наблюдается в глубокой старости улиц, которым задолго до этого осложнения исследовали периферическую кровь или вообще не проверяли кровь десятки лет. Старикам, стационируемым в коматозном состоянии, после установления низкого уровня гемоглобина необходимо немедленно произвести стернальную пункцию, окрасить мазок и, увидев картину В12-дефицитной мегалобластной анемии, начать введение больших доз витамина; переливание эритроцитной массы начинают только при выявлении низкого уровня гемоглобина.
Фапиево-дефицитная анемия-мегалобластная анемия, сходная в основных проявлениях с В12-дефицитной анемией; развивается при дефиците фолиевой кислоты. Нарушение всасывания фолиевой кислоты наблюдается у беременных, страдающих гемолитической анемией или злоупотреблявших алкоголем до беременности, у недоношенных детей, особенно при вскармливании их козьим молоком, у лиц, перенесших резекцию тонкой кишки, при тропической спру и целиакии, у страдающих алкоголизмом, а также при длительном приеме противосудорожных препаратов типа фенобарбитала, дифенина. Клиническая картина, картина крови и костного мозга аналогичны таковым при дефиците витамина В12, но обычно не бывает глоссита и фуникулярного миелоза.
Диагноз фолиево-дефицитной анемии можно достоверно установить по снижению уровня фолиевой кислоты в эритроцитах и сыворотке крови. В практической работе это трудно осуществимо. Обнаружение мегалобластного характера анемии при описанных выше состояниях является достаточным основанием для назначения фолиевой кислоты в дозе 5-15 мг/сут внутрь (такая доза обеспечивает лечебный эффект даже после резекции тонкой кишки, при энтеритах и т. п. ). Ретикулоцитарный подъем через 1,5-2 нед лечения свидетельствует о правильности диагностики. Профилактика фолиево-дефицитной анемии заключается в назначении фолиевой кислоты лицам, перенесшим ее дефицит однажды и страдающим одним из состояний, описанных выше. Фолиевую кислоту следует назначать беременным, болеющим гемолитической анемией.
Кроме описанных, встречаются рецессивно наследуемые формы мегалобластных анемий, когда анемия наряду с другими признаками встречается у детей и не поддается лечению витамином В12 и фолиевой кислотой. Эти больные должны обследоваться в специализированных учреждениях.
Гемолитические анемии связаны с усиленным разрушением эритроцитов. Все гемолитические состояния характеризуются увеличением в крови содержания продуктов распада эритроцитов - билирубина или свободного гемоглобина или появлением гемосидерина в моче. Важный признак-значительное нарастание в крови процента "новорожденных" эритроцитов - ретикулоцитов за счет повышения продукции клеток красной крови. Костный мозг при гемолитических анемиях характеризуется значительным увеличением числа клеток красного ряда.
Наследственный микросфероцитоз
Этиология, патогенез. Болезнь наследуется по доминантному типу. В основе гемолиза лежит дефект структуры мембраны эритроцитов, что вызывает ее повышенную проницаемость и способствует проникновению внутрь эритроцитов избытка натрия и накоплению воды. Эритроциты приобретают сферическую форму, повреждаясь при прохождении через узкие пространства синусов селезенки. Поврежденные клетки захватываются макрофагами (внутриклеточный гемолиз); превращение в них гемоглобина в билирубин ведет к непрямой гипербилирубинемии, желтухе.
Клиническая картина. Внутриклеточный распад эритроцитов определяет клинические проявления болезни- желтуху, увеличение селезенки, анемию, склонность к образованию камней в желчном пузыре, характерные морфологические изменения эритроцитов, ретикулоцитоз. Первые клинические проявления болезни могут быть в любом возрасте, хотя в действительности она начинается с рождения. Весьма редкий и неспецифический признак болезни - образование трофических язв на голенях. Длительно, с раннего детства, существующий гемолиз сопровождается гиперплазией костного мозга, что в свою очередь ведет к нарушению костеобразования. Отмечаются деформация челюстей с неправильным расположением зубов, высокое небо, выступающий лоб, легкая микрофтальмия и т. п. Селезенка пальпируется всегда.
Картина крови: микросфероцитоз эритроцитов, высокий ретикулоцитоз, обычно исчисляемый десятками процентов, нормохромная анемия разной выраженности, иногда число эритроцитов и гемоглобин нормальные. В период гемолитического криза возможен нейтрофильный лейкоцитоз. Очень резко возникают так называемые арегенераторные кризы, когда повышенный гемолиз в течение нескольких дней не сопровождается эритропоэзом; ретикулоциты исчезают из крови, быстро нарастает анемия, уровень билирубина падает. Сфероцитозу эритроцитов соответствует их пониженная осмотическая стойкость. Средний диаметр эритроцитов уменьшается, соответственно увеличивается их толщина, в связи с чем в большинстве клеток не видно центрального просветления, так как эритроцит из двояковогнутого превращается в шаровидный.
Диагноз. Желтуха, увеличенная селезенка, сфероцитоз эритроцитов, их пониженная осмотическая стойкость, высокий ретикулоцитоз, деформация лицевого черепа и увеличение селезенки делают диагноз наследственного сфероцитоза несомненным. Как правило, аналогичные симптомы удается обнаружить у одного из родителей больного, хотя их выраженность может быть иной. В редких случаях родители совершенно здоровы. Трудности диагностики часто обусловлены желчнокаменной болезнью, обычно сопровождающей наследственный микросфероцитоз (из-за образования в протоках и желчном пузыре билирубиновых камней). Свойственная гемолизу непрямая билирубинемия при холелитиазе сменяется прямой - возникает механическая желтуха. Болезненность в области желчного пузыря, некоторое увеличение печени - обычные признаки при наследственном микросфероцитозе. Нередко в течение многих лет больных ошибочно рассматривают как лиц, страдающих заболеванием желчевыводящих путей или печени. Одним из источников ошибок является отсутствие сведений о ретикулоцитах.
Сфероцитоз эритроцитов и другие признаки гемолиза (желтуха, увеличение селезенки, ретикулоцитоз) встречаются и при аутоиммунных гемолитических анемиях. Однако в отличие от наследственного микросфероцитоза при них не бывает изменений лицевого черепа, признаков наследственного микросфероцитоза у кого-либо из родителей; при первых клинических проявлениях аутоиммунного гемолиза еще не отмечается существенного увеличения селезенки, болезненности в области желчного пузыря, но анизоцитоз и пойкилоцитоз эритроцитов выражены больше, чем при микросфероцитозе. В сомнительных случаях необходимо ставить пробу Кумбса, которая бывает положительной (прямая проба) в большинстве случаев аутоиммунной гемолитической анемии и отрицательной при наследственном микросфероцитозе. Характерные для наследственного микросфероцитоза изменения выявляются в кислотной эритрограмме: обнаруживаются резкое увеличение устойчивости эритроцитов к действию хлористоводородной кислоты с типичной кривой их лизиса во времени, уменьшение их стойкости после отмывания.
Лечение. Радикальный метод - спленэктомия, показанная при выраженном гемолизе, анемии, желчнокаменной болезни, трофических язвах голени. У детей спленэктомию желательно проводить в возрасте после 7-8 лет, однако выраженная анемия, тяжелые гемолитические кризы являются прямым показанием к операции в любом возрасте. После операции наступает практическое выздоровление у всех больных, хотя остаются сфероцитоз эритроцитов и весьма небольшие признаки повышенного гемолиза. При калькулезном холецистите одновременно со спленэктомией может быть произведена холецистэктомия. При арегенераторных кризах переливают эритроцитную массу, иногда назначают преднизолон в дозе 40-60 мг в день.
Наследственный овалоцитоз (эллиптоцитоз)-доминантно наследуемая аномалия эритроцитов, иногда осложняющаяся повышенным гемолизом. У большинства носителей аномалии признаков повышенного гемолиза нет. Клиническая картина болезни при гемолизе соответствует наследственному микросфероцитозу. Диагноз устанавливают на основании овалоцитоза большинства эритроцитов и признаков внутриклеточного гемолиза (желтуха, ретикулоцитоз, увеличение селезенки).
Лечение. При выраженном гемолизе - спленэктомия.
Наследственный стоматоцитоз-доминантно наследуемая аномалия формы эритроцитов, иногда осложняющаяся внутриклеточным гемолизом. Сама по себе аномалия протекает бессимптомно.
Патогенез гемолитического синдрома, по-видимому, аналогичен таковому при наследственном сфероцитозе.
Клиническая картина гемолитического синдрома характеризуется желтухой, ретикулоцитозом, увеличением селезенки. Специфическая особенность эритроцитов при этом заболевании -две своеобразные соединяющиеся по краям клетки линии в области центрального просветления эритроцита. Они придают ему форму рта, отсюда и название аномалии.
Лечение. При выраженном гемолитическом синдроме - спленэктомия.
Гемолитические анемии, обусловленные дефицитом глюкозо-6-фосфатдегидрогэназы (Г-6-ФДГ). Болезнь широко распространена в ряде стран Азии и Африки. В СССР встречается в Азербайджане, реже в других республиках Закавказья, спорадически - повсеместно. Ген, регулирующий синтез Г-6-ФДГ, располагается в Х-хромосоме. Нарушения в структуре этого гена, ведущие к дефициту фермента, встречаются преимущественно у мужчин. Генетические нарушения в данном структурном гене варьируют довольно широко: активность фермента в одних случаях лишь слегка ниже нормальной, в других-почти отсутствует. Весьма разнообразны патологические процессы, связанные с дефицитом Г-6-ФДГ. Клинически они проявляются гемолитическими кризами в ответ на прием некоторых лекарств, употребление в пищу конских бобов, но возможен и хронический гемолитический процесс, обостряющийся под влиянием тех же провоцирующих воздействий.
Патогенез повышенного гемолиза при дефиците Г-6-ФДГ не совсем ясен. Нарушение восстановительных процессов в эритроците ведет к окислению гемоглобина, выпадению в осадок цепей глобина, повышенному разрушению таких эритроцитов в селезенке.
Клиническая картина. Гемолитический криз при дефиците Г-6-ФДГ характеризуется появлением темной мочи (гемосидерин и свободный гемоглобин в моче), небольшой желтухой на 2-3-й день приема медикамента, спровоцировавшего гемолиз. Дальнейший прием этого лекарства ведет к тяжелому внутрисосудистому гемолизу с повышением температуры тела, болью в костях рук и ног, в тяжелых случаях - падением АД, анемической комой. В крови-нейтрофильный лейкоцитоз (иногда очень высокий) со сдвигом до миелоцитов, выраженная анемия, высокий ретикулоцитоз. Моча темно-бурого цвета. Уровень билирубина умеренно повышен за счет непрямого. Провокаторами гемолиза являются хинин, акрихин, примахин, сульфаниламиды (в том числе и противодиабетические средства), нитрофураны, производные 8-оксихинолина. (нитроксолин и др. ), налидиксовая кислота (невиграмон), изониазид (тубазид), фтивазид, ПАСК, антипирин, фенацетин, амидопирин, ацетилсалициловая кислота, викасол. Этими препаратами, вероятно, не исчерпывается список провокаторов гемолитического криза при дефиците Г-6-ФДГ. Его уточнению мешает провоцирующая роль самой инфекции, ставшей причиной назначения лекарства. Поскольку тяжесть поражения связана с дозой препарата, его немедленная отмена ведет к стиханию гемолиза. Иногда отмечается временное прекращение гемолиза, несмотря на продолжающийся прием провоцировавшего медикамента (возможно, в связи с выходом в кровь большого числа повышенно стойких молодых форм эритроцитов). Тяжелый гемолитический криз может вызвать острый некронефроз с развитием тяжелой почечной недостаточности.
Особой формой болезни является тяжелый гемолитический криз у новорожденных, клиническая картина которого соответствует резус-конфликту.
Фавизм - развитие острого гемолитического синдрома у некоторых лиц с дефицитом Г-6-ФДГ в ответ на употребление с пищей конских бобов или попаданием в легкие пыльцы этого растения. Картина гемолитического криза соответствует описанной при приеме лекарств, но развивается раньше - уже через несколько часов после употребления этих бобов появляется тяжелый гемолиз с развитием почечной недостаточности. Гемолиз, спровоцированный цветочной пыльцой этих бобов, возникает через несколько минут после контакта с ней, протекает легко.
Наряду с гемолитическими кризами при дефиците Г-6-ФДГ возможен постоянный гемолиз с небольшой желтухой, умеренной анемией, повышением в крови процента ретикулоцитов, увеличением размеров селезенки. Воздействие описанных провоцирующих факторов, в том числе инфекции, усиливает гемолиз. Диагноз с достоверностью может быть поставлен лишь при использовании методов, определяющих активность Г-6-ФДГ в эритроцитах. В дифференцировке с иммунным гемолизом определенную помощь оказывает реакция Кумбса, особенно при гемопитической болезни новорожденного, когда нет несовместимости по резуо-антигену. Поскольку дефицит Г-6-ФДГ распространен в Закавказье, особенно в Азербайджане, гемолитический криз у этнических представителей этого региона всегда требует исключения данного заболевания. Хронические формы повышенного гемолиза необходимо дифференцировать прежде всего от талассемии, гемоглобинопатий, зона распространения которых совпадает с дефицитом Г-6-ФДГ.
Лечение. Отмена медикамента, вызвавшего гемолитический криз. Рибофлавин поО. 015 г2-3 раза вдень внутрь, эревит по 2 мл 2 раза в день в/м. При тяжелом гемолитическом кризе для предупреждения почечной недостаточности в/в медленно вводят 5% раствор гидрокарбоната натрия (реополиглюкин противопоказан при почечной недостаточности), фуросемид (лазикс)-по 40-60 мги более в/в повторно для усиления диуреза. При развитии анурии используют плазмаферез, при необходимости -гемодиализ. Тяжелый анемический синдром с начальными признаками анемической комы может быть основанием для переливания эритроцитов. В связи с тем, что иногда вопрос о гемотрансфузиях приходится решать до установления природы гемолитического криза, следует пользоваться отмытыми эритроцитами (лучше размороженными).
Профилактика. Тщательный сбор анамнеза. Каждый носитель дефекта должен быть снабжен списком противопоказанных ему лекарственных препаратов и осведомлен об опасности употребления в пишу конских бобов. Профилактические прививки носителям данного дефекта следует проводить лишь по строгим эпидемическим показаниям.
Талассемии- группа наследственных гемолитических анемий, характеризующихся выраженной гипохромией эритроцитов при нормальном или повышенном уровне железа в сыворотке крови. Часто повышено содержание билирубина в крови, отмечаются умеренный ретикулоцитоз, увеличение селезенки. В нашей стране болезнь распространена преимущественно в Азербайджане, реже встречается в Грузии, Армении, Таджикистане, Узбекистане; спорадические случаи могут быть повсеместно. При талассемии нарушается синтез одной из четырех цепей глобина. Наследование патологии от одного (гетерозиготность) или обоих родителей (гомозиготность), тип нарушенной цепи определяют выраженность клинических проявлений.
Патогенез повышенной гибели эритроцитов связан с нарушенной структурой клетки из-за неправильного соотношения цепей глобина в ней. Кроме укорочения жизни эритроцитов при талассемии происходит гибель эритрокариоцитов костного мозга - так называемый неэффективный зритролоэз.
Клиническая картина гомозиготной талассемии характеризуется тяжелой гипохромной анемией, резко выраженным анизоцитозом эритроцитов, наличием мишеневидных форм (вместо нормального просветления в центре определяется пятно гемоглобина, напоминающее мишень). Раннее начало гемопиза, сопровождающегося резкой гиперплазией костного мозга, ведет к грубым нарушениям лицевого черепа (квадратный, башенный череп, седловидный нос, нарушения прикуса, расположения зубов и т. п.). Рано начавшаяся анемия обусловливает физическое и умственное недоразвитие ребенка. Отмечается небольшая желтушность (за счет непрямого билирубина). Селезенка увеличена. Рентгенологически определяются утолщение и своеобразное строение губчатого слоя костей свода черепа: "волосатая" структура. Больные подвержены инфекционным заболеваниям. При тяжелой анемии дети умирают на первом году жизни. Встречаются и менее тяжелые формы гомозиготной талассемии, когда больные доживают до зрелого возраста.
Гетерозиготная талассемия может протекать с умеренной гипохромной анемией, небольшим ретикулоцитозом, легкой желтушностью, незначительным увеличением селезенки. Однако признаки повышенного гемолиза при гетерозиготном носительстве могут отсутствовать. Морфология эритроцитов аналогична описанной, хотя выраженность изменений при этом меньшая.
Картина крови при талассемиях характеризуется описанной выше морфологией эритроцитов, низким цветовым показателем. Число эритроцитов нормальное или слегка увеличенное, лейкограмма, число тромбоцитов не меняются. Диагностический признак-нормальные или повышенные цифры сывороточного железа.
Диагноз. Талассемия может быть заподозрена при обнаружении гипохромной анемии с резко выраженным анизоцитозом эритроцитов, их мишеневидностью (признак не абсолютно специфический), увеличением селезенки, нормальным уровнем сывороточного железа. Если при железодефи-цитной анемии прием препаратов железа сопровождается подъемом уровня ретикулоцитов в крови к середине или концу второй недели лечения, то при талассемии прием железа не меняет уровня ретикулоцитов. Форма талассемии может быть определена лишь при специальном исследовании цепей глобина.
Лечение тяжелых гомозиготных форм сводится к коррекции анемии с помощью переливаний эритроцитов в таком количестве, которое позволяет удерживать гемоглобин на уровне 85 г/л (так называемая супертрансфузия), выводя при этом избытки железа десфералом. Одним из рано применяемых методов терапии может быть трансплантация костного мозга. При тяжелом гемолизе и значительном увеличении селезенки показана спленэктомия, однако к ней редко приходится прибегать при талассемии.
Профилактика. Поскольку тяжелая гомозиготная форма болезни чаще встречается в браках кровных родственников, необходимо предупреждать такие браки.
Серповидно-клеточная анемия. В большой группе заболеваний, обусловленных нарушениями аминокислотного состава глобина,-гемоглобинопатий наиболее распространенной является серповидно-клеточная анемия. Болезнь встречается в двух формах: гомозиготной (тяжелой) и гетерозиготной; последняя осложняется анемическим кризом лишь в особых условиях кислородного голодания. Сама по себе аномалия структуры глобина (замена в бета-цепи глобина глутаминовой кислоты на валин) наследуется доминантно, однако клинически яркие проявления болезни возникают лишь у гомозигот, т. е. наследуются рецессивно. Серповидно-клеточная анемия распространена в Центральной Африке, спорадические случаи встречаются среди выходцев из Африки повсеместно; в СНГ очаги распространения серповидно-клеточной анемии отмечены в Закавказье.
Клиническая картина гомозиготной формы складывается из ранней тяжелой гемолитической анемии, имеющей нормохромный или гиперхромный характер. Физическая и некоторая умственная отсталость, связанная с рано развившимся и глубоким анемическим синдромом, сопровождается нарушениями скелета; дети худые с удлиненными конечностями, череп своеобразно деформированный, высокий, суженный, имеет часто утолщенный шов лобных частей в виде гребня. Характерны тромботические осложнения. Тромбозы сосудов, питающих кости, сопровождаются сильной болью в длинных трубчатых костях и суставах, их припухлостью. Наблюдаются асептические некрозы головок бедренной и плечевой костей. Нередко возникают тромбозы мезентериальных сосудов, инфаркты легких. Гемолитический криз обычно протекаете высокой температурой, выраженным нейтрофильным лейкоцитозом с омоложением формулы, тромбоцитозом. Массивный внутрисо-судистый гемолиз при кризе сопровождается выделением темной мочи, в которой определяется гемосидерин. Нередко встречаются язвы голеней. В начале болезни часто увеличена селезенка, в дальнейшем из-за повторных инфарктов она сморщивается и перестает пальпироваться. Печень также несколько увеличена.
Картина крови: нормохромная анемия, выраженный анизоцитоз эритроцитов, присутствие своеобразных форм, напоминающих полудиск, небольшое число мишеневидных эритроцитов. Настоящие серповидные эритроциты выявляются лишь при специальной пробе с метабисульфитом натрия, который, действуя как восстановитель, вызывает недостаток кислорода в эритроцитах, что ведет к кристаллизации гемоглобина в них и появлению серповидных форм. Снятие покровного стекла с препарата - доступ кислорода - ведет к восстановлению нормальной формы эритроцитов.
Клинические проявления гетерозиготной формы наблюдаются лишь при гемолитических кризах, спровоцированных аноксическими состояниями (полет в самолете без герметизации кабины, тяжелая пневмония, наркоз и т. п.). Криз сопровождается множественными тромботическими осложнениями. В крови анемия, нейтрофильный лейкоцитоз, тромбоцитоз. Эритроциты претерпевают те же изменения, что и при гомозиготной форме, та же проба выявляет серповидность. Электрофорез гемоглобина при гомозиготной форме обнаруживает присутствие лишь S-гемоглобина, а при гетерозиготной - как S-, так и А-фракцию гемоглобина.
Лечение. В период гемолитического криза - госпитализация больного и согревание, так как при низкой температуре признаки серповидности выражены больше. Внутрь назначают ацетилсалициловую кислоту (в качестве дезагреганта и фактора, меняющего сродство гемоглобина к кислороду) в дозе 0,5 г 3 раза в день. При тяжелой анемии переливают эритроцитную массу.
Кроме серповидно-клеточной гемоглобинопатий, встречаются и другие аномалии гемоглобина, обычно дающие гемолитический синдром лишь в гомозиготном состоянии: отмечаются небольшая желтуха, увеличение селезенки, анизоцитоз и иногда мишеневидность эритроцитов, ретикулоцитоз. Электрофорез гемоглобина позволяет уточнить характер гемоглобинопатий. Может встречаться гетерозиготность двух патологических гемоглобинов или их сочетание с талассемией.
Гемолитические анемии при нестабильных гемоглобинах. Особую группу гемолитических анемий представляет носительство нестабильных гемоглобинов; их неустойчивость к воздействию окислителей, нагреванию возникает в результате замен аминокислот в альфа- или бета-цепи глобина. Болезни наследуются по доминантному типу, встречаются редко, гомозиготные формы отсутствуют.
Клиническая картина характеризуется гомолитическим синдромом (желтуха, ретикулоцитоз, анемия, увеличение селезенки). У одних больных гемолиз протекает почти бессимптомно, у других выражен. Анемия обычно нормохромная, отмечаются анизоцитоз, иногда тельца Гейнца, небольшая мишеневидность эритроцитов; встречается их базофильная пунктация. Последние два феномена позволяют предполагать носительство нестабильного гемоглобина.
Диагноз. При воздействии на эритроциты различных окисляющих агентов, например бриллиантового крезилового синего, нестабильный гемоглобин подвергается денатурации и выпадает в осадок в виде мелких круглых включений. В ряде случаев проверяется термостабильность эритроцитов.
Лечение разработано недостаточно; при спленомегалии и выраженном гемолитическом синдроме спленэктомия в большинстве случаев несколько уменьшает интенсивность гемолиза.
Пароксизмальная ночная гемоглобинурия (ПН Г, болезнь Маркьяфавы-Микеле, пароксизмальная ночная гемоглобинурия с постоянной гемосидеринурией, болезнь Штрюбинга - Маркьяфавы) - своеобразная приобретенная гемоли-тическая анемия, протекающая с постоянным внутрисосудистым гемолизом, гемосидеринурией, угнетением грануло и тромбоцитопоэза.
Патогенез болезни связан с внутрисосудистым разрушением эритроцитов, дефектных в значительной своей части. Наряду с патологической популяцией эритроцитов сохраняется и часть нормальных клеток, имеющих нормальный срок жизни. Обнаружены нарушения в структуре гранулоцитов и тромбоцитов. Болезнь не является наследственной, но какие-либо внешние факторы, провоцирующие образования дефектной популяции клеток, которая является клоном, т. е. потомством одной первоначально измененной клетки, не известны. Тромботические осложнения при ПНГ связаны с внутрисосудистым гемолизом, провоцирующим тромбообразование. Происхождение важного, но далеко не обязательного признака болезни - пароксизмов гемоглобинурии ночью или утром - остается неясным. Пароксизм связан не со временем суток, а со сном, который днем также может вызвать криз. Отмечается повышенная комплементчувствительность патологических эритроцитов при ПНГ. Возможно, именно это является основой для провокации гемолитического криза переливанием свежей крови, в которой содержатся факторы, активирующие комплемент. Переливание крови, хранившейся более недели, гемолиз не провоцирует.
Клиническая картина. Заболевание развивается медленно: появляются признаки умеренной анемии, слабость, утомляемость, сердцебиение при нагрузке, боль в животе, нередко связанная с тромбозом мезентериальных сосудов. Кожа и слизистые оболочки бледно-желтушные, сероватые в связи с анемией и отложением гемосидерина. Характерны признаки внутрисосудистого гемолиза. Появление черной мочи - непостоянный признак. Поскольку ПНГ часто сопровождается лейкопенией (преимущественно за счет гранулоцитопении), возможны хронические инфекционные осложнения. Тромбоцитопения может осложниться геморрагическим синдромом. Длительное выделение с мочой гемоглобина и гемосидерина постепенно ведет к развитию железодефицитного состояния - возникает астенический синдром, появляются сухость кожи, ломкость ногтей.
Картина крови характеризуется вначале нормохромной, а затем гипохромной анемией, небольшим ретикулоцитозом (2-4% и более), лейкопенией и тромбоцитопенией. Морфология эритроцитов не имеет характерных признаков. В костном мозге наблюдается гиперплазия красного ростка, но в трепанате отмечается незначительное увеличение клеточности костного мозга, который по мере развития болезни может стать гипопластичным. В связи с постоянно текущим внутрисосудистым гемолизом в плазме повышено содержание свободного гемоглобина (в норме менее 0,05 г/л). Уровень сывороточного железа вначале нормален, затем может быть значительно снижен. Наряду с типичным началом болезни, когда преобладает гемолитический синдром, возможно развитие картины апластического синдрома, который через несколько лет может осложниться гемолитическим кризом с типичной ночной гемоглобинурией. Чаще гемолитический криз провоцирует переливание крови.
Диагноз устанавливают на основании признаков внутрисосудистого гемолиза (анемия, небольшой ретикулоцитоз, гемосидерин в моче). Уточняют диагноз специальными исследованиями (положительная сахарозная проба, проба Хема, отрицательная проба Кумбса).
Похожая по внешним проявлениям на ПНГ гемолизиновая форма аутоиммунной гемолитической анемии, протекающая с внутрисосудистым гемолизом, характеризуется наличием гемолизинов в сыворотке крови, положительной пробой Кумбса. В отличие от ПНГ при ней нет лейкопении и тромбоцитопении, обычно хороший эффект дает преднизолон. Отличить от апластической анемии ПНГ позволяет картина костного мозга: при аплазии трепанат характеризуется преобладанием жира, при гемолизе- клеточной гиперплазией, однако в редких случаях ПНГ может развиться картина гипоплазии костного мозга, хотя в моче постоянно обнаруживают гемосидерин, а в крови - ретикулоцитоз.
Лечение при отсутствии выраженной анемии не проводится. Тяжелый анемический синдром требует переливания эритроцитов; наилучшие результаты дает переливание отмытых пли выдержанных в течение 7-10 дней эритроцитов. При гипоплазии кроветворения показаны анаболитические стероиды: неробол по 10-20 мг в день или ретаболил по 50 мг в/м в течение 2-3 нед. Применяют препараты железа, но они могут иногда провоцировать гемолитический криз. Для предупреждения криза железо назначают в малых дозах на фоне лечения анаболическими стероидами. При тромбозах показан гепарин: при первой инъекции в/в вводят 10 000 ЕД, затем по 5000-10 000 ЕД 2-3 раза в день под кожу живота (тонкой иглой на глубину 2 см в жировую клетчатку) под контролем свертывания крови. Противопоказания к лечению гепарином - недавнее обострение язвенной болезни желудка или двенадцатиперстной кишки, а также наличие источников кровотечения.
Иммунные гемалитические анемии развиваются под воздействием антител на эритроциты. Основные формы иммунных гемолитических анемий: 1) аутоиммунные, обусловленные появлением в организме антител против собственных эритроцитов; 2) гаптеновые, вызванные фиксацией на эритроцитах чуждых для организма антигенов - гаптенов (лекарства, вирусы и т. п. ) с антителами, образованными в ответ на соединение гаптена с белком организма; 3) изоиммунные, связанные с попаданием в организм новорожденного антител матери, направленных против эритроцитов ребенка (при несовместимости ребенка и матери по Rh-антигену и гораздо реже по антигенам системы АВО).
Аутоиммунные геополитические анемии. В основе патологического процесса лежит срыв иммунолитической нечувствительности к собственному антигену.
Клиническая картина болезни складывается из признаков анемического синдрома; тяжесть состояния больных определяется выраженностью и остротой развития анемии. При хроническом, медленно развивающемся процессе первым признаком болезни может быть небольшая желтуха (за счет непрямого билирубина); одновременно выявляется и анемия. В других случаях начало болезни характеризуется бурным гемолизом с быстро нарастающей анемией и желтухой. Нередко повышается температура тела. Часто увеличивается селезенка. Возможно увеличение печени за счет холелитиаза, жировой дистрофии. Обычно выслушивается функциональный систолический шум на верхушке и на основании сердца, нередко определяется раздвоение II тона.
Картина крови характеризуется нормохромной анемией (при остром гемолизе уровень гемоглобина может падать до катастрофических цифр, больной может впадать в анемическую кому). Морфология эритроцитов существенно не меняется, но иногда отмечается их микросфероцитоз, что требует дифференцировки от наследственного микросфероцитоза. При остром гемолизе в крови могут определяться единичные эритрокариоциты. Уровень ретикулоцитов высок. Белая кровь существенно не меняется, но гемолитический криз может сопровождаться непродолжительным нейтрофильным лейкоцитозом (назначение стероидных гормонов при гемолизе может сопровождаться очень высоким нейтрофильным лейкозом со сдвигом до промиелоцитов). Число тромбоцитов обычно нормальное. Однако встречается аутоиммунный цитолиз, касающийся двух ростков - тромбоцитарного и эритроцитарного (синдром Ивенса - Фишера). В этом случае клинически определяются признаки гемолитической анемии и тромбоцитопенической пурпуры. Костный мозг при аутоиммунной гемолитической анемии характеризуется раздражением красного ростка (при сочетании гемолиза с тромбоцитопенией в костном мозге отмечается высокий мегакариоцитоз), но нередко можно встретить высокий процент ретикулярных клеток - своеобразных элементов с грубоструктурным ядром с нуклеолой и широкой цитоплазмой, содержащей скудную азурофильную зернистость. Биохимические исследования обнаруживают, помимо гипербилирубинемии, увеличение содержания гамма-глобулинов, которые в отдельных случаях могут иметь моноклоновый характер.
Прогнозировать течение гемолитического процесса невозможно, дозу назначаемых стероидных гормонов приходится нередко повышать (первая доза - обычно 60 мг в день), если нет ответа на первую. Заболевание может проявиться единственным эпизодом гемолиза либо принять хроническое течение.
Наряду с этой наиболее частой формой аутоиммунной гемолитической анемии, при которой поврежденные аутоантителами эритроциты поглощаются макрофагальными клетками селезенки (внутриклеточный гемолиз), встречается форма болезни с внутрисосудистым гемолизом. Отличительная особенность при этом -выделение темной мочи за счет гемоглобинурии и гемосидеринурии. При тяжелом гемолизе возможны тромбозы в системе мезентериальных сосудов с появлением сильной приступообразной боли в животе и вздутием его за счет пареза кишечника. Как правило, тромбируются мелкие сосуды и гангрена кишечника не развивается, в оперативном вмешательстве потребность не возникает. Иногда может отмечаться внутрисосудистый гемолиз в ответ на охлаждение (холодовая гемоглобинурия). Эта форма гемолитической анемии связана с действием гемолизинов сыворотки крови на эритроциты больного.
Изредка (в основном улиц пожилого возраста) встречаются формы внутриклеточного гемолиза, вызванного холодовыми агглютининами к эритроцитам. Провокатором такого гемолиза обычно является резкое охлаждение. Заболевание приобретает хроническое течение. Больные, как правило, плохо переносят холод; возможно развитие гангрены пальцев после длительного пребывания на холоде. Специфическим признаком данного процесса является аутоаглютинация эритроцитов во время взятия крови при комнатной температуре, что может помешать определению уровня эритроцитов и СОЭ. Кровь может агглютинировать в мазке, в пробирке. При подогревании агглютинация исчезает. В сыворотке крови больных при определении белковых фракций находят градиент моноклональных иммуноглобулинов, относящихся к холодовым антитепам.
Диагноз аутоиммунной гемолитической анемии устанавливают на основании общих признаков гемолиза (повышение уровня билирубина в крови или появление гемосидерина в моче, повышение процента ретикулоцитов в крови и обнаружение аутоантител на поверхности эритроцитов с помощью пробы Кумбса, которая бывает положительной почти в 60% случаев аутоиммунного гемолиза). Более высокий процент положительных находок дает агрегатгемагтлютинационная проба. Обе пробы могут быть поставлены в специализированных учреждениях. С диагностической цепью, но лишь в исключительных случаях, может быть проведена терапия стероидными гормонами, которые уменьшают или ликвидируют повышенный гемолиз в течение нескольких дней. Диагностику и разработку конкретной программы лечения при аутоиммунной гемолитической анемии осуществляют в условиях специализированного учреждения. Последующее лечение обычно проводят амбулаторно.
Лечение. Начинают терапию обычно с назначения 60 мг преднизолона (для взрослых) в день. При тяжелом гемолитическом процессе с бурно прогрессирующей анемией дозу преднизолона быстро увеличивают до 100-200 мг в день. Неэффективность стероидной терапии, выявляемая по нарастанию анемии, процента ретикулоцитов, может потребовать проведения спленэктомии уже в самом начале болезни. Обычно вопрос о сплензктомии приходится решать после нескольких месяцев консервативного лечения. По жизненным показаниям и при неэффективности спленэктомии назначают иммунодепрессанты (циклофосфан, азатиоприн, метотрексат и др. ). При тяжелом анемическом синдроме переливают подобранную по непрямой пробе Кумбса кровь или отмытые (лучше замороженные) эритроциты.
Апластические (гипопластические) анемии-группа заболеваний, характеризующихся нарастающим уменьшением содержания форменных элементов в периферической крови и костном мозге.
Этиология, патогенез. Различают апластические анемии с известной причиной и идиопатическую форму. В основе первых могут лежать токсическое воздействие некоторых медикаментов (например, левомицетина), химических веществ (например, бензола), аутоагрессия и появление антител к кроветворным клеткам в результате изменения их антигенной структуры под влиянием вирусной инфекции, медикаментов - гаптенов. Причины идиопатической апластической анемии неясны.
Клиническая картина сводится к нарастающей анемии, тромбоцито- и лейкоцитопении. Панцитопения сопровождается инфекционными осложнениями, повышенной кровоточивостью.
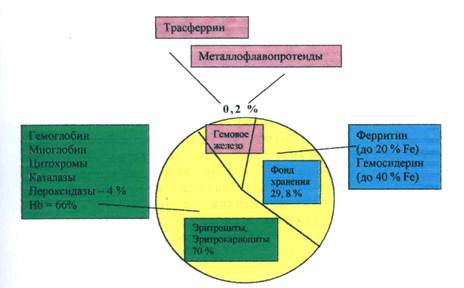
Железодефицитная анемия (ЖДА) – клинико–гематологический синдром, характеризующийся нарушением синтеза гемоглобина в результате дефицита железа, развивающегося на фоне различных патологических (физиологических) процессов, и проявляющийся признаками анемии и сидеропении.
Важность проведения рациональной и эффективной терапии ЖДА обусловлена медикосоциальным значением и высокой распространенностью данного состояния среди населения, особенно женщин детородного возраста, т.к: женщины детородного возраста составляют основную группу риска развития ЖДА запасы железа в организме женщин в 3 раза меньше, чем у мужчин потребление железа у девушек и фертильных женщин в развитых странах (США) составляет 55–60% от должного ЖДА составляет 75–95% всех анемий беременных в России около 12% женщин детородного возраста страдают ЖДА латентный дефицит железа в некоторых регионах России достигает 50%.
Диагностика железодефицитной анемии
Этапы диагностического поиска:
1 диагностика гипохромной анемии
2 диагностика железодефицитного характера анемии
3 диагностика причины ЖДА.
1. Диагностика гипохромной анемии. Все ЖДА являются гипохромными. Поэтому гипохромный характер анемии является ключевым признаком, позволяющим заподозрить в первую очередь ЖДА и определить дальнейшее направление диагностического поиска.
Врачклиницист при трактовке результатов анализа крови должен обязательно обращать внимание не только на цветовой показатель (может быть рассчитан неправильно при ошибке в подсчете лаборантом количества эритроцитов), но и на морфологическую картину эритроцитов, которая описывается врачомлаборантом при просмотре мазка (например, гипохромия, микроцитоз и т.д.).
2. Диагностика железодефицитного характера анемии (дифференциальный диагноз гипохромной анемии). Не все гипохромные анемии являются железодефицитными. С учетом этого наличие гипохромной анемии не исключает гипохромные анемии другого происхождения В связи с этим на данном этапе диагностического поиска необходимо проведение дифференциальной диагностики между ЖДА и так называемыми сидероахрестическими (ахрезия неиспользование) анемиями. При сидероахрестических анемиях (групповое понятие), обозначаемых также, как железонасыщенные анемии, содержание железа в организме находится в пределах нормы или даже имеется его избыток, однако в силу различных причин железо не используется для построения гема в молекуле гемоглобина, что в итоге ведет к образованию гипохромных эритроцитов с низким содержанием гемоглобина. Неиспользованное железо поступает в запасы, откладывается в органах и тканях (печень, поджелудочная железа, кожа, макрофагальная система и др.), приводя к развитию гемосидероза.
Правильно распознавать ЖДА и отличить ее от сидероахрестических анемий чрезвычайно важно, так как ошибочный диагноз ЖДА у больных железонасыщенными анемиями может повлечь за собой неоправданное назначение таким больным препаратов железа, что в данной ситуации приведет к еще большей "перегрузке" органов и тканей железом. При этом лечебный эффект от препаратов железа будет отсутствовать.
Основными гипохромными анемиями, с которыми следует проводить дифференциальный диагноз ЖДА, являются следующие:
анемии, связанные с нарушением синтеза гема, возникающие в результате угнетения активности некоторых ферментов (гемсинтетаза), обеспечивающих включение железа в молекулу гема. Этот ферментный дефект может иметь наследственную природу (наследственные сидероахрестические анемии) или возникать в результате воздействия некоторых медикаментов (изониазид, ПАСК и др.), хронической алкогольной интоксикации, контакта со свинцом и др.;
талассемия, относится к группе наследственных гемолитических анемий, связанных с нарушением синтеза глобина – белковой части гемоглобина. Заболевание имеет несколько вариантов и характеризуется признаками гемолиза (ретикулоцитоз, повышение уровня непрямого билирубина, увеличение селезенки), высоким содержанием железа в сыворотке и в депо, гипохромной анемией. Фактически при талассемии речь также идет о сидероахрезии, т.е. о неиспользовании железа, но не в результате дефектов ферментов, участвующих в синтезе гема, а вследствие нарушения процесса построения молекулы гемоглобина в целом из–за патологии глобиновой его части;
анемии, связанные с хроническими заболеваниями. Этим термином принято обозначать группу анемий, возникающих у больных на фоне различных заболеваний, чаще всего воспалительного характера (инфекционных и неинфекционных). Примером могут служить анемии при нагноительных заболеваниях различной локализации (легкие, брюшная полость, остеомиелит), сепсисе, туберкулезе, инфекционном эндокардите, ревматоидном артрите, злокачественных опухолях при отсутствии хронических кровопотерь. При всем многообразии патогенетических механизмов анемии в данных ситуациях одним из основных считается перераспределение железа в клетки макрофагальной системы, активирующейся при воспалительных и опухолевых процессах. Поскольку истинного дефицита железа при этих анемиях не наблюдается, более оправданно говорить не о ЖДА, а о железоперераспределительных анемиях. Последние носят, как правило, умеренно гипохромный характер, содержание железа в сыворотке может быть незначительно снижено, ОЖСС обычно в пределах нормы или умеренно снижена, что отличает этот вариант анемий от ЖДА. Характерно повышение уровня ферритина в крови. Понимание и правильная трактовка патогенетических механизмов развития анемий при вышеуказанных заболеваниях позволяют врачу воздерживаться от назначения этим больным препаратов железа, которые обычно малоэффективны.
Таким образом, о наличии ЖДА можно говорить в случаях гипохромной анемии, сопровождающейся снижением содержания сывороточного железа, повышением ОЖСС, снижением концентрации ферритина. Во избежание ошибок при трактовке результатов определения содержания железа в сыворотке необходимо учитывать следующие правила и рекомендации:
исследование должно проводиться до начала лечения препаратами железа. В противном случае, даже при приеме препаратов в течение короткого промежутка времени, полученные показатели не отражают истинного содержания железа в сыворотке. Если препараты железа были назначены, то исследование может проводиться не ранее чем через 7 дней после их отмены;
трансфузии эритроцитов, нередко проводимые до уточнения природы анемии (выраженное снижение уровня гемоглобина, признаки сердечной недостаточности и т. д.), также искажают оценку истинного содержания железа в сыворотке;
для исследования сыворотки на содержание железа должны использоваться специальные пробирки, дважды промытые дистиллированной водой, так как использование для мытья водопроводной воды, содержащей незначительные количества железа, влияет на результаты исследования. Для высушивания пробирок не следует использовать сушильные шкафы, так как с их стенок при нагревании в посуду попадает незначительное количество железа;
в настоящее время для исследования железа принято использовать в качестве реактива батофенантралин, образующий с ионами железа цветной комплекс со стойкой окраской и высоким молярным коэффициентом экстинкции; точность метода довольно высока;
кровь для анализа следует брать в утренние часы, так как имеют место суточные колебания концентрации железа в сыворотке (в утренние часы уровень железа выше);
на показатели содержания железа в сыворотке оказывают влияние фаза менструального цикла (непосредственно перед менструацией и во время нее уровень сывороточного железа выше), беременность (повышение содержания железа в первые недели беременности), прием оральных контрацептивов (повышение), острые гепатиты и циррозы печени (повышение). Могут наблюдаться случайные вариации исследуемых показателей.
3. Выявление причины ЖДА. После подтверждения железодефицитного характера анемии, т. е. верификации синдрома ЖДА, не менее важной задачей является установление причины данного анемического синдрома. Распознавание причины развития ЖДА в каждом конкретном случае является конечным этапом диагностического поиска. Ориентация на нозологическую диагностику очень важна, так как в большинстве случаев при лечении анемии можно воздействовать на основной патологический процесс.
В основе развития ЖДА лежат разнообразные причины, среди которых основное значение имеют следующие:
хронические кровопотери различной локализации (желудочнокишечные, маточные, носовые, почечные) вследствие различных заболеваний;
нарушение всасывания поступающего с пищей железа в кишечнике (энтериты, резекция тонкого кишечника, синдром недостаточного всасывания, синдром "слепой петли");
повышенная потребность в железе (беременность, лактация, интенсивный рост и др.);
алиментарная недостаточность железа (недостаточное питание, анорексии различного происхождения, вегетарианство и др.).
Лечение ЖДА
При выявлении причины развития ЖДА основное лечение должно быть направлено на ее устранение (оперативное лечение опухоли желудка, кишечника, лечение энтерита, коррекция алиментарной недостаточности и др.). Однако в целом ряде случаев радикальное устранение причины ЖДА не представляется возможным (например, при продолжающихся меноррагиях, наследственных геморрагических диатезах, проявляющихся носовыми кровотечениями, у беременных, а также при некоторых других ситуациях). В таких случаях основное значение приобретает патогенетическая терапия железосодержащими лекарственными препаратами.
Лекарственные препараты железа (ПЖ) являются средством выбора для коррекции дефицита железа и уровня гемоглобина у больных ЖДА. ПЖ следует предпочитать пищевым продуктам, содержащим железо
В настоящее время в распоряжении врача имеется большой арсенал лекарственных ПЖ, характеризующихся различным составом и свойствами, количеством содержащегося в них железа, наличием дополнительных компонентов, влияющих на фармакокинетику препарата, лекарственной формой.
В клинической практике лекарственные ПЖ применяются внутрь или парентерально. Путь введения препарата у больных ЖДА определяется конкретной клинической ситуацией. Кроме того, все железосодержащие препараты могут быть разделены на две группы препараты солей железа и препараты в виде железосодержащих комплексов, имеющие некоторые отличительные свойства (состав, фармакокинетика, переносимость и т.д.).
Похожие работы
... недостатком ведения больных с анемиями в терапевтической практике является констатация анемии без анализа компенсаторной активности эритропоэза. Оценка активности эритропоэза имеет значение как в диагностике анемии, так и при последующем анализе эффективности проводимой терапии. Имеются достаточно сложные методики определения активности эритропоэза. К ним относятся изучение распределения ...
... могут приводить кровотечения из почек и мочевых путей. Очень часто сопровождаются гематурией гипернефромы. В некоторых случаях кровопотери различной локализации, являющиеся причиной железодефицитной анемии, связаны с гематологическими заболеваниями (коагулопатиями, тромбоцитопениями и тромбоцитопатиями), а также с поражением сосудов при васкулитах, коллагенозах, болезни Рандю - Вебера - Ослера, ...
... (лизоцим, пропердин и т.д.), так и специфический иммунитет. Показано, что в отсутствие железа IgA теряет свою бактерицидную активность. - Сердечнососудистый синдром наблюдают при тяжёлой железодефицитной анемии. У детей развиваются повышенная утомляемость, низкое артериальное давление, тахикардия, снижение тонуса сердечной мышцы, приглушение тонов, функциональный, довольно грубый ...
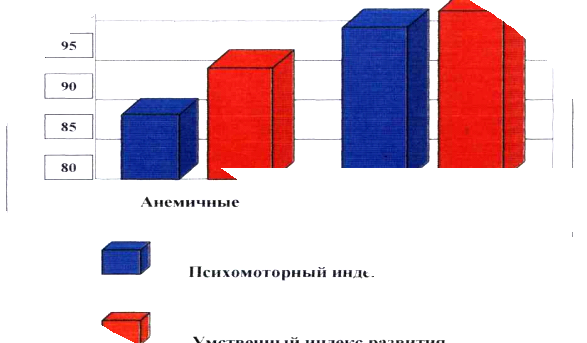
... . Особенно чувствительны к недостаточности железа дети в период введения прикорма (с 6 до 24 месяцев), когда они растут быстрыми темпами. На этот период приходится пик распространенности железодефицитной анемии у детей, который совпадает по времени с последней фазой рывка в развитии головного мозга, когда происходит развитие познавательных способностей и моторики. Данные, полученные в результате ...



0 комментариев