Навигация
Мета роботи: дослідним шляхом перевірити закон П.Л. Дюлонга і А.Г. Пті
1 Мета роботи: дослідним шляхом перевірити закон П.Л. Дюлонга і А.Г. Пті.
2Прилади і обладнання:
Алюмінієве, мідне і залізне тіла, масою 50-100 г
Калориметр
Термометр
Посуд з водою
Електроплитка
Важелі з важками
Мензурка (одна на всіх)
Загальні теоретичні положення
Молекули і атоми різних речовин перебувають у безперервному хаотичному (невпорядкованому) русі. У твердих тілах вони коливаються навколо положень рівноваги, тобто, вліво – вправо, вверх – вниз, вперед – назад та в різних напрямках. Це обумовлено існуванням у твердих тілах кристалічної решітки. У рідинах молекули та атоми рухаються коливально – обертально, тому що стикаються між собою та хаотично рухаються навколо один одного. У газах молекули та атоми рухаються поступально, а після зіткнення один з одним змінюють напрямок руху.
При нагріванні речовини збільшуються інтенсивність і середня швидкість руху молекул та атомів, але це відбувається для різних речовин по різному. Одна речовина швидше нагрівається, ніж інша, тому що вони мають різні маси у молекул, різні сили взаємодії між молекулами, атомами.
Температура є макропараметром, який характеризує інтенсивність руху великої кількості молекул, атомів. Чим більша температура – тим більші середні швидкості руху молекул та атомів і більша внутрішня (теплова) енергія тіла.
При теплообміні більш нагріте тіло (електроплита) передає теплову енергію менш нагрітому тілу (чайнику з водою). Або теплообмін відбувається між двома тілами з різними початковими температурами: у більш нагрітого тіла температура зменшується, а у менш нагрітого тіла температура збільшується. Коли їхні температури зрівняються, теплопередача зупиняється і наступає теплова рівновага.
Щоб визначити кількість теплоти Q, яку потрібно надати тілу масою m для його нагрівання від температури t1 до температури t2 використовують формулу:
![]() , (1)
, (1)
Питома теплоємкість речовини с – це кількість теплоти, яку надають тілу масою 1кг для його нагрівання на 1 0С.
Молярна теплоємкість речовини С – це кількість теплоти, яку надають тілу, яке складається з 6,02 1023 штук молекул або атомів ( це відповідає кількості речовини ν = 1 моль ) для його нагрівання на 1 0С.
Теплоємкість одного моля речовини називають його молярною теплоємкістю.
Молярна теплоємкість зв’язана з питомою теплоємкістю тої самої речовини:
![]() , (2)
, (2)
де М – молярна маса твердих речовин, ![]() ;
;
С - молярна теплоємкість твердих речовин, ![]() ;
;
с - питома теплоємкість твердих речовин, ![]() ;
;
Для твердих речовин молярні теплоємкості при постійному тиску Ср і при постійному об’ємі СV однакові, тому говорять просто про питому теплоємкість.
Як було встановлено П.Л. Дюлонгом і А.Г. Пті, молярна теплоємкість твердих одноатомних тіл майже однакова і дорівнює:
![]() , (3)
, (3)
де R= 8,31![]() – універсальна газова стала.
– універсальна газова стала.
Для деяких тіл з малою атомною масою, наприклад, берилію, бора, вуглецю (структури алмазу), молярну теплоємкість можна визначити і при високих температурах за законом Дюлонга і Пті. Навпаки, при охолоджені, для всіх тіл закон Дюлонга і Пті не дає точне визначення молярної теплоємкості, тобто, є відходження від закону.
При охолодженні теплоємкість всіх тіл зменшується. Ці твердження теорії можна перевірити. Для цього достатньо визначити кількість теплоти Q, яку віддає тверде тіло з відомими масами m і M при охолодженні в інтервалі температур ∆Т і скористатися формулою 5.
Калориметр складається з двох металевих циліндричної форми посудин, вставлених одна в одну. Велика посудина стоїть на дерев’яній підставці, а менша посудина стоїть на дерев’яній хрестовині. Відомо, що дерево і повітря погано проводять тепло, що заважає теплообміну з навколишнім середовищем.
Порядок виконання роботи4.1 Визначте за допомогою терезів і важків масу калориметра mк і маси m мідного, залізного і алюмінієвого тіл.
4.16 Опустіть тіло в посуд з киплячою водою.
4.17 За допомогою мензурки виміряйте і налийте у калориметр 100 мл води при кімнатній температурі. Виміряйте термометром початкову температуру води і калориметра t1.
4.18 Опустіть у калориметр тіло, нагріте до температури 100ºС, і визначте температуру t2 у калориметрі після встановлення теплової рівноваги між тілом, водою і калориметром.
Похожие работы
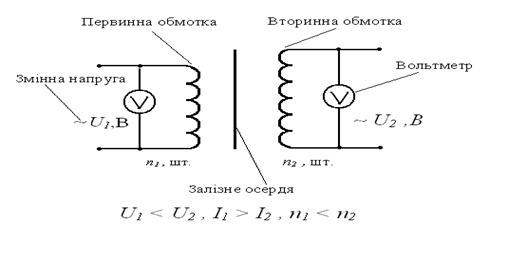
... ії: , (5) 4.4 За відомим коефіцієнтом трансформації: , (6) обчислити кількість витків n1 первинної обмотки: , (7) 4.5 Для визначення кількості витків у вторинній обмотці n2 знову приєднують трансформатор до джерела струму зробивши другу котушку первинною і залишивши додаткову котушку у місті ...
... вимірюється відношенням абсолютної вологості до кількості пари необхідної для насичення повітря за тієї самої температури. Висновок: на цьому уроці ми навчились вимірювати відносну вологість повітря. Практична робота № 2 Спостереження броунівського руху Мета: переконатись у тому, що речовина складається з дрібних частинок і ці частинки рухаються. Теоретичні дан ...
... Философия культуры. – М.: NOTA BENE, 2001. – 349 с. 5. Додельцев Р.Ф. Концепция культуры З. Фрейда. – М.: Знание, 1989. – 60 с. 6. Киссель М.А. Джамбаттиста Вико. – М.: Мысль, 1980. – 197 с. 7. Культурологія. Українська та зарубіжна культура: Навч. посібник (М.М.Закович, І.А.Зязюн, О.М.Семашко та ін.). – з вид. – К.: Знання, 2007. – 567 с. 8. Фрейд Зігмунд. Вступ до психоаналізу: Лекції ...


0 комментариев