Навигация
Неферментативная антиоксидантная система
1.2.1. Неферментативная антиоксидантная система
В качестве компонентов неферментативной АОС могут выступать низкомолекулярные вещества, имеющие высокую константу скорости взаимодействия с АФК.
Неферментативная АОС включает различные по химическому строению и свойствам соединения: водорастворимые – глутатион, аскорбат, цистеин, эрготионеин, и гидрофобные - a-токоферол, витамин А, каротиноиды, убихиноны, витамины группы К, которые снижают скорость образования свободных радикалов и уменьшают концентрацию продуктов реакций, протекающих с участием радикалов [Гуськов, Кения, Лукаш, 1993].
Основная направленность действия низкомолекулярных АО связана с защитой белков, нуклеиновых кислот, полисахаридов, а также биомембран от окислительного разрушения при свободнорадикальной процессах. Важное значение низкомолекулярные АО приобретают в условиях окислительного стресса, когда ферментативная АОС оказывается менее эффективной в сравнении с их протекторным действием. Причины этого – быстрая инактивация конститутивного пула ферментов свободными радикалами и значительное время, необходимое для индукции их синтеза [Зенков, Меньщикова, Шергин, 1993].
Гидрофобные (липидные) антиоксиданты
В липидах содержатся природные антиоксиданты (АО), существенно влияющие на скорость реакции обрыва цепей окисления. К гидрофобным АО фенольного типа относятся три группы веществ: токоферолы, убихиноны и витамины группы К. Каждое из этих веществ образует группу структурно-родственных соединений, включающую хиноны, хинолы, хроманолы и хроменолы [Смирнов, 1974; Рочинский, 1988]. В липидном бислое мембран эти формы могут переходить одна в другую. Каждая группа природных АО присутствует в липидах преимущественно в одной, наиболее стабильной для данных соединений форме: витамины группы К находятся в виде хинонов, токоферолы находятся в липидах, в основном, в циклической форме 6-оксихроманов как в виде свободного токоферола, так и в виде его эфиров, для убихинонов наиболее устойчивой является хинонная форма. Гидрохинонная форма убихинонов довольна нестабильна и окисляется кислородом воздуха, однако в клетках до 70% убихинона может находится в восстановленной форме. Более стабильными являются циклические формы – убихроменолы, не участвующие в процессе переноса электрона по дыхательной цепи. Предполагают, что эта форма выполняет в липидах роль АО.
Характерной особенностью вышеназванных соединений является наличие в их структуре боковых алифатических заместителей, состоящих из нескольких изопреноидных звеньев, различающихся степенью ненасыщенности [Бурлакова, Крашаков, Храпова, 1998].
В состав природных АО, содержащихся в липидах, входят восстановленные фенольные формы, активно реагирующие с пероксирадикалами липидов (ROO·) и окисленные хинонные формы, взаимодействующие с алкильными радикалами (R·) [Бурлакова, Храпова, 1985]. Значительным сродством к пероксирадикалам обладают витамины группы К и токоферол, константы скоростей реакций составляют 5,8*106 и 4,7*106 М-1с-1 соответственно. Убихинолы и убихроменолы в 10 раз менее активны, чем токоферолы [Бурлакова, Храпова, 1985]. Высокое сродство природных АО к пероксирадикалам обусловлено наличием в их молекулах лабильных гидроксильных групп, а длина и степень ненасыщенности боковых цепей не оказывает существенного влияния.
Хиноны легко реагируют с алкильными радикалами липидов (R·), доля которых в общем количестве свободных радикалов при ПОЛ велика, по механизму:
R· + Q ® RQ·; RQ· + R· ®RQR
и могут эффективно тормозить окисление.
Хиноны и их производные способны реагировать с АФК, в частности, хиноны способны связывать радикалы супероксид-аниона, участвующие в инициировании цепей свободнорадикального окисления липидов, с образование семихинонов. Вместе с тем предполагают, что убисемихиноны и убихиноны могут, подобно менасемихинону и менадиолу, реагировать с молекулярным кислородом с образованием супероксидных анион-радикалов.
Один и тот же АО в зависимости от концентрации может тормозить или ускорять окисление. Такие двойственные свойства по отношению к окислению липидов были установлены для токоферолов различного строения, витамина А и каротиноидов, соединений группы убихинона, ионов железа и аскорбиновой кислоты [Бурлакова, Храпова; 1985; Бурлакова, Крашаков, Храпова; 1998, Капитанов, Пименов, 1993].
В липидах биомембран всегда присутствуют несколько АО, изменяющих скорость окисления липидов. Между АО может наблюдаться эффект синергизма. Аскорбиновая кислота является синергистом по отношению к токоферолам. Восстанавливая радикалы токоферола до активной фенольной формы, аскорбиновая кислота увеличивает эффективность действия токоферола. Аналогичной способностью регенерировать токофероксильные радикалы обладают и убихинолы. Отдельные компоненты неферментативной АОС могут дополнять или подменять друг друга, осуществляя ингибирование на разной глубине окисления липидов [Бурлакова, Крашакова, Храпова, 1998].
Среди липидных мембранных АО фенольного типа ведущая роль принадлежит токоферолам, поскольку именно они находятся в липидах в устойчивой фенольной форме [Бурлакова, Храпова, 1985].
Реакция с пероксирадикалами липидов на стадии обрыва цепи не является единственно возможным путем воздействия токоферола на скорость ПОЛ. Токоферолы эффективно взаимодействуют с другими АФК (О2·, ·НО, НО2·,ROО·), выполняющих роль инициаторов окисления. Выводя из сферы реакции АФК, токоферолы тем самым снижают общую скорость окисления за счет уменьшения суммарной скорости инициирования. Токоферолы являются тушителями синглетного кислорода [Шинкарев, 1986].
Витамин Е представлен несколькими гомологами (a-, b-, g-, d- токоферолами) из которых наибольшей антиоксидантной активностью обладает a-токоферол [Айдарханов и др., 1989]. Эффективность действия a-токоферола, как природного аниоксиданта, обусловлена его исключительно высокой антирадикальной активностью (константа скорости его взаимодействия с перекисными радикалами составляет 3,1±0,3 ´ 106 л/моль с, что на 1 – 2 порядка выше соответствующих констант скоростей для многих известных синтетических и биоантиоксидантов) и стабилизацией липидного бислоя мембран путем образования прочных комплексов с полиеновыми жирными ацилами липидов [Бурлакова, Храпова, 1985; Козлов и др., 1983]. a-Токоферол взаимодействует с перекисными радикалами в качестве донора водорода: ROO· + a-Т-ОН ® ROOH + a-Т-О·. Радикал токоферола регенерируется аскорбатом.
Время полураспада a-токоферола, определенное с помощью изотопной метки варьирует от 5 дней в печени и эритроцитах до 30 дней в клетках головного мозга [Евстигнеев, Волков, Чудинова, 1998].
К гидрофобным антиоксидантам также относятся витамины группы А: А1 (ретинол), А2 и цис-форма витамина А1, отличающиеся дополнительными двойными связями в кольце b-ионона. Все соединения представляют собой циклический непредельный одноатомный спирт, состоящий из 6-членного кольца (b-ионон), двух остатков изопрена и первичной спиртовой группы. Всасывание происходит в кишечнике в присутствие липидов. В организме легко окисляются с образованием цис- (сетчатка глаза) и транс-альдегидов (остальные ткани); откладываются про запас в печени в форме более устойчивых сложных эфиров: ретинилпальмитат, ретинилацетат и ретинилфосфат. Известны также предшественники (провитамины) витамина А – каротины. Различают a-, b- и g-каротины. Наибольшей биологической активностью обладает b-каротин, поскольку он содержит два b-иононовых кольца и при расщеплении в кишечнике, и возможно в печени, при участие b-каротин-диоксигеназы, в присутствие молекулярного О2, из него образуются две молекулы витамина А. Повышенное содержание b-каротина в пищевом рационе и плазме крови оказывает профилактическое действие в отношении целого ряда заболеваний [Алимова, Аствацатурьян, 1975; Рябина, Калмыкова, 1997; Хохлова, Кудрина, 1996; Хазанов, 1997]. Существует предположение, что благодаря наличию двойных связей в молекуле, витамин А может участвовать в окислительно-восстановительных реакциях, поскольку он способен образовывать перекиси, которые в свою очередь увеличивают активность АО ферментов в клетке. Также предполагается участие витамина А в делении и дифференцировке клеток, обусловленного его действием на инициацию репликации; на рост костной ткани – участие в синтезе хондроитинсульфата [Зенков, Меньщикова, 1993]. Неотъемлемым является участие витамина А в фотохимическом акте зрения.
Гидрофильные антиоксиданты
Глутатион:
Глутатион – тиол небелковой природы, встречающийся во всех животных и растительных тканях, а также у ряда микроорганизмов [Меньшиков, Кения, 1993; Косовер, Косовер, 1979]. Глутатион существует в двух формах восстановленный (ГSH) и окисленный (ГSSГ). Восстановленный глутатион – трипептид g-L- глутамилцистеинилглицин (g-L-Глу- Цис- Гли). Химическая активность ГSH связана с тиоловой группой остатка Цис, являющейся донором протонов для многих соединений. Отдавая протон, ГSH легко окисляется с образованием димера с S-S- мостиком.
Функции глутатиона многообразны: восстановление и изомеризация дисульфидных связей; влияние на активность ферментов и других белков, поддержание барьерных функций мембран, коферментные функции, резервирование цистеина, влияние на биосинтез нуклеиновых кислот и белка, пролиферацию и др. [Meister, Anderson, 1983; Кулинский, Колесниченко, 1990].
Аскорбат:
Витамин С (L-аскорбиновая кислота) по химическому строению является лактоном гулоновой кислоты со структурой, близкой a-глюкозе. Благодаря наличию двух асимметричных атомов углерода, аскорбиновая кислота образует четыре стереоизомера, биологической активностью обладает только L-аскорбат.
Присутствие в аскорбате двух двойных связей обуславливает ее способность к обратимому окислению, продуктом которого является дегидроаскорбиновая кислота (ДАК). ДАК устойчивое соединение. В ходе необратимого разрыва лактоновой связи часть ДАК превращается в 2,3 –декетогулоновую кислоту (ДКГК). При окислении ДКГК расщепляется на щавелевую и трионовую кислоты [Дегли, Никольсон, 1973].
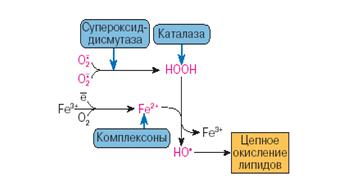
1.2.1. Ферментативная антиоксидантная система Супероксиддисмутаза:
Организмы различной степени сложности, утилизирующие кислород в процессах обмена веществ содержат ферменты, обладающие способностью дисмутировать супероксидные радикалы, обрывая тем самым опасную цепь свободнорадикальных превращений в самом зародыше. Эти ферменты называют супероксиддисмутазами (КФ 1.15.1.1., супероксид: супероксид оксидоредуктаза, СОД). СОД являются, в основном внутриклеточными ферментами и лишь небольшая часть СОД- активности обнаружена во внеклеточных жидкостях млекопитающих в виде гликозилированного тетрамера Cu,Zn-СОД с Mr 135 кДа. Этот гликопротеин проявляет сродство к сульфатированным полисахаридам таким, как гепарин и гепарансульфат [Marclund, 1984; Fridovich, 1997].
Каталаза:
Каталаза (КФ I.II.1.6, Н2О2: Н2О2- оксидоредуктаза, КТ), фермент участвующий в детоксикации нерадикальной активной формы кислорода – Н2О2.
По химическому составу является гемопротеином и состоит из 4-х идентичных субъединиц, каждая из которых в качестве простетической группы содержит _емм с трёхвалентным железом. Апобелки каталаз животного происхождения видоспецифичны [Вайнштейн, Мелик-Адамян, 1986]. _емм в белковой глобуле каталазы находится в гидрофобном окружении.
Глутатионтрансферазы:
Глутатионтрансфераза (КФ 2.5.1.18, донор: восстановленный глутатион трансфераза, ГТ) входит в семейство ферментов, нейтрализующих токсическое влияние различных гидрофобных и электрофильных соединений путем их конъюгации с восстановленным глутатионом.
Глутатионредуктаза:
Во многих реакциях, катализируемых ГП и ГSТ, отдавая протоны, две молекулы ГSH соединяются дисульфидной связью и образуют, так называемый, окисленный глутатион. Для восстановления ГSSГ и, следовательно, рециклирования ГSH, в клетках существует специальный фермент – глутатионредуктаза [Косовер, Косовер, 1979; Мартинчик, Бондарев, 1986] .
Глутатионредуктаза (НAДФH: окисленный глутатион оксидоредуктаза, КФ 1.6.4.2, ГР) ‑ широко распространенный флавиновый фермент, поддерживающий высокую внутриклеточную концентрацию восстановленной формы глутатиона.
Глюкозо‑6‑фосфатдегидрогеназа:
Для восстановления окисленного глутатиона глутатионредуктазой в качестве доноров водорода используется НAДФH, который образуется в пентозофосфатном пути в ходе глюкозо–6–фосфатдегидрогеназной реакции [Атауллаханов, 1981].
ВТОРИЧНАЯ АНТИОКСИДАНТНАЯ СИСТЕМА ЗАЩИТЫ
Аэробные организмы в процессе эволюции приобрели хорошо сбалансированные механизмы, осуществляющие нейтрализацию окислительного действия кислорода и его активных интермедиатов. Эти механизмы (ферментативные и неферментативные), способные поддерживать и восстанавливать друг друга, объединены в единую антиоксидантную систему, которая осуществляет первичную защиту организма (клеток, тканей). Компоненты этой системы взаимодействуют непосредственно с АФК, то есть, стресс-факторами, способными вызывать окислительную модификацию различных биополимеров. Однако защитный потенциал, которым располагают аэробные организмы, наряду с АОС, включает вторичную антиоксидантную систему защиты, или репаративную систему, компоненты которой начинают функционировать при уже случившихся окислительных повреждених , когда появляется необходимость быстрого удаления и восстановления поврежденных клеточных структур.
К репаративной системе относятся липолитические ферменты (липазы, фосфолипазы), протеазы, пептидазы, ДНК-репаразы, эндо- и экзонуклеазы, лигазы.
В процессах перекисного окисления липидов , _емма_рованных АФК, происходит существенная модификация фосфолипидов плазматической и внутриклеточных мембран. В удалении поврежденных жирнокислотных ацилов мембранных липидов участвуют фосфолипазы А1 и А2, а также фосфолипаза С. Выяснено, что перекисное окисление мембранных липидов может стимулировать липолитическое действие фосфолипазы А2. Исследования показали, что предпочтительными субстратами для данного фермента служат именно перекисные формы фосфолипидов. По-видимому, это может иметь важное значение в процессах мембранной репарации, поскольку предоставляет клетке дополнительную защиту против ПОЛ.
В защите клетки принимают участие и протеолитические ферменты, осуществляющие деградацию окисленных белков, предотвращая тем самым их накопление. В последние годы было установлено, что деградацию окисленных белков осуществляют протеосомы, мультикаталитические протеазные комплексы, состоящие примерно из 28 субъединиц, организованных в цилиндрическую структуру. Комплекс протеаз, селективно деградирующий модифицированные белки (окисленные или помеченные убиквитином), играет главную роль в нелизосомальном расщеплении внутриклеточных белковых молекул. Две главные протеосомы (20S и 26S-частицы) идентифицированы. Только 20S протеосома деградирует окисленные белки. Протеосома содержит три главных активности – трипсиноподобную, химотрипсиноподобную и карбоксипротеазную. Протеолиз протеосомой требует разворачивания полипептидных цепей и транспорта развернутого белка во внутренний активный компартмент комплекса [Tsu-Chung Chang,Wei-Yuan Chou,Gu-Gang Chang,2000].
1.3. Антиоксиданты плазмы кровиЗащита ферментов и белков, в частности липопротеинов, присутствующих в плазме крови, осуществляется внеклеточной АОС. Эта антиоксидантная система, как и клеточная, характеризуется наличием антиоксидантных ферментов и низкомолекулярных биоантиоксидантов и присутствует не только в плазме крови, но и в межклеточной, спинномозговой, синовиальной жидкостях и лимфе.
К высокомолекулярным соединениям, содержащимся в плазме крови и обладающим антиоксидантной активностью, относятся экстрацеллюлярная СОД, каталаза и ГПО, альбумины, церулоплазмин, трансферрин, лактоферрин, ферритин, гаптоглобин и гемопексин (белок, связывающий _емм). По мнению [Halliwell, Gutteridge, 1986] удаление О2- и Н2О2 СОД, каталазой и ГПО вносит небольшой вклад в антиоксидантную активность внеклеточных жидкостей. Авторы считают, что главными защитными системами в плазме являются антиоксидантные белки, связывающие ионы металлов переменной валентности в формы, которые не могут стимулировать свободнорадикальные реакции, либо другим способом, препятствующим ионам металлов принимать участие в таких реакциях. Известно, что церулоплазмин, обладающий ферроксидазной активностью, ингибирует Fe2+-зависимое ПОЛ и образование ·ОН из Н2О2. ЦП считается основным антиоксидантом плазмы крови. Поскольку ЦП неспецифически связывает Cu2+, он тормозит также Cu2+-стимулируемое образование АФК.
К внеклеточной неферментативной АОС в настоящее время относят ураты и билирубин – метаболиты, образующиеся при расщеплении пуриновых нуклеотидов и _емма, а также витамины С, Е и А (каротины), поступающие в организм с пищей.
Компоненты АОС работают в комплексе: ферментативная АОС осуществляет обезвреживание О2- и Н2О2 ингибиторы органических радикалов также участвуют в цепочке взаимопревращений, в результате которых образуется менее активная форма радикала.
ROO· ® (токоферол)· ® (аскорбат)· ® (урат)·
Целесообразность существования таких взаимопревращений заключается в более гибкой регуляции и надежности гомеостазирования свободнорадикальных процессов в клетке [Соколовский, 1988].
Церулоплазмин: структура, свойства, биологическая роль
Церулоплазмин (КФ 1.16.3.1, ферро- О2- оксидоредуктаза, ЦП) – металлогликопротеин a2 – глобулиновой фракции, относится к семейству голубых оксидаз. ЦП – белок с большой молекулярной массой, представленный одной полипептидной цепью, но имеющий несколько изоформ и характеризующийся сложной картиной распределения в тканях, а также разнообразием кооперативных форм участия в метаболизме меди и железа в организме [Мжельская, 2000]. ЦП связывает более 95 % общего количества меди, содержащейся в сыворотке крови. Молекула ЦП состоит из 1046 аминокислотных остатков, содержит около 8 % углеводов и 6-7 атомов меди. Пространственная организация и каталитические свойства ЦП определяются присутствием меди [Василец, 1975]. ЦП – это мультифункциональный белок, одна из главных его функций – медьтранспортная, реализуется при взаимодействии со специфическими рецепторами, локализованными на наружной поверхности плазматических мембран клеток. Установлено существование специфического белка-рецептора на мембранах различных клеток, в том числе и на мембранах эритроцитов человека [Пучкова, Вербина и др. 1991]. Рецепция осуществляется путем связывания терминальных остатков сиаловых кислот эритроцитарной мембраны и остатков маннозы и ацетилглюкозамина углеводной части молекулы ЦП. Известно, что лишь 40 % ЦП содержит углеводный фрагмент способный прочно связываться с рецепторами эритроцитов [Саенко , Ярополов , 1991].
В гепатоцитах синтезируется три молекулярные формы ЦП: две из них – секретируемые (сывороточный ЦП и ЦП с молекулярной массой 200 кД), третья – внутриклеточный несекреторный ЦП-подобный белок с молекулярной массой 50 кД. Помимо печени мРНК ЦП обнаружены в коре головного мозга, мозжечке, гипоталамусе, сосудистом сплетении мозговых желудочков, кишечнике, почках, сердце, ретикулоэндотелиальной системе селезенки и бронхиолярном эпителии человека и лабораторных животных [Мжельская, 2000]
ЦП является одним из основных АО плазмы крови. Особенностью этого белка является высокая стабильность к токсическому действию АФК, что позволяет ему сохранять биологическую активность в условиях интенсивной генерации АФК [Gutteridge, Richmond, Halliwell,1980].
ЦП проявляет как специфическую, так и неспецифическую антиоксидантную активность. Специфическая активность, связанная со снижением уровня активных метаболитов кислорода, может быть реализована несколькими путями. В плазме крови церулоплазмин окисляет Fe2+ до Fe3+, после чего окисленные ионы железа связываются трансферрином и транспортируются в гепатоциты и развивающиеся ретикулоциты. Существенно, что окисление железа ЦП, в отличие от неферментативного окисления Fe2+ в присутствие О2, не сопровождается образованием супероксидного анион – радикала, поэтому в окислительных реакциях с участием ионов железа ЦП оказывается антиоксидантом [Киселев, 1988]. ЦП обладает способностью удалять из крови супероксидные анион-радикалы. Он вызывает дисмутацию О2-, которая имеет не ферментативный, а стехиометрический характер, таким образом происходит восстановление О2- до воды, а не до перекисей, в отличие от других антиоксидантных ферментов. Со способностью перехватывать О2- связывают ингибирующее действие ЦП на процессы ПОЛ в хиломикронах и липопротеинах [Санина, Бердинских, 1986]. ЦП является наиболее сильным среди белков сыворотки ингибитором образования гипогалоидов в системе милопероксидаза-Н2О2-Сl-, способен инактивировать АФК, генерируемые миелопероксидазой, защищая a1- антипротеиназу от окислительной инактивации гипохлоритом [Зенков и др., 1993].
Неспецифическая антиоксидантная активность Цп обусловлена образованием комплексных соединений с медью [Саенко, Ярополов,1991].
Глава 2. Материалы и методы 2.1. Объект исследования
Были проведены исследования 3-х пациентов женского пола в возрасте от 21 до 51 года, поступивших в стационар ККБ №1 с заболеванием – эндемический зоб. Исследования проводили на крови, взятой из вены медперсоналом ККБ№1. У каждой пациентки кровь бралась 4 раза: А – до оперпции, Б - в день операции, В – через3-4 дня после операции, Г-через неделю после операции. Определяли активность церулоплазмина в плазме крови.
2.2. Методика определения активности ЦП
Определение церулоплазмина в плазме крови модифицированным методом Ревина [].
Принцип метода основан на окислении р-фенилендамина при участии церулоплазмина [Камышников, 2000].
Реактивы:
1. 0.5 %-ный водный раствор солянокислого р-фенилендиамина.
2. 0.4 М ацетатный буфер, рН 5.5. Готовят из двух растворов:
1) 54.44 г ацетата натрия растворяют в 1л дистиллированной воды;
2) 22.6 мл ледяной уксусной кислоты доводят до 1л.
Полученные растворы смешивали в отношении 9:1 в большом количестве.
3. 3%-ный раствор фтористого натрия. После растворения соли в дистиллированной воде раствор профильтровывают.
Ход определения:
В пробирки вносят по 8 мл ацетатного буфера и 0.1 мл плазмы. В контрольную пробирку добавляют 2мл раствора фтористого натрия (для инактивации ферментативной активности церулоплазмина). Затем во все пробирки вносят по 1 мл раствора р-фенилендиамина (используемого в качестве субстрата). Пробирки встряхивают, помещают в термостат и инкубируют в течение часа при температуре 37 С. После инкубации во все пробирки (за исключением контрольной) добавляют по 2 мл раствора фтористого натрия. Содержимое пробирок перемешивают, затем их переносят в холодильник, где выдерживают 30 мин при 4С. Пробы колориметрируют против контроля (бледно-розовой окраски) в кюветах с шириной слоя 1,0 см при = 530 нм.
Умножая значение оптической плотности на коэффициент пересчета 875, получают величину концентрации церулоплазмина в мг/л.
2.3 Статистическая обработка результатовОбработка эксперементальных данный проводилась общепринятыми методами [Лакин, 1980].
ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Для определения изменения активности церулоплазмина в течение периода лечения, кровь бралась 4 раза:
А – до операции;
Б – через 1-2 часа после операции;
В – через 3-4 дня после операции;
Г – через 7 дней после операции.
В плазме крови людей в норме согласно литературным данным (http://www.health-ua.com/articles/1368.html) ЦП содержится в концентрации 0.20-0.40 мг/мл, т в среднем 0.3 мг/мл. У больных эндемическим зобом, наблюдается значительное увеличение концентрации данного антиоксиданта (рис.1.).
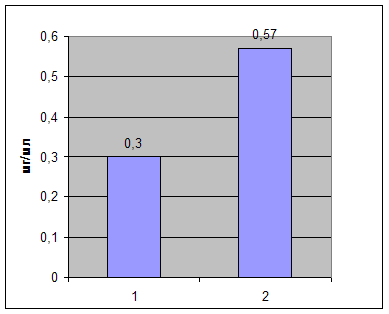
Рис.1. Содержание ЦП в плазме крови здоровых людей и больных эндемическим зобом (1: конц. ЦП в норме; 2: конц. ЦП до операции).
У пациентов была проведена операция по удалению части ЩЗ.
Динамика изменений концентрации ЦП приведена на рис.2 .
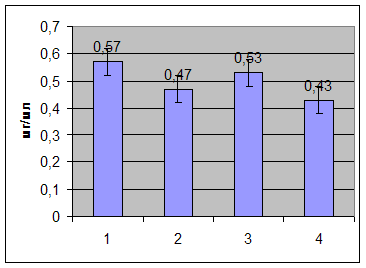
Где
1 – до операции;
2 – через 1-2 часа после операции;
3 – через 3-4 дня после операции;
4 – через 7 дней после операции.
Рис.2.
После удаления части щитовидной железы у больных эндемическим зобом наблюдается постепенное уменьшение концентрации ЦП в плазме крови. Но на стадии 3 (через 3-4 дня после операции), заметно незначительное увеличение концентрации, после чего уровень ЦП приближается к нормальной величине, но не попадает в рамки допустимой нормы.
ВЫВОДЫ1. Проанализирован литературный материал по теме данной курсовой работы.
2: Отработана методика определния церулоплазмина в плазме крови.
3. У больных с эндемическим зобом отмечается повышенный уровень церулоплазмина в плазме крови, превышающий контрольную величину на (%).
4. При данной патологии щитовидной железы после операции концентрация церулоплазмина в крови не достигает нормы.
ЛИТЕРАТУРА1. Ю.А. Владимиров, Свободные радикалы в живых системах / Ю.А. Владимиров, О.А.Азизова, А.И.Деев и др.// Итоги науки и техники. Сер. Биофизика. − 1991. − Т. 29. – С.
2. Кулинский В.И., Активные формы кислорода и оксидативная модификация макромолекул: польза, вред и защита / В.И. Кулинский, Л.С. Колесниченко // Успехи соврем. биологии. − 1993. − Т. 113, вып. 1. − С. 107-122.
3. Владимиров Ю.А., Перекисное окисление липидов в биологических мембранах/ Ю.А. Владимиров, А.И. Арчаков // М.: Наука. – 1972. − С. 282.
4. Н.К. Зентов, Окислительный стресс. Биохимические и патофизиологические аспекты/ Н.К. Зентов, В.З. Ланкин, Е.Б. Меньщикова //М: Наука. −2001. −С. 340.
5. С.Д. Варфоломеев, Простагландины – новый тип биологических регуляторов / С.Д. Варфоломеев // Соросовский Образовательный Журнал. −1996. −Т 1. −С. 40-47.
6. В.И. Кулинский, Лекционные таблицы по биохимии/ В.И. Кулинский// Биохимия регуляций. −1994. −вып. 4. − С.94.
7. S.M. Rapport , Catalase and glutathione peroxidaze. / S.M. Rapport, M.W.Muller//J.Biol.Chem. – 1979. −№ 14.−P.176−179.
8. B.J. Halliwell, Free radicals in Biology and Medicine. Third edition. / B.J. Halliwell, M.C. Cutteridge// Oxford: Oxford University Press. – 1999. – P. 937.
9. Е.Б. Меньщикова, окислительный стресс. Прооксиданты и антиоксиданты/ Е.Б. Меньщикова, В.З. Ланкин Н.К. Зенков, И.А. Бондарь и др. // М.:фирма «слово». – 2006. – С. 556.
10. М.Н. Кондрашов, Отрицательные аэрономы и активные формы кислорода/ М.Н. Кондрашов// Биохимия. – 1999. – 64, №3. – С.430 – 432.
11. В.П. Комов, Гормональная регуляция оборота супероксиддисмутазы в печени крыс/ В.П. Комов, Е.Ю. Иванова// Вопр. мед. химии. – 1983. −№5. −С.79 – 82.
12. В.И.Кулинский, Биологическая роль глутатиона/ В.И.Кулинский Л.С. Колесниченко // Успехи соврем. биологии. −1990. −Т. 110, вып. 1(4) . − С. 20-33.
13. В.П. Скулачев, Кислород в живой клетке: Добро и зло/ В.П. Скулачев // Соросовский Образовательный Журнал. −1996. −Т. 3. −С. 4-10.
14. И.А.Зборовская, Антиоксидантная система организма, ее значение в метаболизме. Клинические аспекты/ И.А. Зборовская, М.В. Банникова// Вестн. Рос АМН. −1995. −№6. − С.53 – 60.
15. Г.И. Клебанов , Антиоксидантная активность сыворотки крови / Г.И. Клебанов, Ю.О. Теселкин, И.В. Бабенкова и др.//Вестн. Рос. АМН. −1999. − №2. − С. 15-22.
16. М.В.Кения, Роль низкомолекулярных антиоксидантов при окислительном стрессе / М.В. Кения, А.И. Лукаш, Е.П. Гуськов// Успехи соврем. биологии. −1993 . −№4. −С. 456-470.
Приложение 1
Динамика ЦП в плазме больных эндемическим зобом.
| № пробы | мг/л |
| 1А | 525 ± 31 |
| 1Б | 402 ± 35 |
| 1В | 481 ± 39 |
| 1Г | 350 ± 22 |
| 2А | 612 ± 27 |
| 2Б | 525 ± 41 |
| 2В | 604 ± 30 |
| 2Г | 525 ± 38 |
| 3А | 568 ± 14 |
| 3Б | 481 ± 34 |
| 3В | 525 ± 35 |
| 3Г | 394 ± 26 |
Приложение 2
Данные измерений ЦП в плазме крови больных эндемическим зобом.
| № пробы | мг/л | ||||
| 1А | 519 | 533 | 547 | 502 | |
| 1Б | 371 | 401 | 422 | 413 | |
| 1В | 501 | 450 | 487 | 485 | |
| 1Г | 369 | 338 | 343 | 351 | |
| 2А | 601 | 595 | 632 | 619 | |
| 2Б | 557 | 509 | 533 | 500 | |
| 2В | 587 | 615 | 590 | 625 | |
| 2Г | 552 | 510 | 500 | 537 | |
| 3А | 578 | 561 | 571 | 560 | |
| 3Б | 457 | 504 | 494 | 470 | |
| 3В | 512 | 502 | 533 | 552 | |
| 3Г | 390 | 405 | 409 | 373 | |
Похожие работы
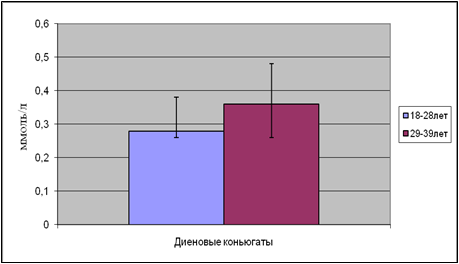
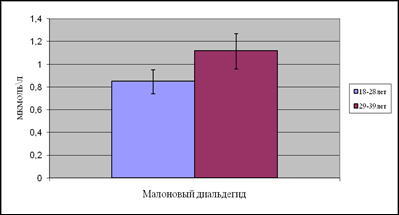
... находится на невысоком уровне, но при стрессовых ситуациях происходит усиленная активация процессов ПОЛ под действием АФК, что приводит к патологическому состоянию. 3.1. Содержание продуктов перекисного окисления липидов в плазме крови небеременных женщин. В данной работе было определено содержание диеновых коньюгатов и малонового диальдегида у небеременных женщин (N=31), которые составили ...
... Біології. Київ. – 2007. (Здобувач брала безпосередню участь дослідженні, аналізі експериментальних даних, написанні та оформленні тез). АНОТАЦІЯ Люта М.Я. Морфофункціональні та біохімічні особливості системи еритрону за умов цукрового діабету 1-го типу. – Рукопис. Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.11 – цитологія, клітинна біологія, ...
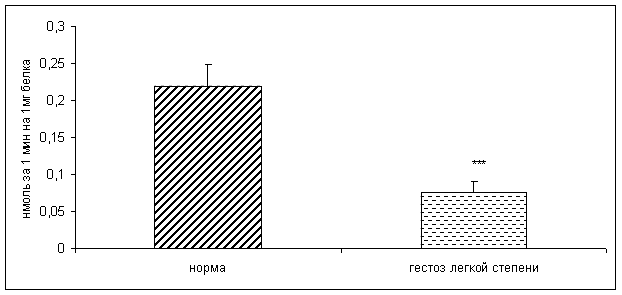
... узловым зобом. //Материалы V Российского Форума «Мать и Дитя», Москва,2003, 44–45 20. Габелова К.А., Арутюнян А.В., Зубжицкая Л.Б. Фиксированные иммунные комплексы и NO-синтетазная активность плаценты при гестозе // Вестн. Росс. Ассоц. акуш.-гин. – 2000. – №1. – С. 22-24. 21. Гармашева Н.Л., Константинова Н.Н. Патофизиологические основы охраны внутриутробного развития человека. Л.,1985.,159 ...
... среду [Менщикова, 2008]. 3.2. Анализ содержание GSH и активность глутатионзависимых ферментов в эритроцитах крови практически здоровых людей, проживающих в различных по уровню загрязнения районах г.Красноярска Город Красноярск административно разделен на 7 районов, различаемых по уровню техногенной нагрузки, которая определяется структурой промышленности и энергетики, исходного и ...
0 комментариев