Навигация
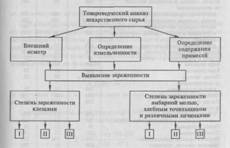
1.1 Пробоподготовка
Анализируемую смесь солей внимательно осматривают, определяя её внешний вид, цвет, запах, степень измельчения, наличие кристаллических или аморфных фаз. Это позволяет установить, является ли смесь однородной, содержит ли она одну или несколько твёрдых фаз – кристаллических или аморфных, каковы размеры частиц.
По окраске анализируемой смеси можно высказать предположения о наличии или отсутствии в ней тех или иных катионов. Если смесь представляет собой бесцветную прозрачную или белую массу, то это указывает на отсутствие в ней значительных количеств окрашенных катионов – Cr3+ (сине-фиолетовый или тёмно-зелёный цвет), Mn2+ (светло-розовый), Fe3+ (жёлто-бурый), Со2+ (розовый), Ni2+ (зелёный), Cu2+ (голубой). Если смесь окрашена, то можно предположить содержание в ней одного или нескольких вышеуказанных катионов. При наличии в смеси нескольких различных окрашенных катионов её цвет может быть промежуточным между цветами индивидуальных окрашенных катионов, в зависимости от их относительного содержания и химической формы (соль, комплекс, оксид и т. д.).
Если смесь представляет собой однородное вещество, легко растворимое в воде, то его обычно растворяют в воде, не растирая в порошок. Если же смесь неоднородна и не очень легко растворяется в воде, то её растирают до однородной массы, состоящей из мелких частиц. Мелкие частицы легче перемешиваются и быстрее растворяются в воде.
После проведения тщательного осмотра сухую смесь растирают в порошок в агатовой, яшмовой или фарфоровой ступке.
Действие разбавленной серной кислоты. Разбавленная серная кислота вытесняет слабые кислоты из их солей – карбонатов, сульфитов, тиосульфатов, сульфидов, цианидов, нитритов, ацетатов. Выделяющиеся слабые кислоты, неустойчивые в кислой среде, либо улетучиваются, либо разлагаются с образованием газообразных продуктов. Некоторые из них обладают характерным цветом или запахом.
При наличии в смеси карбонатов выделяется газообразный диоксид углерода СО2 (бесцветный и без запаха). При наличии сульфитов и тиосульфатов выделяется диоксид серы SO2 c запахом горящей серы; при наличии сульфидов – сероводород H2S с запахом тухлых яиц; при наличии цианидов – пары синильной кислоты HCN с запахом горького миндаля; при наличии нитритов – бурые пары диоксида азота NO2; при наличии ацетатов – пары уксусной кислоты СН3СООН с запахом уксуса.
Для проведения теста отбирают немного смеси в пробирку и по каплям прибавляют разбавленную серную кислоту. Выделение газов указывает на присутствие в анализируемой смеси вышеуказанных анионов слабых, неустойчивых в кислой среде кислот.
Действие концентрированной серной кислоты на пробу. Концентрированная серная кислота при взаимодействии с анализируемым веществом может выделять газообразные продукты реакций также из фторидов, хлоридов, бромидов, иодидов, тиоцианатов, оксалатов, нитратов.
При наличии в анализируемом веществе фторидов выделяются пары фтороводорода HF; при наличии хлоридов – пары HCl и газообразный хлор; при наличии бромидов – пары HBr и газообразный жёлтый бром; при наличии иодидов – фиолетовые пары йода I2 , при наличии тиоцианатов – газообразный диоксид серы, при наличии оксалатов – газообразные оксид СО и диоксид СО2 углерода.
Перевод анализируемого вещества в раствор. Предварительные наблюдения и испытания позволяют сделать предположения и выводы о наличии тех или иных катионов и анионов в анализируемой смеси. Дальнейшее подтверждение этих предположений, а также прямые доказательства присутствия катионов и анионов получают при проведении дробного или систематического анализа. Для этого анализируемую смесь сначала переводят в раствор, подбирая подходящий растворитель.
Растворение пробы в воде. Вначале проверяют растворимость в воде при комнатной температуре и (в случае необходимости) при нагревании. Для этого 2—3 мг анализируемого вещества вносят в пробирку, прибавляют ~1,5 мл дистиллированной воды и перемешивают смесь некоторое время. Если вещество при этом полностью растворилось в воде, то большую часть вещества, отобранную для анализа, растворяют в возможно минимальном объеме дистиллированной воды и полученный раствор анализируют далее. Небольшую часть исходной твердой анализируемой пробы оставляют для проведения повторных или проверочных тестов, если это окажется необходимым.
Анализируемое вещество может растворяться в воде неполностью. Для выяснения того, произошло ли частичное растворение пробы в воде, смесь анализируемого вещества (2—3 мг) с водой в пробирке тщательно перемешивают, центрифугируют, отбирают 2—3 капли центрифугата, наносят на часовое или предметное стекло и выпаривают досуха. Если после выпаривания на стекле образовался налет твердого вещества, то это означает, что часть твердой пробы растворилась в воде. В таком случае к большей части исходной пробы прибавляют дистиллированную воду, смесь тщательно перемешивают, центрифугируют и отделяют центрифугат от осадка. Последний промывают 3—4 раза небольшим объемом дистиллированной воды, присоединяя промывные воды к центрифугату. Промывные воды и центрифугат, представляющие собой водную вытяжку растворившейся части пробы, подвергают дальнейшему анализу отдельно от осадка, который далее испытывают на растворимость в кислотах,
Растворение пробы в кислотах. Растворимость в растворах кислот испытывают в том случае, когда анализируемое вещество нерастворимо или частично растворимо в воде. В первом случае проверяют растворимость в кислотах проб (2—3 мг) исходного твердого анализируемого вещества, во втором — проб (2—3 мг) осадка, оставшегося после отделения водной вытяжки.
Отдельно в разных пробирках испытывают растворимость проб в разбавленной уксусной кислоте, разбавленных и концентрированных НСl и НNО3 при необходимости — также в царской водке (при комнатной температуре или при нагревании).
Для проведения теста в пробирки вносят по 2—3 мг анализируемой твердой фазы и прибавляют несколько капель соответствующей кислоты — разбавленной или концентрированной, наблюдая за тем, выделяются или не выделяются газообразные продукты реакций (СО2,SО2, Н2S, NО2). Если вещество не растворяется в кислоте при комнатной температуре, то испытывают его растворимость при нагревании.
При полном растворении пробы в той или иной кислоте для дальнейшего анализа используют полученный раствор.
В случае растворения пробы как в растворе НС1, так и в растворе НN03, для последующего анализа отбирают полученный азотнокислый раствор, так как нитраты менее летучи, чем хлориды, которые частично могут быть потеряны на дальнейших стадиях анализа.
Если проба частично растворяется в уксусной кислоте, то анализируемый образец обрабатывают уксусной кислотой, отделяют центрифугированием нерастворившийся остаток от раствора и уксуснокислый центрифугат подвергают дальнейшему анализу отдельно от осадка. Осадок же испытывают на растворимость в НСl, НNОз, в царской водке, каждый раз отбирая для дальнейшего анализа соответствующий раствор в случае частичного растворения пробы в той или иной кислоте.
Таким образом могут быть получены несколько растворов (водная вытяжка, растворы в разных кислотах), в которых предстоит открыть катионы и анионы. Это в целом облегчает ход анализа, так как уже на этапе растворения происходит частичное разделение некоторых катионов и анионов, которые могут мешать открытию друг друга, если они одновременно присутствуют в одном и том же растворе.
Когда анализируемая смесь содержит сульфаты свинца и катионов третьей аналитической группы, нерастворимые в кислотах, их можно перевести в растворимые в кислотах карбонаты кипячением с насыщенным водным раствором соды Na2СО3 и поташа К2СО3 или же сплавлением со смесью Nа2СО3 и К2СО3.
Похожие работы
... красного окрашивания раствора не наблюдаем, следовательно анион NO2-действительно в данной смеси отсутствует. Качественные реакции на анионы третьей аналитической группы Подтвердим присутствие в анализируемом веществе аниона NO3-. Проведем следующую реакцию: к нескольким каплям раствора неизвестного вещества прибавим 2-3 капли дефениламина и 5 капель концентрированной серной кислоты. Наблюдается ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
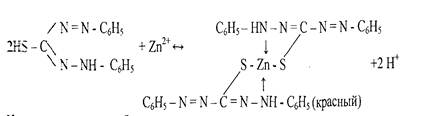
... (II) аммония. Cd2+-+ [Hg(SCN)4]2- -> Cd[Hg(SCN)4] ()бразование бесцветных продолговатых кристаллов тетрароданомеркурата кадмия Аналитически реакции катионов VI аналитической группы по кислотно-основной классификации: Cu2+, Hg2+, Cd2+, Co2+, Ni2+ Групповой реагент – NH4OH в избытке Хотя элементы расположены в разных груупах периодической системы Д.Ию Менделеева, все эти катионы ...
... Глава II. Методики исследования загрязнения окружающей среды и оценки ее качества Для выполнения задач и достижения цели были разработаны нами методики исследования комплексной эколого-геохимической оценки урболандшафтов Волгоградской агломерации, которая заключается в исследовании почв, растительности, оценки выбросов промышленных предприятий и влияния ОС на здоровье человека. 2.1 ...
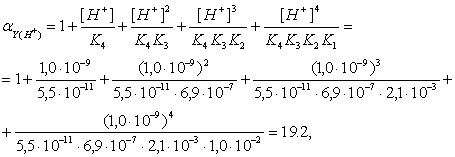
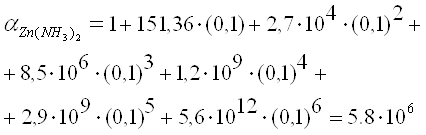
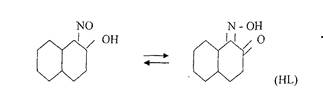
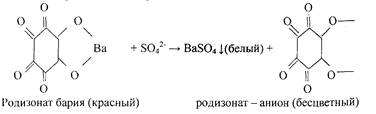
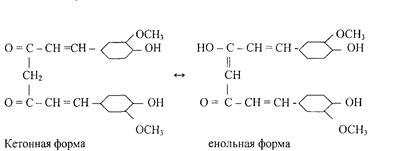
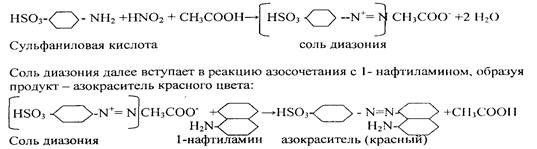
0 комментариев