Навигация
Химические методы определения хлорид иона
2.2 Химические методы определения хлорид иона
2.2.1 Требования к титриметрическим методам определения
Титриметрические определения хлоридов, основаны на реакциях образования осадков малорастворимых соединений. Не все реакции сопровождающиеся выпадением осадков применимы в объемном анализе. В этих реакциях пригодны только некоторые реакции, удовлетворяющие определенным условиям. Реакция должна протекать строго по уравнению и без побочных процессов. Образующийся осадок должен быть практически нерастворимым и выпадать достаточно быстро, без образования пересыщенных растворов. К тому же необходимо иметь возможность определять конечную точку титрования с помощью индикатора. Наконец, явления адсорбции (соосаждения) должны быть выражены при титровании настолько слабо, чтобы результат определения не искажался.
Наименования отдельных методов осаждения происходят от названий применяемых растворов. Метод, использующий раствор нитрата серебра, называют аргентометрией. Тиоцианатометрия основана на применении раствора тиоцианата аммония NH4SCN (или калия KSCN) и служит для определения следов С1- в сильнощелочных и кислых растворах. Дорогостоящий аргентометрический метод определения галогенидов по возможности стараются заменять меркурометрическим. В последнем используют раствор нитрата ртути (I) Hg2(NO3)2.
2.2.2 Аргентометрия
Объемный аналитический метод, основанный на реакциях осаждения ионов галогенов катионами серебра с образованием малорастворимых галогенидов:
Cl-+Ag+= AgCl↓
При этом используют раствор нитрата серебра. Если же анализируют вещество на содержание серебра, то пользуются раствором хлорида натрия (или калия).
Для понимания метода аргентометрии большое значение имеют кривые титрования. В качестве примера рассмотрим случай титрования 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрита серебра (без учета изменения объема раствора).
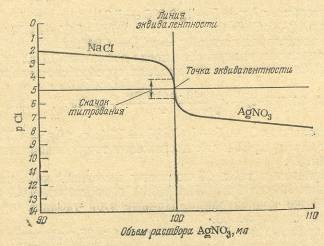
Рисунок 2.1 – Кривая титрования раствора NaCl раствором AgNO3
До начала титрования концентрации хлорид-ионов в растворе равна общей концентрации хлорида натрия, т.е. 0,1 моль/л или [Cl-]=l0-1.
Обозначив отрицательный логарифм концентрации (или активности) определяемых хлорид-ионов через рСl, можно написать:
рCl = – lg [Cl-] = – lg l0-1= 1.
Когда к титруемому раствору хлорида натрия будет прибавлено 9,00 мл раствора нитрата серебра и 90% хлорид-ионов будут осаждены, концентрация их в растворе уменьшится в 10 раз и станет равна 10-2 моль/л, а рС1 будет равен 2. Поскольку же величина ПPAgCl=10-10, концентрация ионов серебра при этом составит:
[Ag+] = 10-10/[С1-] = 10-10/10-2 = 10-8 моль/л,
или pAg= – lg[Ag+] = – lgl0-8 = 8.
Аналогичным образом вычисляют все остальные точки для построения кривой титрования. В точке эквивалентности pCl=pAg= 5 (см. табл. 2.1).
Таблица 2.1 – Изменение рСl и pAg при титровании 10,00 мл 0,1 н. раствора хлорида натрия 0,1 н. раствором нитрата серебра
Прибавлено раствора AgNO3, мл | [С1-] | [Ag+] | рСl | pAg |
0 | 10-1 | 0 | 1 | - |
9.00 | 10-2 | 10-8 | 2 | 8 |
9.90 | 10-3 | 10-7 | 3 | 7 |
9.99 | 10-4 | 10-6 | 4 | 6 |
10.00 (точка эквивалентности) | 10-5 | 10-5 | 5 | 5 |
10,01 | 10-6 | 10-4 | 6 | 4 |
10,10 | 10-7 | 10-3 | 7 | 3 |
11,00 | 10-8 | 10-2 | 8 | 2 |
20,00 | 10-9 | 10-1 | 9 | 1 |
Интервал скачка при аргентометрическом титровании зависит от концентрации растворов и от значения произведения растворимости осадка. Чем меньше величина ПР получающегося в результате титрования соединения, тем шире интервал скачка на кривой титрования и тем легче фиксировать конечную точку титрования с помощью индикатора.
Наиболее распространено аргентометрическое определение хлора по методу Мора. Сущность его состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка.
Индикатор метода Мора – раствор К2СгО4 дает с нитратом серебра красный осадок хромата серебра Ag2CrO4, но растворимость осадка (0,65*10-4Э/л) гораздо больше растворимости хлорида серебра (1.25*10-5 Э/л). Поэтому при титровании раствором нитрата серебра в присутствии хромата калия красный осадок хромата серебра появляется лишь после добавления избытка ионов Ag+, когда все хлорид-ионы уже осаждены. При этом всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот.
Возможности применения аргентометрии довольно ограничены. Её используют только при титровании нейтральных или слабощелочных растворов (рН от 7 до 10). В кислой среде осадок хромата серебра растворяется.
В сильнощелочных растворах нитрат серебра разлагается с выделением нерастворимого оксида Ag2O. Метод непригоден и для анализа растворов, содержащих ион NH4+, так как при этом образуется с катионом Ag+ аммиачный комплекс [Ag(NH3)]+. Анализируемый раствор не должен содержать Ва2+, Sr2+, Pb2+, Bi2+ и других ионов, дающих осадки с хроматом калия. Тем не менее аргентометрия удобна при анализе бесцветных растворов, содержащих С1 – – ионы. Растворы, содержащие Ag+, не выливают в раковину, а собирают в специальную склянку, так как серебро из них регенерируют.
Кроме метода Мора при определении хлоридов аргентометрическим титрованием применяется также метод Фаянса. Он основан на прямом титровании растворов содержащих галогенид ионы стандартным раствором AgNO3 в присутствии адсорбционных индикаторов:
Ag+ + Cl-→ AgCl
mAgCl + n Ag+(изб)→ (AgCl)mAg+n
(AgCl)mAgn+ + Ind- → [(AgCl)mAg+n] Ind-
Титрование хлоридов в присутствии флуоресцеина проводят в нейтральной среде. При повышенной концентрации ионов водорода флуоресцеин, являющийся кислотой (HInd), диссоциирует слабо вследствие подавления его диссоциации кислотой. Поэтому концентрация Ind-ионов становится очень малой. В щелочном растворе осаждается Ag2O. В умеренно кислой среде обычно титруют в присутствии других индикаторов: дихлорфлуоресцеина и эозина. Титрование в кислых средах выгодно отличается от титрования в нейтральных растворах, так как дает возможность вести определение в присутствии гидролизующихся солей, разлагающихся водой с образованием осадков гидроокисей и оксихлоридов (Al3+, Fe3+ и др.).
В мерную колбу и вносят аликвоту пробы. После чего доводят объем раствора до метки и тщательно перемешивают. Для определения хлорида отбирают аликвотные части исследуемого раствора (по 25 мл), переносят их в конические колбы, прибавляют по 5 капель раствора флуоресцеина и титруют стандартным раствором AgNO3, непрерывно перемешивая. По мере прибавления по каплям раствора AgNO3 титруемая смесь мутнеет. Вблизи точки эквивалентности наблюдается частичная коагуляция коллоидного осадка AgCl. В этот момент титруют еще более внимательно и осторожно, сильно перемешивая содержимое колбы, титрование заканчивают, когда белый осадок AgCl окрашивается в красный цвет. Титрование выполняют 3 – 4 раза и, получив три сходящихся результата, вычисляют результаты анализа.
Похожие работы
... NO2- для разных шкал Приготовить четыре стандартных шкалы с разным шагом ных четыре шкалы для блюдателей воре, что позволяет применять для их определения спектроскопию крок шкали, загальне колідля визуального тест-определения нитрит-иона, расположив окрашенные таблетки ППУ на белом фоне в порядке возрастания концентрации нитрит-ионов для каждой шкалы. Большому числу независимых наблюдателей ( ...
... «минерализация природных вод» и на основе аргентометрического и титриметрического методов химического анализа провести количественное определение анионов Cl-, SO42-, НCO3-, CO32- и на основе полученных экспериментальных данных сделать вывод о степени минерализации вод рек Раковка и Комаровка. Глава I. Вода на Земле, ее происхождение и состав I.1. ...
... необходимой для анализа пробы согласно следующей таблице: вид осадка содержание сульфат-ионов в водной вытяжке, мл/100 мл процентное содержание сульфат-ионов в почвенном образце, г/100 г почвы требуемый объем вытяжки для количественного определения сульфат-ионов, мл большой осадок, быстро оседающий на дно более 59 десятые доли 5 сразу появляющееся замутнение в пробирке 10 ...
... ее образуются желто-красные осадки гидразонов, склонные к быстрой кристаллизации. Таким же путем легко обнаружить и биурет в карбамиде. Количественные определения минеральных удобрений Все количественные определения минеральных удобрений производятся согласно ГОСТ 21560.4-02. В промышленных минеральных удобрениях принято рассчитывать следующие количественные показатели: 1. ...
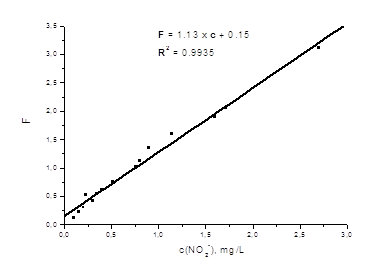
0 комментариев