Навигация
3.2 Химические свойства
Строение атома.
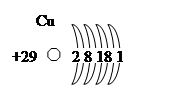
Рисунок 4. Схема строения атома меди.
3.2.1 Отношение к кислороду
Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
![]() (15)
(15)
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
![]() (16)
(16)
Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.

Рисунок 5. Строение оксидной пленки меди.
3.2.2 Взаимодействие с водой
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
![]() (17)
(17)
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
![]() (18)
(18)
![]() (19)
(19)
Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода.
![]() (20)
(20)
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
![]() (21)
(21)
![]() (22)
(22)
3.2.3 Взаимодействие с кислотами
Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислота на медь не действуют. Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
![]() (23)
(23)
3.2.4 Отношение к галогенам и некоторым другим неметаллам
Q образования (CuCl) = 134300 кДж
Q образования (CuCl2) = 111700 кДж
![]() (24)
(24)
Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты.
Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например:
![]() (25)
(25)
Монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
3.2.5 Оксид меди
При прокаливании меди на воздухе она покрывается черным налетом, состоящим из оксида меди
![]() (26)
(26)
Его также легко можно получить прокаливанием гидроксокарбоната меди (II) (CuOH)2CO3 или нитрата меди (II) Cu(NO3)2. При нагревании с различными органическими веществами CuO окисляет их, превращая углерод в диоксид углерода, а водород – в воду восстанавливаясь при этом в металлическую медь. Этой реакцией пользуются при элементарном анализе органических веществ для определения содержания в них углерода и водорода.
Под слоем меди расположен окисел розового цвета – закись меди Cu2O. Этот же окисел получается при совместном прокаливании эквивалентных количеств меди и окиси меди, взятых в виде порошков:
![]() (27)
(27)
Закись меди используют при устройстве выпрямителей переменного тока, называемых купроксными. Для их приготовления пластинки меди нагревают до 1020-1050 0C. При этом на поверхности образуется двухслойная окалина, состоящая из закиси меди и окиси меди. Окись меди удаляют, выдерживая пластинки некоторое время в азотной кислоте:
![]() (28)
(28)
Пластинку промывают, высушивают и прокаливают при невысокой температуре – и выпрямитель готов. Электроны могут проходить только от меди через закись меди. В обратном направлении электроны проходить не могут. Это объясняется тем, что закись меди обладает различной проводимостью. В слое закиси меди, который примыкает непосредственно к меди, имеется избыток электронов, и электрический ток проходит за счет электронов, т.е. существует электронная проводимость. В наружном слое закиси меди наблюдается нехватка электронов, что равноценно появлению положительных зарядов. Поэтому, когда к меди подводят положительный плюс источника тока, а к закиси меди – отрицательный, то электроны через систему не проходят. Электроны при таком положении полюсов движутся к положительному электроду, а положительные заряды – к отрицательному. Внутри слоя закиси возникает тончайший слой, лишенный носителей электрического тока, - запирающий слой. Когда же медь подключена к отрицательному полюсу, а закись меди к положительному, то движение электронов и положительных зарядов изменяется на обратное, и через систему проходит электрический ток.
Похожие работы
... Роквеллу НR Число твердости по Бринеллю НВ, кгс/мм2 Лабораторная работа № 3 Методы исследования качества, структуры и свойств металлов и сплавов Цель работы 1. Изучить сущность, возможности и методику выполнения основных видов макроструктурного и микроструктурного ...
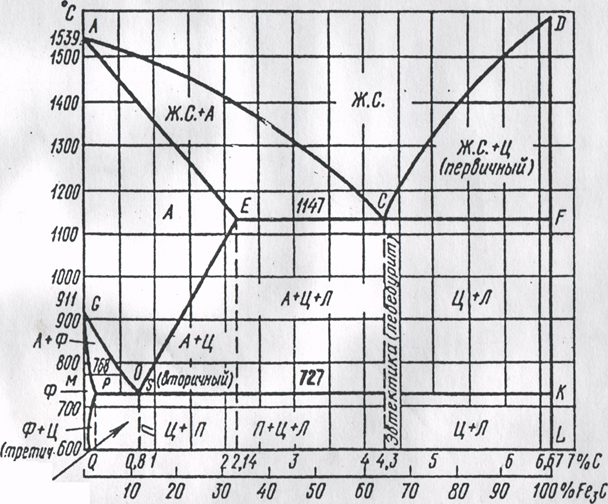
... диаграммы соответствуют чистым компонентам сплава (железо и цементит), а между ними располагаются точки, соответствующие сплавам разной концентрации от 0 до 6,67% С Рис. 2. Структурная диаграмма состояния сплавов Fe — Fe3C. В определенных условиях химическое соединение (цементит) может не образоваться, что зависит от содержания кремния, марганца и других ...
... ? 25. В чем сущность биохимических, фотохимических, радиационно-химических, плазмохимических процессов? Указать области их применения. 26. Какие основные группы физических процессов используют в системах технологий? 27. Дать определение машиностроению как комплексной области. Какова структура машиностроительного предприятия? 28. Раскрыть сущность понятий «изделие», «деталь», «сборочная единица ...
... В упорядоченных твердых растворах сохраняется решетка растворителя, но имеется правильное расположение атомов и резное изменение свойств характерное для химических соединений. 4. Химические соединения Химические соединения и родственные им по природе фазы в металлических сплавах многообразны. Характерные особенности химических соединений: 1. Кристаллическая решетка отличается от решеток ...








0 комментариев