Навигация
1.3. Методика синтеза
Способ 1 (исходя из уксусной кислоты)
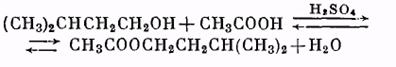
Реактивы:
Уксусная кислота ледяная ……….............20 мл (0,35 г-мол)
Изоамиловый спирт....................................30 г (0,34 г-мол)
Серная кислота (d 1,84). Сода 10%-ный раствор. Сернокислый натрий
Виды приборов для синтезов с азеотропной отгонкой воды: а – с холодильником Либиха, б – с шариковым холодильником, 1 – реакционная колба, 2 – двурогий форштосс, 3 – капельная воронка, 4 – «ловушка» для воды, 5 – обратный холодильник.
Синтез проводят в приборе, изображенном на рисунке. В круглодонную колбу емкостью 100 мл помещают смесь из 20 мл ледяной уксусной кислоты (или соответствующее количество 80%-ной кислоты) и 30 г изоамилового спирта, прибавляют 2 мл концентрированной серной кислоты (катализатор). Колбу соединяют посредством двурогого форштоса с обратным холодильником, между ними помещают «ловушку» для воды, образующейся при реакции. Смесь нагревают на песчаной бане. В «ловушке» собираются вода и спирт, которые образуют два слоя. Верхний спиртовый слой должен свободно переливаться через края ловушки, возвращаясь в сферу реакции. Когда воды в ловушке накопится столько, что появится опасность ее попадания в реакционную колбу, воду сливают в мерный цилиндр и измеряют ее объем. Реакция считается законченной, когда количество воды в «ловушке» перестанет увеличиваться. Полученный эфир охлаждают до комнатной температуры и промывают (в делительной воронке) сначала водой, затем раствором соды до нейтральной реакции по лакмусу и вновь водой. Отделив эфир от водного слоя, высушивают его прокаленным сернокислым натрием и перегоняют из колбы с дефлегматором. Главную фракцию собирают при 138° С.
Выход около 30 г (70% теоретического). Чистый уксусноизоамиловый эфир имеет т. кип. 142°С, ![]() .
.
Реактивы:
Изоамиловый спирт .................25 г (0,28 г-мол)
Уксуснокислый натрий безводный...........25 г (0,30 г-мол)
Серная кислота (d 1,84) Сода 10%-ный раствор. Хлористый кальций.
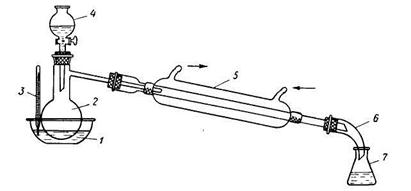
1 — баня; 2 — реакционная колба; 3 — термометр; 4 — капельная воронка; 5—холодильник; 6 — алонж; 7 — приемник.
Синтез проводят в приборе, изображенном на рис. 41. В колбу Вюрца емкостью 150 мл, снабженную капельной воронкой и соединенную с нисходящим холодильником, помещают 25 г растертого в порошок безводного уксуснокислого натрия (примечание 1). Из капельной воронки понемногу приливают смесь из 25 г изоамилового спирта и 25 г (13,5 мл) концентрированной серной кислоты (примечание 2). При этом колбу непрерывно нагревают на масляной бане при 150°С (термометр опущен в баню). По окончании реакции и прекращении отгонки дистиллята верхний слой (смесь уксусноизоамилового эфира и изоамилового спирта) отделяют в делительной воронке, промывают раствором соды, затем два раза водой, высушивают хлористым кальцием и перегоняют из колбы с дефлегматором, отбирая фракции: 1) до 138°С, 2) 138—142°С. 2-я Фракция представляет собой уксусноизоамиловый эфир. Выход 24 г (67% теоретического). Чистый уксусноизоамиловый эфир имеет т. кип. 142°С, ![]() .
.
ПРИМЕЧАНИЯ.
1. Для получения безводного уксуснокислого натрия нагревают 50 г кристаллической соли в плоской железной чашке. Сначала соль плавится в кристаллизационной воде, а после испарения воды затвердевает. При дальнейшем нагревании безводную соль расплавляют, несколько охлаждают, вынимают из чашки затвердевшую и еще теплую соль, растирают ее в порошок и ссыпают в склянку с притертой пробкой. Если имеется продажная безводная соль, то ее переплавляют еще раз.
2. При смешении изоамилового спирта с серной кислотой образуется изоамилсерная кислота; серную кислоту приливают постепенно к спирту при размешивании.
2. Литературный обзор. 2.1. Реакция этерификации и гидролиз сложных эфиров
Реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
![]()
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
![]()
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:
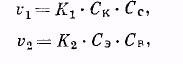
где v1 — скорость реакции этерификации; v2 — скорость реакции гидролиза; К1 и К2 — константы скорости обеих реакций; Ск, Сс, Сэ и Св — концентрации реагирующих и получающихся веществ (кислоты, спирта, эфира, воды).
В состоянии равновесия скорости реакций, протекающих в противоположных направлениях, равны, т. е. V1 = V2. Тогда К1СкСс = КгСэСв или:
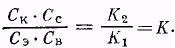
Частное К2/К1 является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
![]()
Однако можно изменить состояние равновесия и повысить выход сложного эфира, увеличивая концентрацию спирта (или кислоты). Например, если взять уксусную кислоту и спирт в молярном отношении, равном 1:2, выход эфира (из расчета на кислоту) повышается до 85%. Действительно, пусть концентрация эфира в состоянии равновесия (в молях) будет равна х, т. е. Сэ = х. Тогда и Св = х. Концентрация кислоты Ск = 1—х, концентрация спирта Сс = 2 — х. Следовательно,
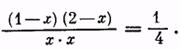
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Часто применяется и другой способ смещения равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Легко можно видеть, что уменьшение концентраций эфира или воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. Так, в случае получения низкокипящих сложных эфиров (например, уксусно-этилового с температурой кипения 77°С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с температурой кипения 125°С или уксусноизоамилового с температурой кипения 142°С) удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропа с парами соответствующего спирта. При конденсации паров в холодильнике происходит расслоение этих ограниченно смешивающихся жидкостей и вода, как более тяжелая, собирается на дне поставленной на пути конденсата «ловушки» (см. рис. 27). Азеотропную отгонку воды можно использовать и в случае этерификации кислот этиловым или пропиловым спиртом, которые в жидкой фазе смешиваются с водой во всех отношениях. В этом случае для отделения воды от сконденсировавшегося в холодильнике спирта в реакционную смесь приходится добавлять третий компонент, образующий с водой и спиртом нераздельно кипящую смесь, но в жидкой фазе с водой не смешивающийся. Его роль состоит в том, что он экстрагирует из конденсата спирт и возвращает его в реакционный сосуд. В качестве такого компонента могут использоваться бензол, хлороформ, четыреххлористый углерод и некоторые другие жидкости, но из перечисленных только бензол можно использовать в «ловушках». Хлороформ и четыреххлористый углерод обладают большей плотностью, чем вода, и для отделения воды от реакционной смеси в случае использования этих жидкостей требуется «ловушка» другой конструкции.
При комнатной температуре реакция протекает очень медленно. При смешении эквимолярных количеств спирта и кислоты для достижения равновесных концентраций требуется до 16 лет. Повышение температуры ускоряет реакцию (так, в случае взаимодействия этилового спирта с уксусной кислотой при 110° С равновесие достигается через 10 дней, а при (155° С — через несколько часов).
Особенно сильное ускорение реакции этерификации достигается применением катализаторов — водородных ионов, получающихся при диссоциации сильных минеральных кислот. В качестве катализаторов чаще всего используются концентрированная серная кислота или сухой хлористый водород, ток которого пропускается через реакционную смесь. Найдено, что скорость реакции возрастает с увеличением количества катализатора; однако известно также, что добавка 0,01% серной кислоты достаточна для образования этилацетата из спирта и уксусной кислоты. Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не могут вызывать сдвига равновесия.
Карбоновые кислоты, как видно из вышесказанного, реагируют со спиртами относительно медленно. Это объясняется слабой активностью карбонильной группы в кислотах по отношению к нуклеофильным агентам по сравнению с активностью той же группы в ангидридах и хлорангидридах кислот, поскольку +М-эффект гидроксильной группы приводит к уменьшению положительного заряда карбонильного углерода
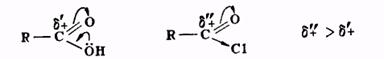
Скорость этерификации карбоновой кислоты тем выше, чем больше положительный заряд карбонильного углерода. Величина δ+ на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом; электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора.
Сильное влияние на скорость реакции этерификации оказывают также пространственные факторы. С увеличением объема связанных с карбоксилом углеводородных радикалов и с повышением объема этерифицируемых спиртов скорость этерификации уменьшается. Среди спиртов одного молекулярного веса быстрее всего взаимодействуют с кислотами первичные, медленнее — третичные спирты.
Реакцию этерификации можно проводить и в паровой фазе над твердыми катализаторами. Пары спирта и кислоты при 280—300° С пропускают через трубку с катализатором (ThO2 или TiO2). Выходы сложных эфиров в этом случае такие же, как и при реакциях в гомогенной фазе.
Аминокислоты образуют сложные эфиры при взаимодействии со спиртами в присутствии сухого хлористого водорода. Роль хлористого водорода здесь не ограничивается катализом реакции или сдвигом равновесия за счет связывания воды. В присутствии хлористого водорода аминокислота, находившаяся ранее в форме внутренней соли, превращается в хлористоводородную соль аминокислоты, причем карбоксильная группа из неактивной формы аниона переходит в реакционноспособную форму —СООН:
![]()
В результате этерификации в этих условиях эфиры также получаются в виде солей. Например, из аминоуксусной кислоты (гликоколя) и абсолютного этилового спирта образуется хлористоводородная соль эфира гликоколя
![]()
Свободный эфир из соли можно получить, удаляя хлористый водород окисью серебра:
![]()
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
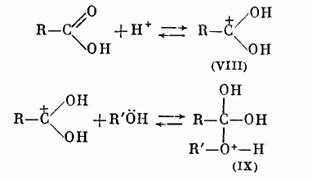
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
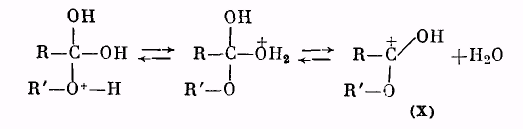
Катион (X) в результате отщепления протона образует молекулу сложного эфира:

Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
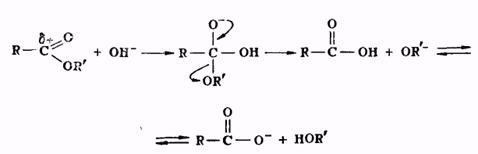
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
Список литературы
1. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
Похожие работы
... вещество с запахом пота, т.пл. 31 С, т. кип. 233 С. Получают ее каталитическим гидрированием бензойной кислоты. [8] 3. ПРИМЕРЫ ПРОБЛЕМНЫХ СИТУАЦИЙ И ИХ РЕШЕНИЕ Проблемные ситуации при изучении предельных одноосновные кислоты можно рассмотреть через систему уроков по теме: «Карбоновые кислоты». УРОК 1. Карбоновые кислоты, их классификация. Краткое содержание. Строение карбоксильной группы. ...
... Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или же, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетическом родстве данных соединений — к липидам относят жирные кислоты и их производные [1]. В то же время в биохимии ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... деятельность. Поиск методов и форм обучения, способствующих воспитанию творческой личности, привел к появлению некоторых специфических способов обучения, одним из которых являются игровые методы. Реализация игровых методов обучения при изучении химии в условиях соблюдения дидактических и психолого-педагогических особенностей, повышает уровень подготовки учащихся. Слово «игра» в русском языке ...
0 комментариев