Навигация
3.6 Из нитрилов
![]()
Хотя от нитрилов можно перейти к сложным эфирам через амиды, обычный метод состоит в превращении их в иминоэфир, который можно выделять в качестве промежуточного соединения, а можно и не выделять. Для этой реакции применяют различные катализаторы, такие, как хлористый водород, бромистый и йодистый водород, серную кислоту и моногидраты бензол- и толуолсульфокислот. Следует отдать предпочтение аренсульфокислотам по сравнению с хлористым водородом или серной кислотой. С хлористым водородом получаются, более высокие выходы, чем с бромистым и йодистым водородом. Как показывает приведенное уравнение реакции, если исключить из участия в реакции воду, можно получить иминоэфиры. В некоторых случаях для реакции, ведущей к образованию иминоэфира, вода не нужна совсем, а иногда в отсутствие воды реакция не идет.
Этот метод синтеза находит широкое применение для получения полифункциональных соединений. Так, например, малоновые эфиры обычно синтезируют из эфиров а-цианкарбоновых кислот. Из циангидринов получают оксиэфиры, из кетоцианидов — кетоэфиры, а из аминоцианидов—аминоэфиры. Выходы при этом обычно бывают удовлетворительные.
3.7. Из сложных эфиров и спиртов (реакция переэтерификации)![]()
Переэтерификация представляет собой равновесную реакцию, которую можно сдвинуть в прямом направлении, применяя избыток одного из реагентов или, что предпочтительно, удаляя один из компонентов — RCOOR" или R'OH. Если температура кипения R'OH ниже, чем R"OH, можно проводить разделение, при помощи фракционирования: иногда для удаления получающихся продуктов пользуются образованием азеотропных смесей. Катализаторами такой реакции обмена служат кислоты, например серная или толуолсульфокислота, или основания, например алкоголяты алюминия. Как правило, превращение лучше протекает с первичными спиртами, причем наиболее реакционноспособен метиловый спирт, хотя в некоторых случаях с успехом можно применять вторичные спирты.
Этот метод синтеза пригоден для синтеза алкиловых эфиров высших жирных кислот из жиров, масел и восков. Путем такого обмена удобно получать и многие другие сложные эфиры, например эфиры акриловой и диэтиламино-а-фенилмасляной кислот. Наиболее важным эфиром енола, применяемым для получения сложных эфиров, является изопропенилацетат. Этот реагент легко доступен, и из него можно получать различные сложные эфиры с высоким выходом в результате обмена со спиртом в присутствии кислых катализаторов
![]()
Эта реакция может протекать с образованием кетена, из которого получают изопропенилацетат, но возможно также, что при реакии, катализируемой кислотой, образуется ион ацилия, атакующий спирт. Приведен пример образования сложного эфира, а также эфира енола.
Механизм переэтерификации обычных сложных эфиров сходен с механизмом гидролиза сложных эфиров, катализируемого кислотами и щелочами. Кетоэфиры не требуют катализаторов для переэтерификации, и обмен спиртовых групп происходит количественно при температуре паровой бани. трет-Бутиловый спирт, однако, обменивается очень медленно
3.8. Из лактонов и спиртов (реакция переэтерификации)![]()
Этот метод синтеза находит лишь ограниченное применение при получении сложных эфиров. Бромистый водород в спиртовом растворе дает бромзамещенный сложный эфир, а хлористый водород приводит к образованию оксиэфира. Вместо галогеноводорода применяют и другие галогенпроизводные, например пятибромистый фосфор и тионилхлорид. Наиболее детально изучена, по-видимому, реакция пропиолактона. В этом случае при взаимодействии со спиртом в зависимости от природы катализатора образуются два продукта. С основаниями происходит расщепление по связи кислород—углерод карбонила, приводящее к образованию оксиэфиров
![]()
В отсутствие катализатора или с кислыми катализаторами происходит расщепление связи кислород — углерод метиленовой группы с образованием р-алкоксикислот
![]()
Механизм этого расщепления сходен с механизмом, предложенным для сложных эфиров, поскольку лактоны можно рассматривать как внутримолекулярные сложные эфиры. Выходы при этой реакции получаются удовлетворительные.
3.9. Из сложных эфиров и кислот (реакция переэтерификации)![]()
Этот обмен происходит, и часто с хорошими выходами, в случае ациламинокислот и при получении виниловых эфиров различных алифатических и ароматических карбоновых кислот. N-Ациламинокислоты, например фталоилглицин или тозилглицин, превращаются в метиловые или этиловые эфиры под действием алкилформиата или алкилацетата. Обычно в качестве катализаторов используют 96% -ную серную кислоту или моногидрат толуолсульфокислоты. Неацилированные аминокислоты, за исключением фенилаланина нельзя превратить в сложные эфиры при помощи такого катализатора, как серная кислота.
«Винильный обмен» требует применения в качестве катализатора ртутной соли сильной кислоты. Температура при этой реакции должна поддерживаться в области 20—80 °С; более высокие температуры приводят к образованию диэфиров этилидена и ангидридов кислот. Этот метод синтеза позволяет получать более чистые мономеры, чем те, которые образуются в результате присоединения ацетилена к кислоте. Считают, что в этом случае соль ртути образует ацетиленовый комплекс (I)
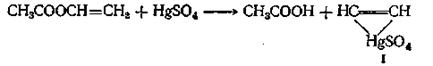
реагирующий с кислотой с образованием сложного эфира (II)
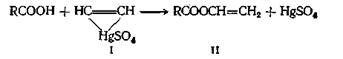
![]()
Эта реакция обмена дает высокие выходы с галогенпроизводными, способными к реакции замещения по механизму SN2 в апротонных растворителях. Хорошие выходы метиловых эфиров высокой степени чистоты получаются с йодистым метилом, бикарбонатом натрия и соответствующей кислотой при проведении реакции в диметилацетамиде при комнатной температуре. При реакции с другими алкилгалогенидами синтезирован ряд сложных эфиров. Можно использовать для этой реакции соль натрия или серебра с триэтиламином в качестве катализатора или саму свободную кислоту с триэтиламином. Фенациловые эфиры, получаемые этим методом, используют для характеристики карбоновых кислот.
При получении тритиловых эфиров следует предпочесть бромистый триэтил хлористому, поскольку он более реакционноспособен и менее гигроскопичен и его можно применять с безводной серебряной, натриевой или калиевой солью.
При реакции соли, уксуснокислого тетраэтиламмония, с оптически активным галогенпроизводным образуется сложный эфир с меньшей степенью рацемизации, чем при применении уксусной кислоты

Реакция медной соли кислоты с каким-либо арилгалогенидом в высококипящем растворителе — единственно пригодный способ получения ариловых эфиров из арилгалогенидов. В качестве промежуточного соединения образуется медьорганическое соединение
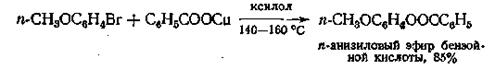
Эту реакцию можно применять также в случае винилгалогенидов с целью получения виниловых эфиров.
3.11. Из солей и кислот и других алкилирующих агентов
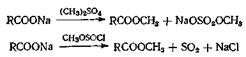
При этом методе синтеза обычно в качестве алкилирующегс агента применяют диметилсульфат; кроме того, используются алкилпирокарбонаты, алкилсиликаты, алкилфосфонаты, ацетали и даже алкилхлорсульфиты. В последнем случае эфир получается в результате пиролиза реакционной смеси с выделением двуокиси серы. Алкилирование, как правило, проводят в щелочной среде; в этих условиях алкилируется как пространственно затрудненная, так и незатрудненная карбоксильная группа. При проведении реакции в кислых условиях алкилируется только пространственно незатрудненная карбоксильная группа. Выходы часто получаются высокие.
В методе, предложенном недавно, свободную кислоту алкили-руют при помощи какого-нибудь алкилсульфата и дициклогексил-этиламина в качестве акцептора протонов
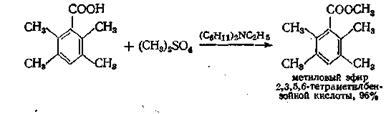
Выходы некоторых эфиров составляют 96—97% (метиловые эфиры) и 84% (этиловые эфиры).
3.12. Из медных солейЭта реакция дает возможность осуществить весьма необычный синтез эфиров арилбензойных кислот. При пиролизе медной соли ароматической кислоты образуется с хорошим выходом сложный эфир. Необычным является то, что арильная группа становится в орто-положение по отношению к присутствующей вначале карбоксильной группе, выделяющейся в процессе реакции, как показано ниже:

Механизм этой реакции, возможно, представляет собой циклозамещение, но он еще не установлен окончательно. Окись меди частично может быть заменена воздухом.
3.13. Из тетраалкиламмоиевых солей![]()
Этот метод синтеза первоначально применялся для получения сложных эфиров пространственно затрудненных бензойных кислот. Метиловые эфиры 2,4,6-триметил- и 2,4,6-триэтилбензойной кислот получены с выходом от 63 до 90%. Сложный эфир также образуется при непосредственном нагревании четвертичного галогенида аммония с ацетатом натрия и уксусной кислотой.
3.14. Из амидов![]()
Превращение амидов в сложные эфиры — термодинамически невыгодная реакция и поэтому требует специальных условий. И действительно, реакция легко осуществляется лишь в необычных условиях. В качестве одного из примеров приведем гладкое превращение о- или п-нитроацетанилидов в сложные эфиры при взаимодействии со спиртами в присутствии алкоголята натрия. При этом очевидно, происходит алкоголиз через анион нитроацетанилида.
Амиды можно превратить в изоцианаты реакцией Гофмана с гипобромитом, а изоцианаты затем превратить в карбаматы действием спирта. Поскольку мочевина при нагревании превращается в изоциановую кислоту HN=C=O, она может реагировать со спиртами, образуя в качестве производных сначала изоциановую кислоту, а затем алкилкарбаматы (уретаны). Так, например, бензилкарбамат легко получается при кипячении мочевины и бензилового спирта до прекращения выделения аммиака
![]()
Любое соединение, приводящее к образованию изоцианата, является потенциальным источником карбамата, если проводить реакцию каком-нибудь спирте в качестве растворителя. Так, например, : облучении азида кислоты в этиловом спирте образуется уретан
-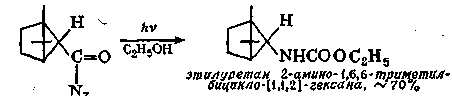 о
о
Из изоциановой кислоты, которая, вероятно, в кислых растворax сначала димеризуется, можно получить эфиры аллофановой кислоты
![]()
Многие эфиры аллофановой кислоты и целлосольва представляют собой кристаллические соединения и удобны для получения про водных.
Наиболее удобным, хотя и имеющим ограниченное применен методом превращения амида в сложный эфир является перегруппировка р-оксиэтиламида под влиянием концентрированной соляной кислоты
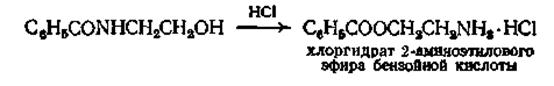

Эта реакция проводилась с различными замещенными бензотрифторидами и бензотрихлоридами, причем выходы составляли от 42 до 90%. Для более лабильных тригалогензамещенных, таких, как 3,3,3-трихлор-1,1-ди-(п-хлорфенил)пропен-1, при кипячении его с метиловым спиртом выход сложного эфира составляет 95%.
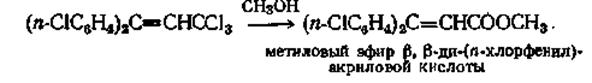

Сложные эфиры можно получить из а,а-дихлоралкилзамещенных простых эфиров при гидролизе их водой. Для гидролиза а,а-дифторалкилзамещенных простых эфиров необходимо применять более сильные гидролизующие агенты, такие, как 95%-ную серную кислоту. Выходы при этих реакциях гидролиза составляют от 55 до 83%. Механизм этого расщепления точно не установлен, но можно предполагать, что этот гидролиз протекает с большей легкостью, чем гидролиз тригалогензамещенных, в результате влияния простой эфирной группы.
3.17. Из карбоновых кислот и дивинилртутиЭтот метод синтеза применим только для получения сложных виниловых эфиров, простых виниловых эфиров (из фенола) и винилсульфидов (из тиофенола или алкилтиола). Для проведения реакции ароматическую или алифатическую карбоновую кислоту нагревают саму по себе или в каком-нибудь растворителе с дивинилртутью, полученной из хлорида ртути и винилмагнийбромида в тетрагидрофуране. В отсутствие растворителя реакция обычно проходит более чем на 50% за время меньше 5 мин при нагревании на паровой бане. Для безопасности реакцию необходимо проводить в хорошо вентилируемой тяге, поскольку дивинилртуть высоко токсична. Если проводить реакцию в инертном растворителе, можно выделить образующийся в качестве промежуточного соединения винилртутный эфир RCOOHgCH=CH2- Выходы виниловых сложных эфиров составляют от 38 до 74%.
3.18. Механизм реакции этерификации
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
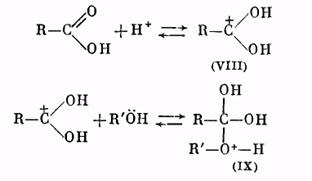
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
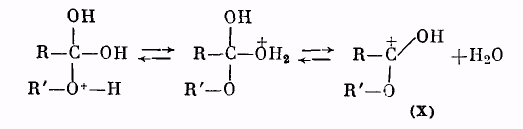
Катион (X) в результате отщепления протона образует молекулу сложного эфира:

Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
Присутствие О18 установлено сжиганием образца эфира и анализом образующихся продуктов сгорания (CO2 и Н2О) на присутствие тяжелого изотопа кислорода.
Гидролиз сложных эфиров представляет собой реакцию, обратную реакции их образования. Гидролиз может быть осуществлен как в кислой, так и в щелочной среде. Для кислого гидролиза сложных эфиров справедливо все, что было сказано выше применительно к реакции этерификации, об обратимости и механизме процесса, о методах смещения равновесия. Щелочной гидролиз сложных эфиров проходит через следующие стадии:
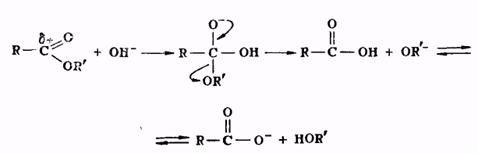
Он является процессом необратимым, поскольку богатый электронами анион кислоты не способен взаимодействовать с нуклеофильной молекулой спирта.
Практически щелочной гидролиз сложных эфиров проводят в присутствии едких щелочей КОН, NaOH, а также гидроокисей щелочноземельных металлов Ва(ОН)2, Са(ОН)2 Образующиеся при гидролизе кислоты связываются в виде солей соответствующих металлов, поэтому гидроокиси приходится брать по крайней мере в эквивалентном отношении со сложным эфиром. Обычно используют избыток основания. Выделение кислот из их солей осуществляется с помощью сильных минеральных кислот.
В качестве растворителя основания для реакции гидролиза чаще всего применяют воду, которая, однако, не растворяет сложный эфир. Реакция идет на поверхности раздела двух фаз и требует, поэтому хорошего перемешивания. Иногда реакцию бывает целесообразно проводить в гомогенной среде, используя в качестве растворителя водный спирт. При этом, однако, нужно иметь в виду, что для выделения кислоты перед подкислением раствора спирт необходимо удалить (отогнать).
Список литературы
1. Терней А. Современная органическая химия: В 2 т. - М.: Мир, 1981. - Т.1 - 670 с; Т.2 - 615 с.
2. В. Ф. Травень. Органическая химия. Том 1. – М.: Академкнига, 2004, - 708 с.
3. Общая органическая химия. Карбоновые кислоты и их производные. Том 4. М., Химия, 1983, 729с.
4. Богословский Б.Н., Казакова З.С. Скелетные катализаторы, их свойства и применение в органической химии. М., Госхимиздат, 1957.
5. Голодников Г.В. Практические работы по органическому синтезу. Л., Изд-во ЛГУ, 1966, 697с.
6. Дорофеенко Г.Н., Жданов Ю.А., Дуленко В.И. и др. Хлорная кислота и ее соединения ворганическом синтезе. Ростов, изд-во Ростовского ун-та, 1965.
7. Голодников Г.В., Низовкина Т.В., Рыскальчук А.Т. Практикум по органическому синтезу. Л., Изд-во ЛГУ, 1967.
8. Крешков А.П., Курбатов И.Н. Лабораторные работы по синтезу и анализу органических соеднений. М., изд-во Артиллерийского ордена Ленина академии Красной армии им. Дзержинского, 1940.
9. Лабораторные работы по органической химии. Изд. 3-е. М., Высшая школа, 1974.
10. Шабаров Ю.С. Органическая химия: В 2-х кн. - М.:Химия, 1994.- 848 с.
11. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М.: Высш. шк., 1973. - 623 с.
12. Препаративная органическая химия. Изд. 2-е, М., Госхимиздат, 1964.
13. Храмкина М.Н. Практикум по органическому синтезу. Изд. 4-ое, Л., Химия. 1977.
Похожие работы
... комнатной температуре на несколько часов. Растворитель отгоняют в вакууме, а твердый остаток кристаллизуют из уксусной кислоты. Выход продукта 9-5%; т. кип. >360°. 2. Литературный обзор. Бензимидазол, его производные, их синтезы и свойства Данная работа посвящена изучению обладающих ценными свойствами бензимидазолов общей формулы их таутомеров, их стереоизомеров, их смесей ...
... вещество с запахом пота, т.пл. 31 С, т. кип. 233 С. Получают ее каталитическим гидрированием бензойной кислоты. [8] 3. ПРИМЕРЫ ПРОБЛЕМНЫХ СИТУАЦИЙ И ИХ РЕШЕНИЕ Проблемные ситуации при изучении предельных одноосновные кислоты можно рассмотреть через систему уроков по теме: «Карбоновые кислоты». УРОК 1. Карбоновые кислоты, их классификация. Краткое содержание. Строение карбоксильной группы. ...
... H2C CH2 / O NaPO3 Н2С——СН2 CH2=CH─CH=CH2 │ │ - H2O H2C CH2 / O АРОМАТИЧЕСКИЕ ОКСИСОЕДИНЕНИЯ ФЕНОЛЫ Термин «фенолы» происходит от старинного названия бензола «фен», введённого Лораном (1837 г.), и обозначает ароматическое ...
... ¾¾® CH—OH II -HCl II -NaCl II ½ CH2 CH2 CH2 CH2—OH пропилен хлоритый аллиловый глицерин аллил спирт Простые эфиры Простыми эфирами называют производные спиртов, образованные в результате замещения водорода гидроксильной группы спирта на углеводородный остаток. Эти соединения можно рассматривать и как производные воды, ...
0 комментариев