Навигация
1.1 Кристалічні структури
Практично всі матеріали, що мають критичну температуру переходу в надпровідний стан вище 77 К, є купратами. Спільним для всіх одержаних купрумвмісних надпровідних композицій є:
1. Структури фаз – похідні від структури перовскіту.
2. Структури мають велику кількість аніонних вакансій, концентрацію яких можна легко варіювати, змінюючи умови синтезу (температуру прожарювання, парціальний тиск кисню та інше.). Аніонні вакансії у подібних структурах створюються або шляхом гетеровалентного заміщення катіона, або в похідній структурній матриці є вакантні позиції, заповнення яких атомами кисню вимагає малих енергетичних витрат та не супроводжується руйнуванням структурної матриці. Так, наприклад, у структурі Sr2CuO3 внаслідок упорядкованості аніонних вакансій спостерігається сильна деформація перовскітної комірки (а=3,91 Å, b=3,48 Å [14]). Проникнення у вакантну аніонну позицію цієї структури надлишкових атомів кисню призводило до аномально малої відстані Cu-O, а можливі деформації вимагали більших енергетичних витрат. Тому для цієї структури є лише одна можливість варіювання концентрації аніонних вакансій: гетеровалентне заміщення атомів стронцію на одновалентні катіони.
3. В структурах є атоми купруму "формально" з різними ступенями окиснення (+2 та +3). Проте, мабуть, більш правильно стверджувати (що і було підтверджено експериментальними дослідженнями): унаслідок зміни кількості атомів кисню в структурах відбувається утворення дірок у зоні провідності (зниження рівня Фермі). Утворення зони провідності в шарі (CuO2) відбувається в наслідок перекриття орбіталі 3d1x2-y2, що має завдяки ефекту Яна Тейлора найбільшу енергію, та 2рх, 2ру-орбіталей атомів кисню, що розміщені в екваторіальних площинах.
4. Структури ВТНП оксидів – шаруваті, обов’язково їх елементом є наявність площин CuO2. Шари СuО2 вважаються активними компонентами у високотемпературних надпровідниках. Виділяють три різних типи Cu-O координації: квадрати CuO4, піраміди CuО5 та октаедри СuО6, що містять кисень у вершинах, а також над та під шаром CuO2 (рис. 1.1).
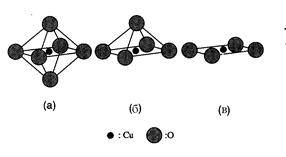
Рис. 1.1. Типи шарів Cu із різною Сu-О координацією: (а) октаедр СuО6, (б) піраміда CuО5, та (в) квадрат СuО4 [15].
Шари, що розташовані між шарами CuO2, та виконують функцію накопичення заряду, можуть мати набагато складнішу структуру ніж шари CuO2. Утворення шаруватих структур відбувається або завдяки впорядкуванню аніонних вакансій, або завдяки порушенню ідеальної послідовності укладки шарів уздовж осі 4-го порядку.
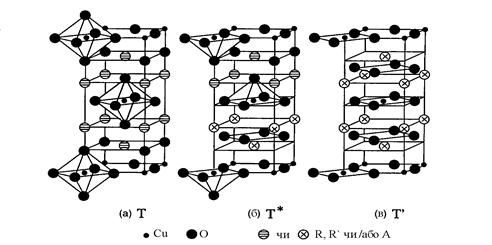
Рис. 1.2. Кристалічні структури купратів 214: фази Т, Т* та Т’ (R, R’ - рідкісноземельні елементи, А = Ba, Sr, Ca,Ce чи Th) [15].
Сполуки-214. Сполуки (R, R’)2-xAxCuO4, де R та R’ – рідкісноземельні елементи, А = Ba, Sr, Ca, Ce чи Th, мають Тс ≤ 36 К. В залежності від іонних радіусів R та R’ здатні утворювати три структурні фази Т, Т’ та Т* (рис. 1.2). Вони мають один шар CuO2 на формульну одиницю. Шар CuO2 містить цілий ряд октаедрів CuO6 в фазі Т, пірамід CuO5 в фазі Т*, та квадратів CuO4 у фазі Т’. Ці високотемпературні надпровідники мають тетрагональну симетрію [14,16-19].
Сполуки R-123. RBa2Cu3O7 (відомі як RBCO, або R-123) мають Тс до 100 К, де R = Y чи рідкісноземельні елементи за винятком Се чи Tb.

Рис. 1.3. Кристалічна структура сполук R123 (R - рідкісноземельний елемент, крім Ce чи Tb) [15].
Кристалічна структура сполук 123 - орторомбічна [16,20-22] (рис. 1.3). Вони містять два шари CuO2 та один шар ланцюжка CuO на формульну одиницю. Коли кисневий індекс стає менший за ~6,4, атоми кисню в ланцюжку CuO втрачають свій довго-лінійний порядок, і структура стає тетрагональною та не надпровідною [16,23].
1.2 Методи синтезу полікристалічних високотемпературних надпровідників
В 1911 р. Г. Камерлінг-Оннес відкрив надпровідниковість ртуті, охолодивши її рідким гелієм до температури 4,2 К. Як з’ясувалось пізніше, повна втрата електричного опору під час переходу в надпровідниковий стан є не єдиною незвичайною властивістю речовин. В 1933 р. В. Мейснер і Р. Оксенфельд експериментально встановили, що надпровідник повністю витісняє магнітне поле із свого об’єму (якщо індукція поля не перевищує критичного значення). „ Абсолютний ” діамагнетизм надпровідникового стану означає можливість вільно висіти магніту над чашою з надпровідника.
У вересні 1986 р. з’являється наукове повідомлення Г.Беднорца та А.Мюллера про те, що в керамічних зразках на основі Ba – La – Cu – O можлива високотемпературна надпровідність.
ВТНП – матеріали можуть бути використані у великій кількості технологічних новацій ХХІ ст. – від левітуючих (зависаючих) потягів на магнітній подушці та підшипників без тертя до медичних томографів, які дозволяють контролювати біотоки людського мозку [ 2 ]. ВТНП – матеріали одержують шляхом кристалізації продукту із розплаву протягом тижня, а для завершення процесу використовується хімічна реакція окиснення при низькій температурі. Без такої обробки матеріал не стає надпровідником і не спроможний зависати в магнітному полі.
Дефекти, або в більш загальному розумінні мікроструктури, визначають структурно важливі властивості матеріалу. Оскільки сумарна характеристика складу речовин, його агрегатного стану і алотропної модифікації можуть бути замінені більш загальним поняттям „ фаза ”, тому попередні визначення зміняться в більш загальне і більш просте:
матеріал = фаза (и) + мікроструктура.
Таким чином, матеріал – це реальна форма існування фази або сукупність фаз. І якщо хімік-синтетик обмежується одержанням індивідуальних фаз, то матеріалознавцю крім цього необхідно сформувати оптимальну мікроструктуру. Часто ця задача набагато важча, ніж одержання індивідуальної фази, особливо якщо необхідно відтворити методику у виробництві.
Звичайні ВТНП – матеріали, які отримані методом твердофазного синтезу, являють собою кераміку, мікроскопічні кристаліти ВТНП – фази розміщені в просторі відносно один одного і слабко взаємопов’язані між собою [ 4 ].
По-перше, шестикутні блоки-пігулки, з яких виготовлений ВТНП – п’єдестал, складається з крупнокристалічних доменів, кожен з яких являє собою пачку гігантських (0,1 – 1 см) пластичних кристалітів – аркушів, епітаксіально (в одній кристалографічній орієнтації), що зрослися паралельно один до одного. По-друге, матеріал є композитом, в надпровідниковій матриці рівномірно розподілені ультродисперсні включення ненадпровідникових частинок. В результаті надпровідниковість матеріалу зберігалась, тому в тонкому поверхневому шарі зразка протікає струм, магнітне поле екранує зовнішнє поле. Саме це дозволило залучити ВТНП – матеріал в продуману форму і повністю реалізувати потенціал фізичного явища при високій температурі. Такий матеріал може висіти над і під магнітом, а також від невеликого поштовху обертатися в повітрі в будь-якому положенні, нехтуючи силою тяжіння.
Єдиний шлях отримання мікроструктури – це кристалізація розплаву, в якому швидкість дифузії більша, ніж в твердому тілі. Крім того, із-за відносно малої в’язкості розплаву можливе „ підстроювання ” формуючих анізотропних кристалітів відносно один одного. Все це створює умови для утворення оптимальної мікроструктури ВТНП – матеріалу.
Плавлення ВТНП – фаза пов’язана з хімічною реакцією розпаду : з твердого тіла складу ![]() утворюється фаза іншого складу
утворюється фаза іншого складу ![]() , рідина (розплав Y) і газ (кисень
, рідина (розплав Y) і газ (кисень ![]() ) :
) :
![]()
![]() (1)
(1)
В зворотному процесі – кристалізації – всі три різнорідних компонента (тверде тіло, рідина і газ) повинні бути „ зібрані ” в ВТНП-фазу :
![]() (2)
(2)
Для протікання кристалізації (2) потрібна рушійна сила, відхилення від стану рівноваги, які призводять до виникненню потоків речовин і енергії. Згідно відомому принципу Ле Шательє, якщо на систему, яка знаходиться в стані рівноваги, вплинути будь-яким чином зовні (тиск, температура, концентрація), то система буде протидіяти зовнішньому втручанню. Існує кілька способів протікання кристалізації за бажаною схемою. При кристалізації з розплаву можна :
1) охолоджувати вихідну суміш з оптимально вибраною швидкістю dT/dt або досягти оптимального переохолодження Δ T, що частіше всього застосовується в експериментах ;
2) знижувати парціальний тиск кисню Δ![]() ;
;
3) керувати градієнтами концентрації компонентів суміші ;
4) змінювати кількість і склад розплаву при контакті з пористою підкладкою.
Формування оптимальної мікроструктури пов’язане з закономірностями розвитку кристалітів, які початково виникають як при невеликих, так і при незначних відхиленнях системи від стану рівноваги. Природнім „ барометром ” нерівноваги розплаву прийнято вважати як пересичення по одному або по декількох компонентах, абсолютне відхилення від концентрації досягає при новій рівновазі, після чого виникає релаксація системи. Не так важливо, яким методом утворене пересичення, але його високий рівень необхідний для створення макрокількості речовини, що твердіє. Тобто, формування мікроструктури відбувається в нерівноважних, динамічних умовах. Тому доводиться вести пошук відтворених методів отримання матеріалу, які складаються з добре сформованих кристалітів оптимального розміру, взаємна орієнтація стабілізується міцними міжкристалічними контактами.
У деякому випадку (проведення процесу при певній температурі) концентрація йонів ітрію (або іншого рідкісноземельного елемента) в розплаві повинна перевищувати рівноважну, а вміст кисню відповідати стехіометрії реакції (2). При температурі вище області існування ВТНП-фази кристалізація неможлива. Якщо вміст кисню в розплаві малий, то навіть при оптимальній температурі і інтенсивному потоку йонів ітрію від частинок ненадпровідникової фази ![]() , які знаходяться в розплаві, може лише змінюватися середній розмір цих частинок, але кристалічна ВТНП-фаза
, які знаходяться в розплаві, може лише змінюватися середній розмір цих частинок, але кристалічна ВТНП-фаза ![]() не утвориться.
не утвориться.
Ще один випадок – коли розплав насичений киснем (наприклад, кристалізацію проводять на повітрі), а температура достатньо низька, щоб ВТНП-фаза ![]() змогла сформуватися (‹100ْС). Здавалося б, все підготовлено для її утворення і залишається лише додатково забезпечити інтенсивний потік йонів ітрію в розплаві, але, на жаль, концентрація йонів ітрію різна від точки до точки, оскільки специфіка розчинення частинок фази
змогла сформуватися (‹100ْС). Здавалося б, все підготовлено для її утворення і залишається лише додатково забезпечити інтенсивний потік йонів ітрію в розплаві, але, на жаль, концентрація йонів ітрію різна від точки до точки, оскільки специфіка розчинення частинок фази ![]() в розплаві, необхідна для протікання реакції (2), залежить від середнього розміру і загальної кількості. Крім того, розчинення займає деякий час із-за дифузії катіонів ітрію, яка призводить до виникнення індукційного періоду формування значно кристалічної фази
в розплаві, необхідна для протікання реакції (2), залежить від середнього розміру і загальної кількості. Крім того, розчинення займає деякий час із-за дифузії катіонів ітрію, яка призводить до виникнення індукційного періоду формування значно кристалічної фази ![]() .
.
Отже, процес кристалізації ВТНП-фази може повністю змінитися при невеликих відхиленнях від оптимальних умов для протікання реакції (2).
Ріст кристаліта з розплаву – лише друга (хоч і основна) стадія процесу кристалізації. Їй передує утворення зародка – центру кристалізації, - якому може дати життя локальна флуктуація хімічного складу або температура в розплаві. Але для росту кристаліта одного виникнення зародка недостатньо, необхідно, щоб він був стабільний. Згідно класичним уявленням, в залежності від розміру, раптово утворений зародок може або „ вижити ” і розвиватися далі, або розпастися, оскільки „об’ємна ” енергія, що виділяється повинна компенсувати роботу для формування нової межі розділу, а вона, в свою чергу, залежить від величини поверхневої енергії.
В нелінійній термодинаміці, яка застосовується до динамічних процесів, існує зручний прийом аналізу об’єкта : він розбивається на велике число елементарних об’ємів, кожен зі своїми параметрами стану і зв’язком з сусідніми об’ємами. В реальній системі локальні нелінійні хімічні процеси (утворення з розплаву нової твердої фази з впорядкованою будовою кристалічної гратки) існують дифузією, які здійснюють зв’язок між сусідніми елементами об’єму. Якщо в останніх протікають процеси хімічного типу, то вони намагаються відхилити систему від просторової неоднорідності, що призводить до флуктуації складу, температури. Отже, дифузія намагається підвищити однорідність. Відсутність зв’язку між елементами об’єму (швидкість дифузії незначна в порівнянні з швидкістю локальної хімічної реакції) призведе до строкатого набору випадкових станів. Але при швидкій дифузії будь-яка флуктуація миттю „ розсмоктується ” і знищується. В той же час, якщо частота виникнення флуктуації буде велика, то в такій системі може виникнути новий режим узгоджуваної поведінки. Тобто, практично будь-яка флуктуація може проявляти себе макроскопічно та існувати довго.
Найбільш зручний та універсальний прийом комп’ютерного моделювання таких систем – метод клітинних автоматів полягає в тому, що макросистема складається з великого числа елементів – „ клітинок ”. Кожен з елементів змінює свій стан, коли настає новий дискретний момент часу в залежності від того, якою була клітинка і її оточення. Тим самим робиться спроба врахувати енергетичний вплив навколишнього середовища на розвиток підсистеми, яка описує нелінійну поведінку макросистеми. Взаємодія цих простих елементів, локально зв’язаних, дозволяє простежити динаміку складної поведінки єдиного цілого.
Якими ж повинні бути добавки для хімічного контролю за кристалізацією? Ненадпровідниковий („ бінарний ”) барій купрат ![]() і надпровідниковий купрат
і надпровідниковий купрат ![]() різні за структурою. Згідно такої різниці фази можуть по-різному сприймати легуючу добавку, мати зовсім несхожі коефіцієнти поділу між твердою фазою і розплавом. Отже, селективність поділу – перша умова, яка повинна задовольняти добавку. Але цього недостатньо. Необхідно, щоб при невеликій концентрації вона помітно змінювала фізичні властивості ВТНП-фази
різні за структурою. Згідно такої різниці фази можуть по-різному сприймати легуючу добавку, мати зовсім несхожі коефіцієнти поділу між твердою фазою і розплавом. Отже, селективність поділу – перша умова, яка повинна задовольняти добавку. Але цього недостатньо. Необхідно, щоб при невеликій концентрації вона помітно змінювала фізичні властивості ВТНП-фази ![]() , не погіршуючи її надпровідниковість, тобто була б достатньо ефективною.
, не погіршуючи її надпровідниковість, тобто була б достатньо ефективною.
Рішення було знайдено після аналізу причин геометричної стабільності фаз типу ![]() . Відомо, що крім ітрію існує чотирнадцять братів-близнюків лантаноїдів, надзвичайно схожих за хімічними властивостями на ітрій (Се, Pr, Nd,…,Yb, Lu). В той же час в силу лантаноїдного стиснення йонний радіус цих елементів закономірно зменшується по мірі збільшення порядкового номеру. Це дає додатковий необхідний ступінь свободи в геометричному варіюванні параметрів кристалічної структури фази
. Відомо, що крім ітрію існує чотирнадцять братів-близнюків лантаноїдів, надзвичайно схожих за хімічними властивостями на ітрій (Се, Pr, Nd,…,Yb, Lu). В той же час в силу лантаноїдного стиснення йонний радіус цих елементів закономірно зменшується по мірі збільшення порядкового номеру. Це дає додатковий необхідний ступінь свободи в геометричному варіюванні параметрів кристалічної структури фази ![]() , легування рідкісноземельними елементами (РЗЕ) вибірково, оскільки каркасна структура барій купрату не спроможна включити в себе маленький трьохзарядний катіон, що підтверджується експериментально [ 9 ]. Ітрій може бути замінений більшістю лантаноїдів, і це не призведе до погіршення надпровідникових властивостей (якщо не використовується церій Се і празеодим Pr). Крім того, подібне легування виявляється ефективним, тому що змінює температуру перитектичного розпаду фаз
, легування рідкісноземельними елементами (РЗЕ) вибірково, оскільки каркасна структура барій купрату не спроможна включити в себе маленький трьохзарядний катіон, що підтверджується експериментально [ 9 ]. Ітрій може бути замінений більшістю лантаноїдів, і це не призведе до погіршення надпровідникових властивостей (якщо не використовується церій Се і празеодим Pr). Крім того, подібне легування виявляється ефективним, тому що змінює температуру перитектичного розпаду фаз ![]() .
.
Ітрієва позиція являє собою слабе місце в структурі надпровідникової фази, оскільки йон ітрію ![]() стискає структуру, утворюючи „ хімічний тиск ” і структурні викривлення. Внаслідок термічна стабільність такої викривленої структури знижується відносно невикривленої структури. Очевидно, що введення лантаноїдів з малим йонним радіусом більше дестабілізує структуру, а з великим йонним радіусом – виявляє протилежний ефект. Для оцінки геометричної стабільності подібних структур (до цього класу відноситься фаза
стискає структуру, утворюючи „ хімічний тиск ” і структурні викривлення. Внаслідок термічна стабільність такої викривленої структури знижується відносно невикривленої структури. Очевидно, що введення лантаноїдів з малим йонним радіусом більше дестабілізує структуру, а з великим йонним радіусом – виявляє протилежний ефект. Для оцінки геометричної стабільності подібних структур (до цього класу відноситься фаза ![]() ) застосовується критерій толерантності Гольдшміта t,
) застосовується критерій толерантності Гольдшміта t,
![]() , (4)
, (4)
де R – йонні радіуси, а SQRT – квадратний корінь.
Якщо температура менша 0.8ْС або більша 1.0ْС, то в структурі існує невідповідність довжин зв’язків між окремими шарами, яка викликає стабільність і нестабільність. Для тих лантаноїдів, йонний радіус яких менше радіуса йона- ![]() (
(![]() ), структура нестабільна, для більших (
), структура нестабільна, для більших (![]() та інші) структура повинна бути стабільною. В результаті температура перитектичного розпаду фази
та інші) структура повинна бути стабільною. В результаті температура перитектичного розпаду фази ![]() зростає на 80ْС, а
зростає на 80ْС, а ![]() -фази знижується приблизно на 100ْС відносно
-фази знижується приблизно на 100ْС відносно ![]() , незважаючи на те, що йонні радіуси неодиму Nd та ітербію Yb відрізняються лише на 5 – 10 %. Фаза
, незважаючи на те, що йонні радіуси неодиму Nd та ітербію Yb відрізняються лише на 5 – 10 %. Фаза ![]() вбирає лантаноїд, який введений в розплав, температура плавлення, отриманого надпровідникового твердого розплаву, стає суттєво відмінним від температури плавлення купрата барію. З іншого боку, при заданій температурі розплав переохолоджується тим більше, чим вища температура розпаду твердого розчину. Тому імовірність утворення зародків надпровідникової фази з такого нестабільного розчину помітно зростає.
вбирає лантаноїд, який введений в розплав, температура плавлення, отриманого надпровідникового твердого розплаву, стає суттєво відмінним від температури плавлення купрата барію. З іншого боку, при заданій температурі розплав переохолоджується тим більше, чим вища температура розпаду твердого розчину. Тому імовірність утворення зародків надпровідникової фази з такого нестабільного розчину помітно зростає.
Керамічний метод. Найпростіша технологія одержання високоякісних полікристалічних ВТНП сполук - це твердофазні реакції. Керамічний метод [37-43] складається з трьох етапів:
перемішування реагентів у відповідній катіонній стехіометрії та одержання гомогенного прекурсору;
одержання ВТНП сполуки шляхом термічної обробки прекурсору;
прожарювання для оптимізації ВТНП властивостей.
Реагентами для керамічного методу є порошки оксидів, карбонатів чи нітратів. Гомогенні полікристалічні ВТНП зразки можуть бути одержані завдяки ретельному перемішуванню та прожарюванню, що чергується з багаторазовим подрібненням та пресуванням.
Головним етапом синтезу ВТНП є відпалювання вихідних реагентів у відповідних умовах (температура, час та атмосфера), при яких відбувається реакція утворення фаз типу:
XMe’Or + YMe’’Ol + … + ZMe’’’On ® Me’xMe’’y…Me’’’zOm
де Me’, Me’’, Me’’’ = K, Ba, Ln, Y, Cu, Bi, Sr, Ca, Tl та інші керамікоутворюючі катіони.
Керамічний метод досить простий, універсальний, технологічний та практично не має обмежень: у принципі він може бути використаний для одержання найскладніших високотемпературних надпровідних композицій. Проте йому притаманні недоліки термодинамічного та кінетичного характеру, які є причиною низького відтворювання експлуатаційних властивостей ВТНП матеріалів. Перші пов’язані зі значними відмінностями термодинамічних властивостей індивідуальних оксидів та солей, другі – з утворення проміжних фаз, сегрегацією компонентів, та наявністю реакційної поверхні розділу.
Метод саморозповсюджуваного високотемпературного синтезу. За останній час інтенсивно розробляється метод саморозповсюджуваного високотемпературного синтезу (СВС) [43-45]. Розроблено методики одержання YBa2Cu3O7-x із суміші Cu, Y2O3 та BaO2, яку підпалюють, після чого відбувається її інтенсивний розігрів унаслідок окиснення міді. Швидкість окиснення та виділення теплоти корелюють із тепловідводом таким чином, щоб не відбувалося плавлення евтектик Cu–CuO2, BaCuO2–CuO при тиску 1 атм., так як останнє (наприклад, при 10 атм.) робить неможливим подальше самочинне протікання реакції утворення YBa2Cu3O7-x.
Методи гомогенізації. Більш перспективними є хімічні методи гомогенізації [42,43,46-56], в яких вихідні сольові компоненти розчинюють у воді чи іншому розчиннику, а потім цільовий продукт виділяють із розчину тим чи іншим методом. Це дозволяє уникнути деяких недоліків, що притаманні керамічній технології, наприклад, усуває необхідність перемішуючих чи подрібнюючих приладів.
Найбільш поширеним методом, який оснований на гомогенізації вихідних компонентів є золь-гель процес [42,43,47,49,50,52,53,56]. Сутність його полягає в тому, що розчини керамікоутворюючих катіонів переводять у золь чи гель, вилучають розчинник та піддають суху масу термообробці. Як вихідні речовини використовують нітрати, ацетати, форміати, алкоксиди, цитрати та інші. Основним недоліком цих методів є використання сполук, які містять вуглець, та малі концентрації вихідних розчинів, що зменшує продуктивність процесу та створює проблеми, пов’язані з утворенням термостабільних карбонатів лужноземельних елементів.
Здійснити перехід від золю в гель можна методом упарювання розчинника. Цей метод досить успішно використовують при синтезі ВТНП матеріалів. Так, для одержання купрату ітрію-барію [43] суміш гексагідратів нітратів ітрію та міді з карбонатом барію обробляють розчином NaOH та відмивають водою. До суміші додають еквівалентну кількість мурашиної кислоти. Одержану масу сушать при 85°С на повітрі та нагрівають в струмені кисню зі швидкістю 20 град/хв до 920°С з ізотермічною витримкою при цій температурі протягом години. Потім повільно охолоджують до кімнатної температури. За даними рентгенофазового аналізу одержаний матеріал є YBa2Cu3O7-x із домішкою невеликої кількості оксиду барію.
Іншим прикладом золь-гель методу служить синтез купрату ітрій-барію з використанням цитратів [43,51,55]. До змішаного розчину нітратів ітрію, барію та міді додавали лимонну кислоту (1г/екв С6Н6О7 на 1г/екв металів). Після цього розчин упарювали при 75°С до в’язкого стану та зневоднювали при 85°С протягом 4 – 5 годин. Цей метод модифікували введенням додаткових операцій нейтралізації в’язкого цитратного розчину водним розчином амоніаку та випарюванням одержаної суміші у вакуумі. В обох методиках термічний розклад продуктів синтезу здійснювали при 900°С (2 години) чи при 950°С (1 годину). В результаті були одержані практично однофазні продукти. Відзначимо, що густина кераміки після спікання при 950°С протягом 2 годин виявилась рівною 93% від теоретичної (6,36 г/см3).
В роботі [47] описаний золь-гель метод одержання бісмутових надпровідників (Bi1,68Pb0,32Sr1,75CaxCuyOz) через ацетати. Метод здійснювали за наступною схемою. Нітрат бісмуту розчиняли в оцтовій кислоті. Розраховану кількість нітрату стронцію, ацетатів кальцію та купруму розчиняли в амоніачній воді та змішували з розчином нітрату бісмуту. Плюмбум ацетат розчиняли у воді та додавали до попереднього розчину. Автори звертають увагу на необхідність підтримання рН розчину близько 5,5. Врегульовувати рН розчину необхідно за допомогою розчину амоніаку. Одержаний розчин перемішували при кімнатній температурі протягом 5 годин. Після цього, для підвищення густини розчину, його витримували при температурі 343 К. Одержаний гель охолоджували до кімнатної температури, а потім прожарювали 5 годин при 723 К та 15 годин при 1068 К. Порошок перетирали, пресували у пігулки та знов прожарювали протягом 90 годин при температурі 1123 К. Після цього пігулки перетирали, знов пресували та прожарювали 60 годин при 1123 К, а потім повільно охолоджували до 973 К та загартовували до кімнатної температури. Такий спосіб дозволяє одержати Ві-2223 надпровідну кераміку. Для одержання зразків Ві-2212 кераміки треба зменшити час та температуру прожарювання (до 1073 К).
Метод сумісного осадження [43,48,51,54,55] малорозчинних сполук можна розглядати як один із методів гомогенізації. Він базується на взаємодії розчину, який містить компоненти майбутнього керамічного матеріалу, із розчином осаджувача. Саме так Bednorz та Muller синтезували перший керамічний високотемпературний надпровідник [1]. Як вихідні солі для синтезу використовують нітрати чи хлориди, а як осаджувач – оксалатну кислоту чи калій оксалат, калій чи натрій гідроксиди, діамонійетилоксолат чи ді(триетіламоній)оксолат, амоній карбонат чи суміш амоніаку та амоній карбонату.
При застосуванні цього методу особливу увагу слід приділяти можливості неповного осадження одного з компонентів, що може призвести до порушення хімічного складу. Значна різниця величин добутків розчинності різких компонентів може призвести до одержання неоднорідних матеріалів із властивостями, які не відтворюються. Це пов’язано з тим, що в першу чергу з розчинів виділяються менш розчинні осади, а потім більш розчинні. Для запобігання цього явища, треба або підтримувати рН розчину на оптимальному рівні, або створюють умови, що зменшують загальну розчинність у системі [42]. Для цього осадження компонентів проводять спиртовим розчином оксалатної кислоти [43,50,56]. При цьому процеси спільного осадження та висолювання поєднують, і це призводить до більш повного виділення компонентів. Слід відмітити, що при недотриманні умов, продукти, які одержані методами сумісного осадження, можуть містити сторонні йони (наприклад, натрію чи калію), вилучити які не завжди вдається, що знижує якість синтезованого матеріалу.
Метод розпилювальної сушки [43] побудований на швидкому випаровуванні розчинника при його диспергуванні в потік газу-носія. Як вихідні солі використовують нітрати та ацетати, а як розчинники – воду, амоніачно-спиртові та водно-спиртові суміші.
Цей метод досить універсальний бо дозволяє одержати різноманітні композиції ВТНП. Крім того, при розпиленні розчину у високотемпературний газовий потік можна досягти часткового чи повного розкладання сольових компонентів. Однак продукти розпилювальної сушки є частинки у вигляді порожніх кульок, що свідчить про перерозподіл компонентів у процесі випаровування розчинника та про більші чи менші порушення в їх хімічній однорідності. Суттєвим недоліком цього методу є, по-перше, леткість деяких солей (наприклад, безводного купрум(ІІ) нітрату). В умовах високотемпературного потоку це призводить до одержання напівпродуктів, які відрізняються по катіонним складом від вихідної суміші. По-друге, значні масовитрати матеріалу.
Основою кріохімічного методу [43] є розпилення водних розчинів солей, катіони яких входять до складу ВТНП матеріалу, в холодоагент (частіше за все використовують рідкий азот), а потім виділення розчинника (льоду) із заморожених гранул методом сублімаційної сушки. Крім зазначених операцій, в синтезі використовують традиційні процеси одержання ВТНП матеріалів, які відбуваються при кімнатних, підвищених та високих температурах, в тому складі дегідратацію та термічний розклад сольових продуктів, приготування прес-порошків, спікання, ізостатичне чи гаряче пресування, додаткову термообробку в атмосфері кисню. Як вихідні солі для синтезу YВa2Cu3O7-x у більшості випадків використовують нітрати, ацетати, а також гелі, які одержують при змішуванні ітрій нітрату, купрум(ІІ) ацетату та барій гідроксиду. Перевага використання нітратів полягає в можливості приготування розчинів, які містять практично будь-які катіони з необхідним співвідношенням компонентів. Це робить кріохімічний метод синтезу таким ж універсальним, як і керамічний.
Кріохімічний синтез має і суттєві недоліки. По-перше, низька розчинність Ba(NO3)2, особливо в присутності значної кількості нітрат йонів у змішаному розчині, значно зменшує продуктивність методу. По-друге, при швидкому заморожуванні розчинів кристалізація нітратних солей відбувається лише частково і в кріогранулах зберігається значна кількість аморфних фаз, що може призвести до плавлення матеріалу на стадії сублімаційної сушки. Більшість нітратних розчинів мають низьку температуру плавлення евтектик (наприклад, для Y(NO3)3ЧН2О Тевт = - 30°С), що вимагає суворого дотримання режиму сублімаційної сушки, особливо на її початковій стадії.
Таким чином, зараз запропоновано та експериментально розроблено велика кількість різноманітних методів синтезу ВТНП матеріалів. Кожний з них має як певні переваги так і недоліки, але в кожному способі синтезу необхідно оптимізувати умови виготовлення кінцевих матеріалів із заданою сукупністю експлуатаційних характеристик. Крім того, можна стверджувати, що в залежності від конкретних виробів із ВТНП та галузей їх застосування, оптимальними можуть виявитися зовсім різні методи їх одержання.
Розділ 2. Методика рентгенофазного аналізу
0 комментариев