Навигация
В каждый такой массив попадают микросостояния одного уровня
17. В каждый такой массив попадают микросостояния одного уровня.
Общий уровень называется терм. Каждая терм характеризуется двумя суммарными квантовыми числами L и S. Кратность вырождения терма определяется числом принадлежащих ему микросостояний и равна произведению (2L+1)´(2S+1).
Это L-S-термы или термы Рассел-Саундерса.
Номенклатура термов в первую очередь учитывает эти два признака:
во-первых, величину орбитального момента импульса.
во-вторых, величину спинового момента импульса.
По величине суммарного L термы называются:
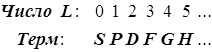
По величине суммарного спина S вводится мультиплетность, равная 2S+1, и термы
получают дополнительное наименование – символ мультиплетности:
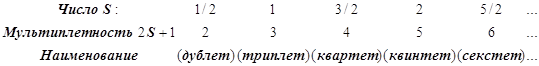
Результирующий символ атомного терма Рассел-Саундерса имеет вид ![]()
Резюме:
По этим признакам конфигурация ![]() порождает 15 микросостояний электронной оболочки, и они группируются в три терма:
порождает 15 микросостояний электронной оболочки, и они группируются в три терма:
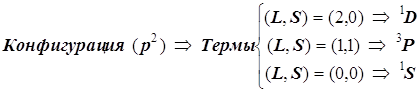
18. Следующая поправка к энергии оболочки атома имеет релятивистское происхождение и непосредственно не связана с кулоновским эффектами. Она называется спин-орбитальным эффектом. Название «спин-орбитальное взаимодействие» устоявшееся, но физически не вполне точное. Это просто привычный термин... .
Спин-орбитальный эффект приводит к тому, что термы Рассел-Саундерса расщепляются на несколько подуровней, каждый из которых характеризуется внутренним квантовым числом, принимающим значения ![]() . Внутреннее квантовое число J определяет модуль суммарного момента импульса электронной оболочки, а, соответственно, суммарного магнитного момента атома.
. Внутреннее квантовое число J определяет модуль суммарного момента импульса электронной оболочки, а, соответственно, суммарного магнитного момента атома.
Спин-орбитальный эффект возникает в том случае, когда оба из независимых моментов импульса электронной оболочки атома, орбитальный и спиновый не равны нулю. Если же хотя бы один из них равен нулю, то спин-орбитальный эффект не имеет места.
19. Низший из атомных термов на шкале энергии (основной терм) определяется комбинацией трёх правил Хунда. Они следующие:
1-е правило Хунда: В пределах орбитальной конфигурации основной терм обладает
максимальной мультиплетностью.
2-е правило Хунда: Если в пределах орбитальной конфигурации у нескольких термов мультиплетность одинакова, то у основного терма орбитальный момент наибольший и квантовое число L максимальное.
3-е правило Хунда: Если в пределах орбитальной конфигурации орбитальный подуровень заполнен менее, чем наполовину, среди термов, возникающих в результате спин-орбитального расщепления, низшему отвечает минимальное внутреннее квантовое число J (нормальный терм), а при заполнении орбитального подуровня более, чем наполовину, низший терм характеризуется максимальным внутренним квантовым числом J (обращённый терм).
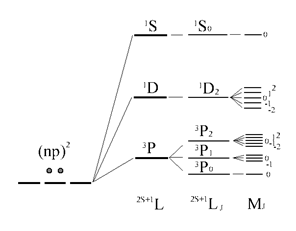
Уточняя символы атомного терма Рассел-Саундерса за счёт включения спин-орбитального эффекта, записывают их в виде ![]() . Эти термы отражают схему последовательных приближений в учёте различных слагаемых полной энергии коллектива электронов в атомной оболочке в отсутствие внешних силовых полей.
. Эти термы отражают схему последовательных приближений в учёте различных слагаемых полной энергии коллектива электронов в атомной оболочке в отсутствие внешних силовых полей.
В итоге термы, возникающие в основной конфигурации атома углерода, представлены следующим образом:
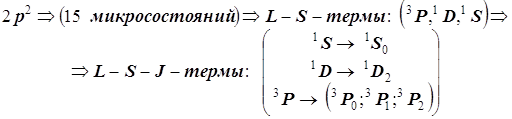
Во внешнем магнитном поле наблюдается дополнительное расщепление атомных уровней по атомному квантовому числу J. С учётом этого расщепления нумерация уровней осуществляется с помощью квантового числа MJ.
В завершение этого раздела приведём последовательность атомных уровней на каждой стадии последовательного уточнения картины взаимодействий...
Последовательность учёта электронных взаимодействий и энергетическая диаграмма атомных уровней (термов) для основной конфигурации np2 атома C (или Si,...)
|
Существует очень простой приём определения основного терма атомной оболочки (мнемоническое правило Грегори).
Для этого в пределах высшего незавершённого подуровня распределяют электроны с максимально возможным спиновым распариванием. При этом по АО они распределяются таким способом, чтобы достигалось максимальное значение суммарного орбитального момента. В результате получаем микросостояние с экстремальными проекциями M Lmax и MSmax , значения которых совпадают с соответствующими числами L, S основного терма. ПРИМЕР 1(атом C(p2)). M Lmax=1+0; ®Lmax=2; ® D; MSmax=1/2+1/2; ® Smax=1; ®® 2Smax+1=3 (триплет) ; Терм 3D или точнее C (2p2) 3D
ПРИМЕР 2(атом Ti(d2)). M Lmax=2+1; ®Lmax=3; ® F; MSmax=1/2+1/2; ® Smax=1; ®
® 2Smax+1=3 (триплет) ; Терм 3F или точнее Ti (3d2) 3F
ПРИМЕР 3(атом Fe(d6)). M Lmax=2; ®Lmax=2; ® D; MSmax=5/2-1/2=2; ® Smax=2; ®
® 2Smax+1=5 (квинтет) ; Терм 5D или точнее Fe (3d6) 5D
ПРИМЕР 4(атом N(p3)) . M Lmax=0; ®Lmax=0; ® S; MSmax=3/2; ® Smax=3/2; ®
® 2Smax+1=4 (квартет) ; Терм 4S или точнее N (2p3) 4S
Похожие работы
... оболочки атома, которые обозначим с помощью волновых функций , характеризуются постоянстовом этих величин. 10.1 Из-за неразрешимой сложности задачи невозможно получить весь спектр состояний-уровней многоэлектронного атома дедуктивным математическим способом подобно тому, как это делается в простых задачах квантовой механики в том числе и для водородоподобного атома. Количественный расчёт даже ...
... надо иметь в виду возможность структурных особенностей времени для каждого такого вида. II Силы взаимодействия и строение кристаллов2.1.Природа сил связи в кристаллах. Различные типы кристаллов и возможное расположение узлов (точка, относительно которой атом (молекула) совершает колебания) в пространственной решётке ...
0 комментариев