Навигация
Sr [24]. Так, LaNiO3 показывает высокую каталитическую активность, а La2NiO4 ─ совершенно неактивен. Среди стронций-замещенных катализаторов La0,9Sr0,1NiO3 и La1,8Sr0,2NiO4 имеют максимальную активность.
Начальная активность катализаторов этого типа растет со временем по мере их работы, достигая стационарного состояния. Рентгенофазовый анализ отработанных катализаторов показывает, что в условиях реакции катализаторы превращаются в смесь фаз La2O2CO3 и SrCO3 с высокодисперсным Ni. Такое превращение может быть вызвано удалением решеточного кислорода при замещении, ускоряемом в восстановительной атмосфере при CH4/CO2 = 1. Предположительно, высокая активность обусловлена двумя центрами: La2O3 служит для адсорбции CO2, Ni ─ для активации CH4.
Перовскитные катализаторы Ni/Ca0,8Sr0,2TiO3 и Ni/BaTiO3, приготовленные методом твердофазной кристаллизации, были испытаны в сухом риформинге метана. В условиях катализа образуется металлический Ni, который равномерно распределяется в решетке перовскитной матрицы. Отмечено, что внедрение Ni в решетку BaTiO3 происходит легче, чем в решетку Ca0,8Sr0,2TiO3. Высокая дисперсность никеля приводит к высокой активности и коксоустойчивости катализатора, причем снижение углеобразования частично обязано присутствию щелочноземельных металлов. Подвижный кислород в решетке перовскита также способствует удалению углерода.
Изучено влияние добавок Mo и W на каталитические свойства системы Ni/Al2O3 [24]. Никелевый катализатор, легированный малыми добавками Мо, дезактивируется, хотя при низких степенях легирования углерода на поверхности катализатора не наблюдалось. Напротив, катализатор, легированный W, не дезактивируется, углерода на поверхности значительно меньше, чем на непромотированном катализаторе. Ингибирование углеотложения объясняется образованием карбидов Мо и
W, активных в сухой конверсии метана. По-видимому, карбидные центры формируются вблизи никелевых центров в Ni/Al2O3, промотированном Mo/W. Эти центры обеспечивают диссоциацию СО2 и увеличивают на каталитической поверхности количество кислорода в атомарном состоянии, доступное для реакции с поверхностным углеродом.
4.5 Технология конверсии метанаСпособ паровой конверсии в трубчатых печах применяется для получения синтез-газа, используемого для производства водорода, аммиака и метанола. Для синтеза метанола паровая конверсия обладает существенным недостатком ─ получают газ с избыточным содержанием водорода, а переработка таких газов приводит к увеличению затрат на сжатие. Кроме того, избыточный водород ─ балласт в процессе синтеза, и его приходится отводить с продувочными газами. Но, несмотря на это, процесс паровой конверсии все еще считается наиболее экономически эффективным вариантом для крупнотоннажных (750 тыс. т/год) установок производства метанола, имеющих одну технологическую линию и рассчитанных на использование в качестве сырья газа по низкой или умеренной цене.
В России наиболее широко распространен процесс паровой конверсии метана. Процесс идет в несколько стадий: подготовка сырья, конверсии, утилизации тепла, очистки газов от CO2. Сырье очищают по необходимости.
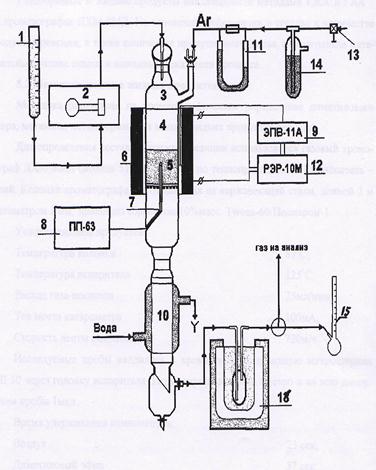
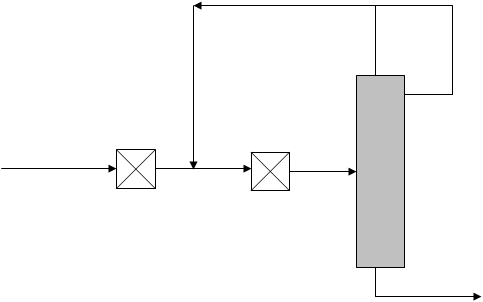
Исходный метан сжимают турбокомпрессором 1 до 2 ─ 3 МПа (см. рис. 15) и смешивают с необходимым количеством водяного пара и CO2. Смесь подогревают в теплообменнике 2 до 400 оС частично охлажденным конвертированным газом и подают в смеситель конвертора 6, куда поступает предварительно приготовленная смесь O2 с равным объемом водяного пара. Конвертор охлаждается кипящим в рубашке конденсатом; при этом генерируется пар с давлением 2 ─ 3 МПа, который отделяют в паросборнике 5. Тепло горячего конвертированного газа, выходящего из конвертора при 800 ─ 900 oC, используют в котле-утилизаторе для получения пара высокого давления, направляемого затем в линию пара соответствующего давления или используемого для привода турбокомпрессора. Тепло частично охлажденного газа утилизируют для предварительного подогревания смеси в теплообменнике 2 и в теплообменнике 3 для нагревания водного конденсата, питающего котел-утилизатор. Окончательное охлаждение осуществляют в скруббере 7 водой, циркулирующей через холодильник 8. При этом на выходе газ содержит смесь газов следующего состава:
CO ─ 15 – 45% (об.)
H2 ─ 40-75% (об.)
CO2 ─ 8-15% (об.)
CH4 ─ 0,5% (об.)
N2 и Ar ─ 0,5-1% (об.)
Очищают от CO2 через абсорбцию под давлением, хемосорбцию водным раствором моноэтаноламина или карбоната калия.
Наверх газ поступает в абсорбер 9, где поглощается CO2, а очищенный газ направляется к потребителю. Насыщенный абсорбент подогревается в теплообменнике 10 горячим регенерированным раствором и направляется в десорбер 11, с низа которого абсорбент направляется через т/о 10 вновь на поглощение CO2 в абсорбер 9. CO2 с верха 11 компримируют до соответствующего давления и возвращают на конверсию, смешивая перед т/о 2 с природным газом и водяным паром.
Расход на 1 м3 синтез-газа составляет:
Природный газ ─ 0,35 – 0,40 м3,
Технический O2 ─ 0,2 м3,
и в зависимости от применяемого
давления и добавки CO2 ≈ 0,2 - 0,8 кг водяного пара.

Рис. 15. Технологическая схема окислительной конверсии природного газа при высоком давлении
1 – турбокомпрессор; 2, 3, 10 – теплообменники; 4 – котел-утилизатор; 5 – паросборники; 6 – конвертор; 7 скруббер; 8 – холодильник; 9 – абсорбер; 11 – десорбер; 12 – дроссельный вентиль; 13 – кипятильник.
За рубежом развитие процессов паровой и углекислотной конверсии метана направлено несколько в другую сторону. На рис. 16 показаны принципиальные технологические схемы конверсии метана с паром для получения водорода и комбинированного парового/углекислотного риформинга для производства синтез-газа.
Установка риформинга обычно включает от 40 до 400 трубок (длина 6 ─ 12 м, диаметр 70 ─ 160 мм, толщина стенок 10 ─ 20 м), которые установлены вертикально в прямоугольной печи. Трубки заполняются катализатором, обычно формованным в виде небольших цилиндров или колец Рашига. Реактор обогревается горелками, которые могут размещаться внизу, сбоку или сверху печи. Топливо сжигается в радиационной секции печи. Отходящие дымовые газы (после обогрева реактора). Проходят через конвекционную секцию, где охлаждаются за счет отдачи тепла жидкостным и паровым потокам, включая пар, необходимый для реакции, исходный водяной поток и потоки для производства пара.
Дальнейший технологический маршрут синтез-газа зависит от выбранного процесса его вторичной переработки (получение H2, CO, оксосинтез, синтез аммиака и т.д.). Для получения водорода газ направляют в реактор конверсии водяного газа и поглотительный реактор переменного давления (см. рис.16а). Если требуется получить CO, то используется технологическая схема, включающая секцию удаления CO2 и установку низкотемпературного разделения (т.н. «холодный ящик»). Выделяемый диоксид углерода повторно используется в процесс риформинга. Если в этом случае желательно также получить H2 в качестве продукта, то установку снабжают блоком PSA (Pressure-Swing-Adsorption) (см. рис. 16).
В таблице 6 представлены некоторые характеристик процессов конверсии метана.
Таблица 6
Сравнительные технико-экономические показатели процессов получения синтез-газа.
| Показатели | Паровая конверсия углеводородного газа | Двухступенчатая конверсия в системе конвертеров "Тандем" | Паро-углекислотная конверсия природного газа |
| Сырье, требования к сырью | Природный газ, легкая часть попутного нефтяного газа | Природный газ, легкая часть попутного нефтяного газа Кислород - 138 н.м3/1000 н. м3 | Природный газ, легкая часть попутного нефтяного газа CO2 из отделений синтеза |
| Получаемые продукты | Синтез-газ, % (об.) CO2 - 7,59 CO - 14,28 H2 - 73,02 CH4 - 4,67 N2 - 0,51 Калорийность 2688 ккал/н.м3 Пар высокого давления - 1,31 т/1000 н.м3 синтез-газа | Синтез-газ, % (об.) CO2 - 7,49 CO - 22,03 H2 - 67,42 CH4 - 2,17 N2 - 0,89 Калорийность 2578 ккал/н.м3 Пар высокого давления - 0,5 т/1000 н.м3 синтез-газа | Синтез-газ, % (об.) CO2 - 0,04 CO - 31,27 H2 - 36 CH4 - 2,28 |
| Расходные показатели (на 1000 н.м3 синтез-газа) | Природный газ: на технологию - 261 н.м3 на топливо - 47 н.м3 всего - 308 н.м3 Катализаторы - 0,209 кг | Природный газ: на технологию - 312 н.м3 на топливо - 54 н.м3 всего - 366 н.м3 Катализаторы - 0,195 кг | Природный газ: на технологию - 261 н.м3 на топливо - 82 н.м3 всего - 343 н.м3 Катализаторы - 0,2 кг |
| Влияние на окружающую среду (на 1000 н.м3 синтез-газа) | Дымовые газы огневого подогревателя - 113 н.м3 NOx + SO2 = 0,006 кг Дымовые газа после трубчатой печи - 2580 н.м3 NOx + SO2 = 0,085 кг Отработанные катализаторы | Дымовые газы вспомогательного котла – 36 н.м3 Отработанные катализаторы | Дымовые газы - 2290 н.м3 Отработанные катализаторы |
Таблица 6 (окончание)
Технико-экономические показатели.
| Показатели | Паровая конверсия углеводородного газа | Двухступенчатая конверсия в системе конвертеров "Тандем" | Паро-углекислотная конверсия природного газа |
| Выход CO на исходный углерод, % | 53 - 55 | 69 - 70 | 93 |
| Соотношение H2:CO,моль/моль | 5:1 | (3,0 - 3,2):1 | (2,1 - 2,3):1 |
| Удельные кап. вложения, долл. /1000 н.м3 газа в год | 73,4 | 78,2 | 99,9 |
| Расход природного газа на 1000 н.м3 синтез-газа | 308 | 366 | 343 |
| Давление получаемого синтез-газа, МПа | 1,2 - 1,6 | 2,8 - 3,0 | 1,2 - 1,5 |
5. Синтез Фишера-Тропша
Метод Фишера – Тропша по превращению метана в более тяжелые углеводороды был разработан в 1923 г. и реализован в промышленности Германии в 1940-х годах.
Почти все авиационное топливо в этой стране во время второй мировой войны производилось с помощью синтеза Фишера – Тропша из каменного угля. Впоследствии от этого способа изготовления моторных топлив отказались, так как топливо, получаемое при переработке нефти, до последнего времени было экономически более выгодным.
При получении жидкого топлива на основе синтеза Фишера - Тропша разнообразные соединения углерода (природный газ, каменный и бурый уголь, тяжелые фракции нефти, отходы деревообработки) конвертируют в синтез-газ (смесь СО и Н2), а затем он превращается в синтетическую «сырую нефть» - синтнефть. Это – смесь углеводородов, которая при последующей переработке разделяется на различные виды практически экологически чистого топлива, свободного от примесей соединений серы и азота. Достаточно добавить 10% искусственного топлива в обычное дизельное, чтобы продукты сгорания дизтоплива стали соответствовать экологическим нормам. [28]
Еще более эффективной представляется конверсия газа в дорогостоящие продукты тонкого органического синтеза.
Конверсию газа в моторное топливо можно в целом представить как превращение метана в более тяжелые углеводороды:
2nСН4 + 1/2nО2 = СnН2n + nН2О
Из материального баланса брутто-реакции следует, что массовый выход конечного продукта не может превышать 89%.
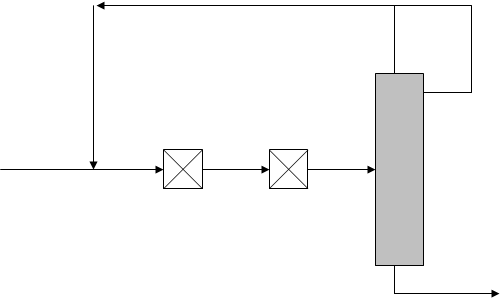
Реакция напрямую неосуществима. Конверсия газа в жидкое топливо (КГЖ) проходит через ряд технологических стадий (рис.17). При этом в зависимости от того, какой конечный продукт необходимо получить, выбирается тот или иной вариант процесса.
Синтез Фишера-Тропша может рассматриваться как реакция восстановительной олигомеризации монооксида углерода, при которой образуются углерод-углеродные связи, и в общем виде она представляет собой сложную комбинацию ряда гетерогенных реакций, которую можно представить суммарными уравнениями:
nCO + 2nH2 → (CH2)n + nH2O,
2nCO + nH2 → (CH2)n + nCO2 .

Рис. 17. Принципиальная схема конверсии синтез-газа в жидкие продукты (топливо).
Продуктами реакции являются алканы, алкены и кислородсодержащие соединения, то есть образуется сложная смесь продуктов, характерная для реакции полимеризации. Первичными продуктами синтеза Фишера-Тропша являются a- и b-олефины, которые превращаются в алканы в результате последующего гидрирования. Природа применяемого катализатора, температура, соотношение СО и Н2 существенно сказываются на распределении продуктов. Так, при использовании железных катализаторов велика доля олефинов, тогда как в случае кобальтовых катализаторов, обладающих гидрирующей активностью, преимущественно образуются насыщенные углеводороды. [2]
В настоящее время в качестве катализаторов синтеза Фишера-Тропша в зависимости от поставленных задач (повышение выхода бензиновой фракции, увеличение выхода низших олефинов и др.) используются как высокодисперсные железные катализаторы, нанесенные на оксиды алюминия, кремния и магния, так и биметаллические катализаторы: железо-марганцевые, железо-молибденовые и др. [34]
За 70 лет с момента открытия синтеза не утихают споры по поводу механизма реакции. В настоящее время рассматриваются три различных механизма. Первый механизм, называемый карбидным, впервые предложенный Фишером и Тропшем и в дальнейшем нашедший поддержку у других исследователей, предполагает образование С-С-связей в результате олигомеризации метиленовых фрагментов на поверхности катализатора. На первой стадии происходит адсорбция СО и образуется поверхностный карбид, а кислород превращается в воду или СО2:
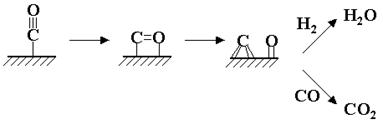
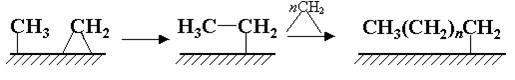
На второй стадии поверхностный карбид гидрируется с образованием фрагментов СНx (х = 1-3):

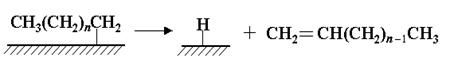
Удлинение цепи происходит в результате реакции поверхностных метила и метилена и далее путем внедрения метиленовых групп идет рост цепи:
Стадия обрыва цепи происходит в результате десорбции алкена с поверхности катализатора:
Второй механизм, названный гидроксикарбеновым, предполагает также гидрирование координированного на металле СО с образованием поверхностных гидроксикарбеновых фрагментов, в результате конденсации которых и происходит образование С-С-связей:
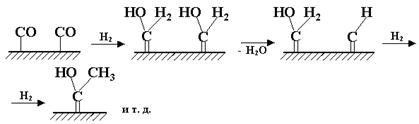
Третий механизм, который можно назвать механизмом внедрения, предполагает образование С-С-связей в результате внедрения СО по связи металл-углерод (о способности СО к внедрению по связи металл-алкил говорилось выше):

Накоплен достаточно богатый экспериментальный материал, свидетельствующий в пользу того или иного варианта механизма, однако приходится констатировать, что к настоящему моменту невозможно сделать однозначный выбор между ними. Можно предположить, что в связи с большой важностью синтеза Фишера-Тропша исследования в этом направлении будут интенсивно продолжаться и мы станем свидетелями новых воззрений на механизмы протекающих реакций [3].
Похожие работы
... эту высокую стоимость. К тому же метанол сильно ядовит. Что касается дизельных двигателей, то в них можно использовать продукт разложения метанола – ДМЭ. 4. Получение диметилового эфира дегидратацией метанола Дегидратация метанола с получением диметилового эфира-исторически первый путь проведения данного синтеза. Этому процессу ещё с 1960-х годов было посвящено множество работ советских и ...
... затрат в рециркуляционных реакционно-ректификационных процессах с различной организацией подачи рецикла для реакции изомеризации типа АВ. Глава 2. Расчетно-аналитическая часть 2.1. Анализ стационарных состояний рециркуляционного реакционно-ректификационного процесса. В рециркуляционных схемах существуют различные варианты подачи рецикла. В данном случае рассматривается схема, ...
... процесс разделения нестабильных веществ можно проводить в холодильной камере. Выделенное соединение подвергают структурному химическому исследованию, а затем изучают его фармакологическое действие. Получение лекарственных веществ методом культуры тканей высших растений В нашей стране заготавливаются десятки тысяч тонн ЛРС. Однако потребность в БАВ, содержащихся в растениях, с каждым годом ...
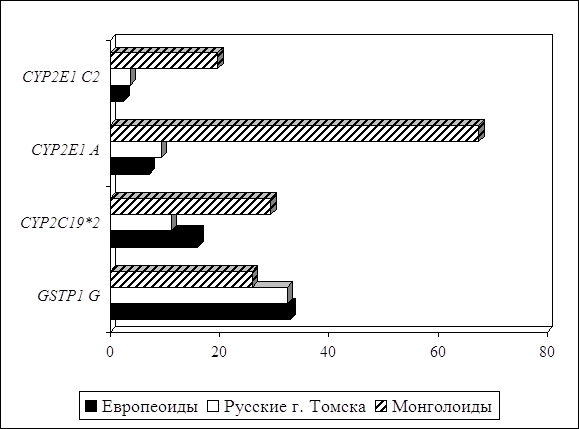
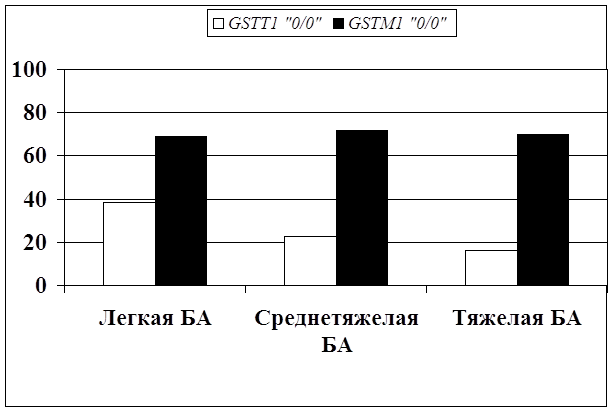
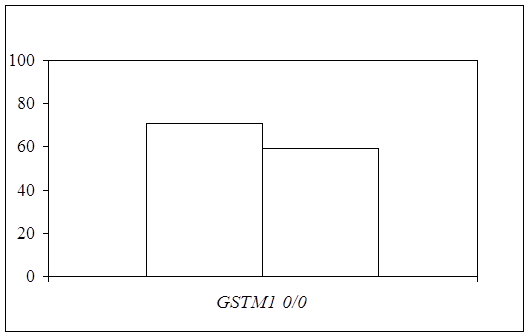
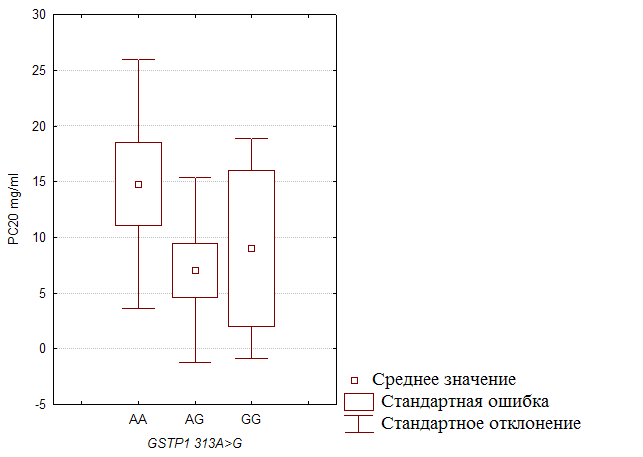
... препаратов. Установлена связь полиморфизма 313A>G гена GSTP1 с изменчивостью уровня аланинаминотрансферазы (р=0,021). 7. Выявлены различия в структуре генетической подверженности к бронхиальной астме и туберкулезу по генам ферментативной системы метаболизма ксенобиотиков: гены GSTM1, CYP2E1 и CYP2C19 связаны с бронхиальной астмой и значимыми для заболевания качественными и ...
0 комментариев