Навигация
Сущность и химическая структура стероидов
![]()
![]()
![]() 1. Общая структура (строение) и синтез стероидов
1. Общая структура (строение) и синтез стероидов
Стероиды имеют исключительно широкий диапазон биологического действия, включающий в себя деление клеток, восстановление органов и тканей, обмен веществ углеводный, жировой, защитные реакции организма – иммунная функция, рост мышечных тканей, химические процессы в мембранах нервных клеток.
Стероиды можно разделить, по тому где они синтезируются, на три основные группы: гонадотропные, глюкокортикостероиды и минералкортикоиды. Если с гонадотропными понятно по их названию, то, глюкокортикостероиды (например кортизол) и минералкортикоиды (например альдостерон) синтезируются в коре надпочечников.
Стероиды также можно разделить на группы по их функциям.: андрогены, эстрогены, прогестогены, анаболические стероиды и катаболики. Основные, которые мы здесь рассмотрим – это андрогены и анаболические стероиды. Андрогены семенников синтезируются клетками Лейдига в интерстициальной ткани: в этих клетках содержится практически вся 3бетагидроксистероид-дегидрогеназа семенников - фермент, катализирующий ключевой этап биосинтеза тестостерона, который имеет как анаболические, так и андрогенные свойства.
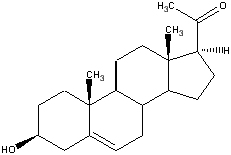
Стероиды являются жирорастворимыми гормонами, имеющие тетрациклическую основу строения. Основа структуры состоит из четырех соединенных вместе колец: три циклогесановые и одно циклопентановое. См. ниже.
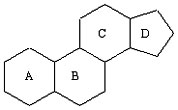
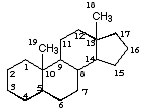
Как видно из рисунка, кольца А и D способны к видоизменениям, благодаря их краевому расположению. На следующем рисунке показана расстановка углерода в стероидах, позиции 10 и 13 наиболее подвержены различным изменениям.
Процесс синтеза стероидов начинается со сквалена - сложной линейной ароматической молекулы, структура показана ниже
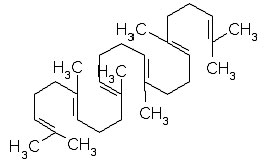
Сквален (от лат. squalus - акула), ациклический полиненасыщенный жидкий углеводород состава C30H50 с t кипения 242С, растворимый во многих органических растворителях. Важный промежуточный продукт в метаболизме тритерпеноидов и стероидов; широко распространён в тканях животных и растений, а также у микроорганизмов; впервые выделен из печени акулы. Биосинтезируется из мевалоновой кислоты, превращающейся в фарнезилпирофосфат; последний под действием скваленсинтетазы (в присутствии тиамина) "димеризуется" в сквален. Ферментативное превращение сквалена в ланостерин и из него в холестерин и др. стерины начинается с аэробного окисления концевой двойной связи сквалена.
Этот процесс циклизации сквалена, как полагают, является одним из большинства удивительных и сложных реакций в органической химии.
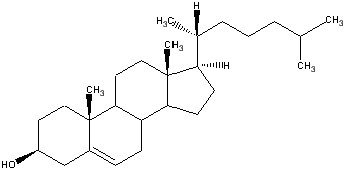
Холестерол
Холестерол служит напосредственным предшественником половых стероидов, подобно тому, как он служит предшественником кортикостероидов надпочечников. Скорость-лимитирующим этапом, как и в надпочечниках, является отщепление боковой цепи холестерола. Превращение холестерола в прегненолон (гормон, выделяемый в матке, контролирующей имплантацию яйца, и - предшественник для андрогенов, эстрогенов, и глюкокортикоидов) в надпочечниках, яичниках и семенниках происходит идентично. Однако в двух последних тканях реакция стимулируется не АКТГ, а ЛГ.
Прегненолон
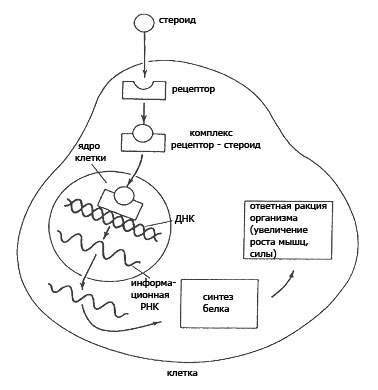
Все функции стероидов схожи на клеточном и молекулярном уровне. Поскольку стероиды жирорастворимы, они легко могут проникать (диффундировать) через мембану клетки в цитоплазму, где путем присоединения к рецептору (белковаой структуре) формируют всем известный комплекс рецептор-стерод. Далее в процессе димеризации (образование димера - удвоенной молекулы в результате реакции присоединения) два комплекса формируют димер, который в свою очередь присоединяется к ДНК клетки, способствуя тем самым транскрипции гена и белковому синтезу.
Этот процесс представлен в диаграмме ниже. Влияние стероидов на ген и синтез белка весьма сложное и труднообъяснимое. Часто белок, синтезируемый в результате присоединения димера к ДНК является регулирующим и отвечающим за активирование или подавление других генов. Это вызывает своего рода цепную реакцию. Помимо этого, влияние стероида на ген зависит от типа клетки, в которой идет присоединение. Поэтому фактические примеры этих процессов не будут представлены в статье.
Структура и превращение некоторых стероидов
Первый стероид, который мы рассмотрим – это тестостерон, имеет наиболее простую структуру строения.
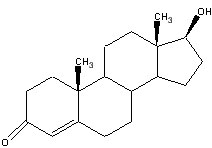
Тестостерон
Метаболические превращения тестостерона осуществляются двумя путями. Один путь включает в себя окисление в 17-м положении, другой - восстановление двойной связи кольца А и 3-кетогруппы.
В результате первого пути, функционирующего во многих тканях, в том числе и в печени, образуются 17-кетостероиды, как правило, лишенные активности или обладающие более слабой активностью, чем исходное соединение.
Второй путь, менее эффективный, протекает главным образом в тканях-мишенях и ведет к образованию активного метаболита - дигидротестостерона ( ДГТ )а также эстрадиола и андростандиола. Этиохоланолон и андростерон - это 5 бета-восстановленные продукты андрогенов.
Таким образом, тестостерон можно рассматривать как прогормон по двум причинам: во-первых, он превращается в более активное соединение дигидротестостерон и, во-вторых, превращение это происходит главным образом в тканях, расположенных вне семенников. Небольшая часть тестостерона ароматизируется, образуя эстрадиол.
Свободный тестостерон и тестостерон, связанный с сывороточным альбумином, легко проникают в клетки-мишени. Внутри клеток тестостерон может превращаться в дигидротестостерон и эстрадиол. Основное количество дигидротестостерона (около 300 мкг/сут) образуется в предстательной железе. Физиологическая активность тестостерона и дигидротестостерона различна. Эстрадиол синтезируется из тестостерона с участием ароматазы. У взрослого мужчины за сутки образуется около 40 мкг эстрадиола, из них 10 мкг - в яичках и 30 мкг - вне яичек.
Андростандиол, еще один высоко активный андроген, также образуется из тестостерона.
Главные 17-кетостероидные метаболиты тестостерона - андростерон и этихоланолон - коньюгируют в печени с глюкуронидом и сульфатом с образованием водорастворимых экскретируемых соединений. Количественное определение 17-кетостероидов в моче использовалось ранее в качестве теста на андрогенную активность. Теперь, однако, установлено, что этот показатель слабо отражает гормональный статус in vivo.
Сложные эфиры тестостерона
Сложные эфиры тестостерона образуются путем присоединения боковых цепей атомов, состоящих из углерода (С), водорода (Н) и кислорода (О) к самой молекуле тестостерона, формируя таким образом, тестостерон ципионат, тестостерон энантат, тестостерон пропионат. Сложные эфиры гораздо медленнее высвобождаются в русло крови, т.к. они снижают возможность стероида растворяться в воде, и наоборот увеличивают его жирорастворимость. Присоединяясь к стероду, сложный эфир делает его неактивным, и таким образом, препятствует его связыванию с рецептором. Чтобы произошла его активация, фермент эстераза (фермент класса гидролаз; катализирует реакции расщепления эфирной связи) отщепляет сложный эфир и восстанавливает водород для формирования гидроксильной группы, присоединенной к С17. Как только молекула вновь конвертирована в тестостерон, она способна соединиться с рецептором. Обычно сложные эфиры присоединяются к С17, хотя могут быть связаны и с С3 в молекуле тестостерона.
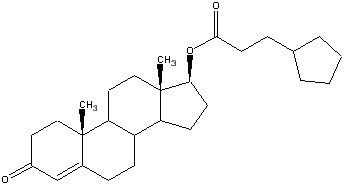
Тестостерон ципионат
В молекуле тестостерона ципионата, вместо водорода в гидроксильной группе С17, к молекуле тестостерона присоеденена боковая цепь, состоящая из 8 атомов углерода, кольца циклопентана и одной карбоновой группы (=О). Тестостерон ципионат входит в группу наиболее сложных эфиров. Если сравнивать сложные эфиры по их молекулярной массе, то можно поставить их в таком порядке, начиная с наименьшей: ацетат, пропионат, фенилпропионат, изокапроат, капроат, энантат, ципионат, деканоат, ундесиленат, ундеканоат, лаурат. Наибольшей молекулярной массой обладает лаурат, который состоит из 12 атомов углерода, 24 атомов водорода и 2 атомов кислорода. Сложные эфиры могут присоединяться и к другим стероидам, не ограничиваясь только тестостероном.
Превращение тестостерона в дигидротестостерон происходит как в яичках, так и вне яичек с участием 5альфа-редуктазы. В течение этого процесса двойная связь между С5 и С4 уменьшается до одинарной(простой) связи, при этом к С4 и С5 присоединяются по одному атому водорода
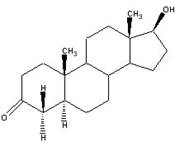
ДГТ
Не все стероиды конвертируются в ДГТ с помощью 5альфа-редуктазы. Благодаря специцифичности ферментов, которую можно описать по аналогии ключ-замок, каждый фермент подходит только определенному субстрату.
Следующий стероид, который мы рассмотрим - Нандролон Деканоат
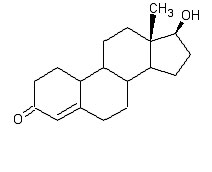
Как вы видите нандролон отличается от тестостерона только в одном: на месте метиловой группы (СН3) в позиции С10 стоит водород (не показан на рисунке). Благодаря своей схожести с тестостероном, нандролон также конвертируется с помощью 5альфа-редуктазы, конечный продукт этой реакции – дигидронандролон, молекула которого в свою очередь схожа с ДГТ.
Некоторые стероиды способны также к ароматизации, это процесс преобразования андрогена в эстроген с помощью фермета ароматазы. Тестостерон конвертируется в эстрадиол, который показан ниже.Если сравнить молекулу эстрадиола с молекулой тестостерона, то можно увидеть, что метиловая группа в позиции С10 отсутствует, а кислород в позиции С3 превратился в гидроксильную группу. Ароматизация привела к потере числа углерода и к образованию двойных связей в цепи, чтобы процесс ароматизации произошел, молекуле стероида необходимо иметь метиловую группу в позиции С10, еще один принцип ключ-замок. По этой причине Нандролон не конвертируется в эстроген, т.к не имеет метиловой группы.
Еще одна причина, по которой стерод не может ароматизироваться в эстроген – это само строение молекулы, когда строение видоизменено, ароматаза не может функционировать.
Пример такого измененного кольца молекулы это Оксандролон, где в позиции С2 стоит кислород вместо углерода. Обратите внимание, что метиловая группа в позиции С10 присутствует, но ароматизация все равно не возможна.
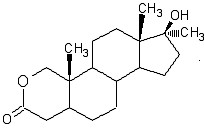
Оксандролон
Ярким примером изменения в структуре молекулы, является Станазолол, где к четырем основным кольцам присоединено пятое кольцо, которое и предотвращает этот стероид от ароматизации.
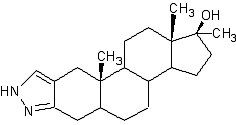
Станазолол
Еще одно превращение, которому подвергаются некоторые стероиды – это 17 альфа-алькилирование, в этом процессе к позиции С17 присоединяется метиловая группа (СН3). Эти стероиды, проходя печень, практически не подвергаются изменениям и имеют более длинный период полураспада, чем их неалькилированные собратья. Примером 17 альфа-алькилирования является представленный выше оксандролон, обратите внимание на СН3 в позиции С17. Большинство оральных стероидов 17 альфа-алькилированы, поэтому более токсичны для печени, чем инъекционные стероиды.
В таблице вы найдете больше примеров стероидов и возможных превращений.
Эстрогенная активность: эстрогенно не активен
Прогестагенная активность: нет данных (возможно низкая)
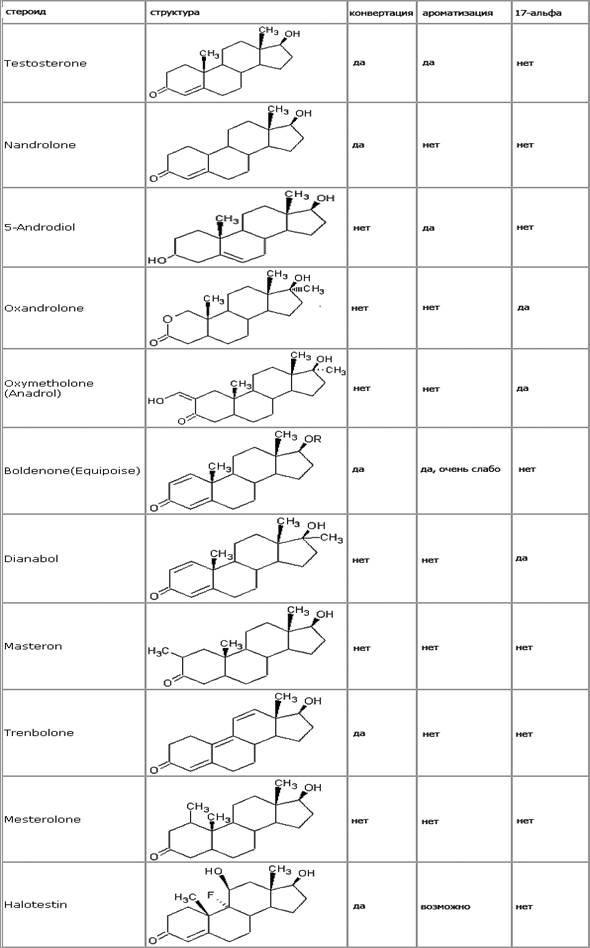
Мастерон- иньекционный препарат, содержащий действующее вещество дростанолон.
Дростаналон – производная дигидротестостерона, 2а-метил-дигидротестостерон.
В результате, у нас получается неароматизирующийся умеренный анаболик\мощный андроген, поэтому задержку воды и гинекомастию мы можем не брать в расчет.
Также он обладает антиэстрогенной активностью, примерно также как провирон. Культуристы находят этот стероид очень удобным для предсоревновательной подготовки.
Он улучшает внешний вид мускулов, усиливает их жесткость, прорисованность, снижает процент подкожного жира. Раньше этот препарат не ловился на допинг-контроле, но с начала 90-ых есть методика по выявлению его метаболитов моче.
Некоторые атлеты утверждают, что если прекратить прием мастерона за 3-4 недели до соревнований - можно пройти допинг-контроль, но надо иметь ввиду, что иньекционные эфиры могут по разному вести себя в разных организмах.
Хоть дигидротестостерон и не очень активен в мышечных тканях, 2альфа-метилирование очень усиляет его анаболические способности.
Мастерон- стероид для построения качественной массы. Наиболее хорошо будут видны его свойства, если применять его в связке с такими иньекционными препаратами, как нандролона деканоат\болденона ундесилинат.
Для большего роста массы, можно применять связки мастерона с метандростенолоном\эфирами тестостерона. Также мастерон может использоваться в предсоревновательной подготовке, в связке с винстролом\примоболаном\оксандролоном.
Пропионатный эфир держится в крови очень короткое время, всего лишь несколько дней, поэтому иньекции мастерона нужно производить хотя бы каждые 3-4 дня, для поддержания его уровня в крови. Дозировка составляет 200-350мг в неделю для мужчин.
Женщинам лучше не применять этот препарат ввиду его высокой андрогенности и возможных побочных эффектов вирилизации. Если же все-таки женщина-культуристка решится на его использование, дозировка должна быть ограничена 25-50 мг в неделю.
Мастерон не представляет вреда для печени, поэтому его можно использовать в длинных циклах. Единственные побочные эффекты- андрогенные (сальная кожа, акне, агрессивность, рост волос на теле и лице)
Проскар не поможет нам в случае мастерона, так как мастерон- искусственная производная дигидротестостерона. Также не рекомендуется применять этот стероид людям начинающим лысеть, так как мастерон может усилить выпадение волос.
На черном рынке препарат доступен, производится фирмами BD, в дозировке 100мг\мл, под названием мастабол. Мастабол выпускается в стеклянных бочонках, с красной или синей жестяной запечаткой+ непосредственно на пластиковой крышке должно быть выбито название продукта.
Также есть еще произведенный в Бирме дромостан, и еще множество других андеграундных продуктов.
Оксиметалон![]()
![]()
![]() Андрогенный индекс: 45
Андрогенный индекс: 45
Анаболический индекс: 320
Хим. Название: 2-гидроксиметилен-17а-метил-дигидротестостерон
Эстрогенная активность: высокая
Прогестагенная активность: нет данных
Анадрол- американская торговая марка мощного орального андрогенного препарата- оксиметалона. Впервые был выпущен в 1960 году, компанией Syntex. Так как оксиметалон очень хорошо влияет на увеличение количества красных кровяных телец, препаратом заинтересовались в качестве средства для лечения анемии. В течении длительного времени оксиметалон использовался для лечения этого нарушения, вплоть до появления более безопасного эритропоэтина, который увеличивает количество красных кровяных телец, но без андрогенных побочек. Syntex прекратила его выпуск в 1993 году, ввиду его финансовой неокупаемости. Вскоре был прекращен его выпуск и в Австрии и в Швейцарии, а также в Испании. Но в связи распространением СПИДа, об оксиметалоне снова вспомнили. Теперь оксиметалон официально производится фирмой Unimed под названием анадрол.
Оксиметалон является одним из самых мощных аптечных стероидов. Новичок может при употреблении всего одной-двух таблеток в день в течении менее, чем 6 недель, может набрать 8-12кг массы. Большая из этого- набранная вода. В основном его использование – не для построения массы, а для смазки соединительных тканей, для повышения их эластичности и профилактики разрывов связок. Из-за его эстрогенных побочных эффектов, в течении курса рекомендуется использовать нольвадекс\кломид.
Важно отметить, что сам оксиметалон не ароматизируется. Оксиметалон – производная дигидротестостерона, с неароматизирующейся структурой. Но он имеет некоторую прогестагенную активность, также как нандролон, норэтандролон.
Также, из-за его прогестагенной активности, мы не можем использовать одновременно с ним ингибиторы ароматазы, а только рецепторные антагонисты, такие как нольвадекс\кломид. Цитадрен и аримидекс в этом случае бесполезны, так как ароматизации нет.
Также оксиметалон – очень сильный андроген, в результате чего возникают побочные эффекты в виде сальности кожи, акне, повышенного роста волос на теле и лице.
Ввиду очень высокой андрогенности, препарат не рекомендуется женщинам, так как может вызвать вирилизацию, еще до того как, вы примете какие-либо меры.
Надо отметить, что оксиметалон в небольшом количестве конвертируется в дигидротестостерон, но это не происходит через воздействие 5альфа редуктазой.
Структурно- оксиметалон это дигидротестостерон, с присоединенными в позиции 17-метильным радикалом, и в позиции 2- гидроксиметиленовой группы.
Принципиальный недостаток оксиметалона в том, что он 17 альфа алкилирован, что представляет опасность для печени. Это еще более усугубляет тем, что произоводится он в дозировке, намного большей, дозировка, в которой выпускает дианабол или станазолол.
Эта дозировка обьясняется тем, что он, в отличии от других стероидов, плохо связывается с андрогенными рецепторами. По медицинским показаниям, дозировка его должна составлять 1-5мг на килограмм веса больного, хотя это вызывает риск рака печени.
Атлеты не нуждаются в таких высоких дозировках, поэтому 50-150мг оксиметалона в день, в течении 4-6 недель. На курсе желательно следить за состоянием печени почек.
Из-за высокого скопления воды также необходимо контролировать кровяное давление.
После отмены препарата, может быть очень резкий спад и потеря веса, набранного на курсе, а так как оксиметалон вызывает сильное угнетение собственного тестостерона, не дожидаясь конца курса надо начинать прием ХГГ, параллельно с кломидом\нольвадексом.
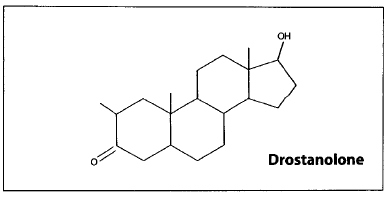
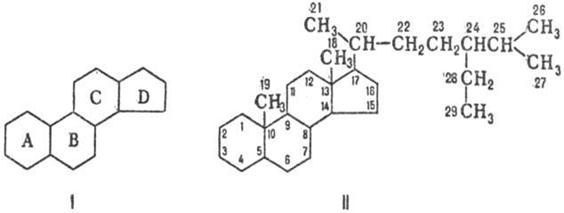
СТЕРОИДЫ, группа биологически важных прир. соед., в основе структуры к-рых лежит скелет циклопентанопер-гидрофенантрена (гонана, стерана; ф-ла I). Входят в состав всех растит. и животных организмов.
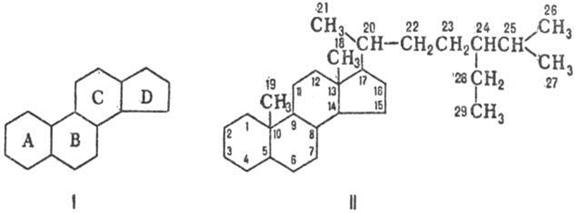
По номенклатуре ИЮПАК полная нумерация в стероидах производится так, как показано в ф-ле П. Если один или более атомов С отсутствуют, нумерация оставшейся части сохраняется. В формулах стероидов связи атомов или групп, располагающихся за плоскостью кольцевой системы (-конфигурация), изображают пунктирной линией, атомы и группы, располагающиеся перед плоскостью (-конфигурация), -жирной линией; связи с неопределенной конфигурацией обозначают волнистой линией. Назв. частично ненасыщенных стероидов производят от назв. насыщенных посредством окончания "ен". В названиях стероидов, содержащих внутри структуры трехчленное кольцо, вводится префикс "цикло" с цифровым указанием положения и стереохимией обозначения; общее назв. таких стероидов-циклостероиды.
Природные стероиды имеют транс- или цис-сочленение колец А и В, транс-сочленение колец В и С и обычно транс-сочленекие С и D. Циклогексановые кольца, как правило, находятся в энергетически выгодной конформации кресла. Большинство стероидов содержат гл. обр. группы СН3 у атомов С-10 и С-13, группу ОН (или кетогруппу) у атома С-3 и боковую цепь у атома С-17, содержащую до 8-10 атомов углерода.
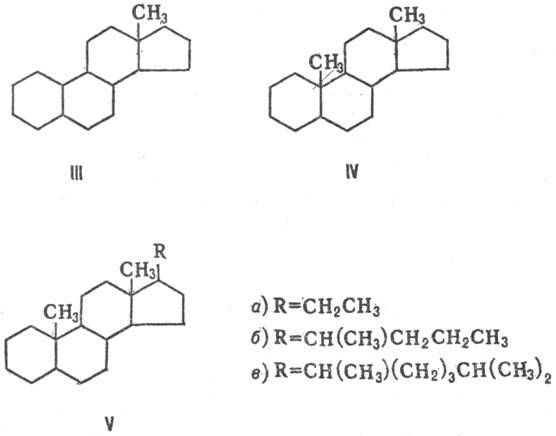
В зависимости от структуры боковой цепи и наличия групп СН3 различают производные эстрана (ф-ла III), андростана (IV), прегнана (Vа), холана (Vб) и холестана (Vв).
В химии стероидов широко применяют также и тривиальные назв., напр. холест-5-ен-3-ол наз. холестерином, 3, 7, 12а-тригидрокси-24-карбокси-5-холан-холевой к-той.
Стероиды включают в себя стерты (стеролы), сапонины, стероидные алкалоиды, стероидные гормоны, желчные кислоты, желчные спирты, гликозиды сердечные, витамин D.
Все стероиды (подобно др. изопреноидам) объединяются одной схемой биогенеза: в живой клетке из уксусной k-ты через ацетилкофермент А и мевалоновую к-ту строятся изопрено-вые фрагменты -изопентенилпирофосфат и изомерный ему диметилаллилпирофосфат, к-рые путем конденсации образуют общий биогенетич. предшественник -сквален; эпоксид последнего при циклизации с послед. окислит. отщеплением неск. углеродных атомов превращается в стероид.
Стероиды выделяют из спинного мозга и желчи рогатого скота, из щелочного гидролизата дрожжей, растит. масел и животных жиров, отходов целлюлозно-бумажной пром-сти, синтезируют из неприродного сырья. Полный синтез осуществлен для мн. природных стероидов-холестерина, андрогенов, гестагенов, кортикостероидов, эстрогенов и др.
Стероиды-биол. регуляторы. Способность к биосинтезу стероидов наиб. выражена у высших позвоночных. Насекомые стероиды не вырабатывают, а получают с пищей, однако ф-ция их линьки контролируется стероидами
СТЕРОИДЫ, группа биологически важных прир. соед., в основе структуры к-рых лежит скелет циклопентанопер-гидрофенантрена (гонана, стерана; ф-ла I). Входят в состав всех растит. и животных организмов.
По номенклатуре ИЮПАК полная нумерация в стероидах производится так, как показано в ф-ле П. Если один или более атомов С отсутствуют, нумерация оставшейся части сохраняется. В формулах стероидов связи атомов или групп, располагающихся за плоскостью кольцевой системы (-конфигурация), изображают пунктирной линией, атомы и группы, располагающиеся перед плоскостью (-конфигурация), -жирной линией; связи с неопределенной конфигурацией обозначают волнистой линией. Назв. частично ненасыщенных стероидов производят от назв. насыщенных посредством окончания "ен". В названиях стероидов, содержащих внутри структуры трехчленное кольцо, вводится префикс "цикло" с цифровым указанием положения и стереохимией обозначения; общее назв. таких стероидов-циклостероиды.
Природные стероиды имеют транс- или цис-сочленение колец А и В, транс-сочленение колец В и С и обычно транс-сочленекие С и D. Циклогексановые кольца, как правило, находятся в энергетически выгодной конформации кресла. Большинство стероидов содержат гл. обр. группы СН3 у атомов С-10 и С-13, группу ОН (или кетогруппу) у атома С-3 и боковую цепь у атома С-17, содержащую до 8-10 атомов углерода.
В зависимости от структуры боковой цепи и наличия групп СН3 различают производные эстрана (ф-ла III), андростана (IV), прегнана (Vа), холана (Vб) и холестана (Vв).

В химии стероидов широко применяют также и тривиальные назв., напр. холест-5-ен-3-ол наз. холестерином, 3, 7, 12а-тригидрокси-24-карбокси-5-холан-холевой к-той.
Стероиды включают в себя стерты (стеролы), сапонины, стероидные алкалоиды, стероидные гормоны, желчные кислоты, желчные спирты, гликозиды сердечные, витамин D.
Все стероиды (подобно др. изопреноидам) объединяются одной схемой биогенеза: в живой клетке из уксусной k-ты через ацетилкофермент А и мевалоновую к-ту строятся изопрено-вые фрагменты -изопентенилпирофосфат и изомерный ему диметилаллилпирофосфат, к-рые путем конденсации образуют общий биогенетич. предшественник -сквален; эпоксид последнего при циклизации с послед. окислит. отщеплением неск. углеродных атомов превращается в стероид.
Стероиды выделяют из спинного мозга и желчи рогатого скота, из щелочного гидролизата дрожжей, растит. масел и животных жиров, отходов целлюлозно-бумажной пром-сти, синтезируют из неприродного сырья. Полный синтез осуществлен для мн. природных стероидов-холестерина, андрогенов, гестагенов, кортикостероидов, эстрогенов и др.
Стероиды-биол. регуляторы. Способность к биосинтезу стероидов наиб. выражена у высших позвоночных. Насекомые стероиды не вырабатывают, а получают с пищей, однако ф-ция их линьки контролируется стероидами
Похожие работы
... атлета такие маленькие дозировки уже не дают должного прогресса. Что я имею ввиду? Сейчас поясню. Нондралона Деканоата действительно является самым популярным препаратом в спортивном мире из класса анаболических стероидов. Но вот дозировки по мере стажа его использования у бодибилдеров должны потихонечку повышаться. Многие по этому по прошествию четырех курсов начинают жаловаться на то, что их ...
... подразумевают упорядоченную связь и взаимодействие между элементами системы, благодаря которой и возникают новые целостные свойства. В такой химической системе, как молекула, именно специфический характер взаимодействия составляющих ее атомов определяет свойства молекулы. 3.2 «Триумфальное шествие органического синтеза» Возникновение структурной теории позволило химикам впервые обрести ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...

0 комментариев