Навигация
Применение теории МО для описания строения пи-комплексов и металлоценов
3. Применение теории МО для описания строения пи-комплексов и металлоценов
Особенная и чрезвычайно широкая область координационных соединений металлов представлена пи-комплексами — соединениями, в которых центральный атом образует многоцентровые связи с лигандами в результате обобществления своих d-орбиталей с делокализованными пи-орбиталями лигандов. Прототипом пи-комплексов являются более простые алкеновые комплексы металлов, первый представитель которых — хлороплатинат К [С2Н4 •PtCl3] — в виде кристаллогидрата был получен В. Цейзе еще в 1827 г. при кипячении в этиловом спирте платинохлористоводородной кислоты с последующим добавлением к раствору КСl.
Природа связи в соли Цейзе XXV объясняется так называемой синергической моделью Дьюара—Чатта—Дункансона (1953), близкой по своей основной идее к описанию связывания в гексакар-бониле хрома (рис.7). Электронная плотность с высшей заполненной пи-МО этилена переносится на вакантную (spn) орбиталь металла (прямое донирование XXVIa). Упрочнение связи достигается также за счет эффекта обратного донирования (дативной связи) — частичного переноса электронов с заполненной d-орбитали металла на вакантную пи*-МО этилена. Строгие расчеты хорошо согласуются с общей схемой XXVI формирования связи в пи-комплексе XXV и других подобных ему структурах. Отвлечение электронной плотности со связывающей и частичное заселение антисвязывающей орбиталей этиленового фрагмента в XXV должно приводить к разрыхлению связи С = С в комплексе. Действительно, если частота валентного колебания этой связи в молекуле этилена равна 1623 см-1, а длина связи 0,1337 нм, то в соли Цейзе частота колебания связи понижается до 1511 см-1 , а длина связи возрастает до 0,1354 нм.
Еще более значительные изменения происходят в этиленовых тг-комплексах (рис.8.). Учитывая типы взаимодействий XXVIa,б, определяющих связывание в пи-комплексах, можно подойти к решению вопроса о конформационной предпочтительности пи-комплексов. Например, для железокарбонильного комплекса XXVIII можно представить две альтернативные конформации, учитывая бисфеноидную геометрию фрагмента Fe (CO)4 и предпочтительность экваториального положения алкена (рис. 9.):
На рис. 11 показана диаграмма орбитальных взаимодействий фрагментов для двух рассмотренных ориентации. Поскольку октаэдрическая симметрия уже не сохраняется, t2g -ряд соответствующим образом расщеплен.
Можно видеть, что взаимодействия, реализующие связь металл—лиганд, отвечают схеме Дьюара—Чатта—Дункансона. Однако оба типа связывающих эффектов — прямое и обратное донирование — возможны только в конформации XXVIIIa, тогда как в конформации XXVIII6, отличающейся поворотом одного из фрагментов в экваториальной плоскости на 90°, исчезает d-пи* -перекрывание. Это приводит к отсутствию обратного донирования, ослабляет связывание и дестабилизирует конформацию XXVIII6. По данным спектроскопии ЯМР, энергетический барьер для вращения фрагмента Fe (CO)4 в XXVIIIa, связанный с прохождением через XXVIIIб, составляет 42—65 кДж/моль.
Аналогичная схема связывания осуществляется и в пи-комплексах, образуемых более сложными сопряженными алкенами, таких, как, например, металлкарбонильные комплексы XXIX—XXXII (рис. 10.).
Рис. 12 показывает схему орбитальных взаимодействий фрагментов в комплексе.
Особое внимание в ряду пи-комллексов привлекли так называемые металлоцены, или соединения с сэндвичевой структурой. Первым известным металлоценом, полученным в 1951 г. Т. Кили и П. Посоном, стал ферроцен XXXIII (M-Fe), послуживший прототипом для многих синтезированных впоследствии его аналогов. Аналогичное сэндвичевое строение было доказано и для хромоцена — дибензолхрома XXXIV и его аналогов. Объяснение природы связывания в молекуле ферроцена было дано впервые М. Дяткиной и Е. Шусторовичем (1959). Было показано, что только пи-орбитали лигандов играют существенную роль в стабилизации сэндвичевой структуры комплекса.
На рис. 13 показаны происхождение и последовательность валентных энергетических уровней в ферроцене XXXIII (M = Fe), а также в дибензолхроме XXXIV (М = Сг), получаемые на основании теории орбитальных взаимодействий и подтвержденные данными многочисленных полу эмпирических и неэмпирических расчетов.
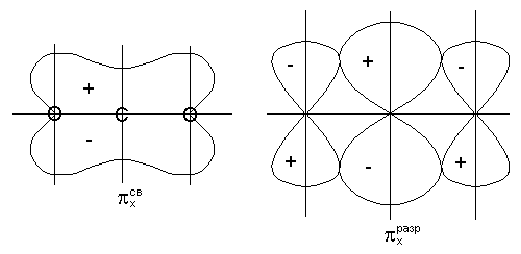
Восемнадцать валентных электронов ферроцена (восемь от центрального атома d6s2) заполняют все нижние уровни вплоть до е2g. Связи между металлом и кольцами обусловливаются МО а1g и е1g. Вид некоторых МО ферроцена показан на рис. 14.
Электронное строение других металлоценов XXXIII и XXXIV описывается той же схемой МО, что и представленная на рис. 13. Тип связывания, реализованный в металлоценах XXXIII, XXXIV и обусловленный d—пи-взаимодействиями, осуществляется и для более сложных ценовых, так называемых трехпалубных структур.
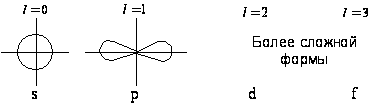
Аналогичный характер имеют орбитальные взаимодействия, определяющие устойчивость сэндвичевых комплексов лантаноидов и актиноидов. Поскольку для этих элементов активными валентными орбиталями являются орбитали f-типа с квантовым числом 1=3, подходящие по симметрии пи-орбитали циклического лиганда должны обладать уже не одной узловой плоскостью (как е1 и е2-МО циклопентадиена, комбинирующие с d-AO металла), а двумя. Это возможно лишь для циклических полиенов больших размеров, например для циклооктатетраена.
Похожие работы
... - + H3O+, внутрисферные превращения лимандов, например, координированных нитрилов R-CЇN (R - органический радикал) в амидины [Pt(R-CЇN)2Cl2] + 2NH3 [Pt()2Cl2] и другие превращения. Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных ...
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
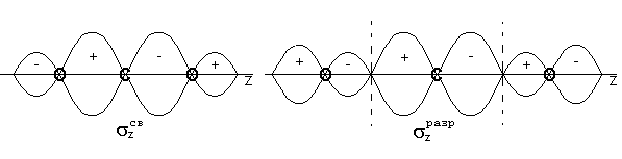
0 комментариев