Навигация
4. Правило 18 электронов
Анализ корреляционной диаграммы МО типового октаэдричес-кого комплекса ML6, в котором М — атом переходного металла (см. рис. 3), показывает, что в комплексе имеется девять низколежащих валентных МО (шесть связывающих и три несвязывающих), которые могут быть заселены 18 электронами. Диаграмма на рис. 11.13 относится к простейшему случаю лигандов L, образующих двухцентровые двухэлектронные связи. Как и в случае сигма-лигандов с р- и пи-орбиталями (например, С1-, СО, ...), именно двухцентровые двухэлектронные связи М—L определяют общую стабильность комплекса и можно ограничиться подсчетом электронов только на орбиталях этих связей. Из рис. 6 вытекает, что число электронов на таких орбиталях вместе с электронами на несвязывающих d-орбиталях металла также равно 18. Можно, таким образом, подойти к формулировке общего, весьма важного в химии координационных соединений «правила 18 электронов»: в устойчивых комплексах переходных металлов ML, общее число электронов на связях М—L и несвязывающих электронов металла равно 18.
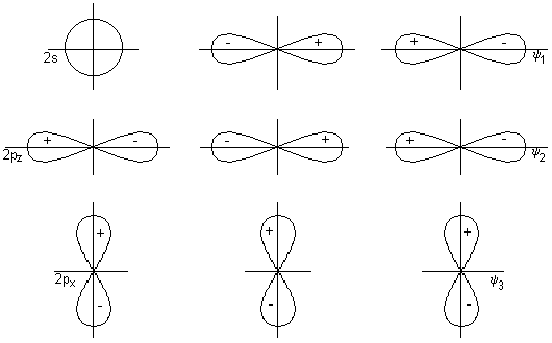
Это правило можно трактовать как стремление центрального атома металла иметь замкнутую электронную оболочку соответствующего атома инертного газа. Можно представить и другое общее объяснение, позволяющее одновременно предсказать важные исключения из данного правила. На рис. 18,а приведена обобщенная диаграмма орбитальных взаимодействий валентных р-, s-, d-орбиталей (общее число которых равно 9) с n симметризованными сигма-орбиталями лигандов L в комплексе MLn. Подходящие по симметрии n-орбитали центрального атома (можно рассматривать их как соответствующие dx sy pz -гибридные орбитали) образуют с орбиталями лиганда n связывающих и n антисвязывающих МО, а (9 — n) d-орбиталей металла, имеющих отличную симметрию, образуют несвязывающий уровень. Очевидно, что на связывающих и несвязывающих уровнях можно разместить 18 электронов.
При практическом использовании правила 18 электронов пренебрегают всеми другими орбитальными взаимодействиями, кроме сигма-связывания, и каждый лиганд рассматривается как вносящий два электрона в валентную оболочку комплекса. Таким образом, объединяются и обычные сигма-лиганды (NR3, РRз, Н2О, CH3-), и сигма-лиганды
с р—d-донорным эффектом (Сl-, ОН-), и сигма-лиганды с d-пи* -акцепторными свойствами (СО, CNR, CR2, NO+). Кроме того, пи-лиганды рассматриваются аналогичным образом как льюисовские основания, причем число вносимых ими электронов приравнивается к числу электронов на связывающих и несвязывающих пи-МО. Это число можно оценить согласно рис.15.
Для металла подсчитываются все электроны на s-, р-, d-оболочках и учитывается общий заряд комплекса.
Нетрудно проверить выполнение правила 18 электронов для большинства рассмотренных выше пи-комплексов, например ферроцена (M = Fe), хромоцена (М = Сг). В отличие от последнего в валентной оболочке рутеноцена в структуре D6h-симметрик (M = Ru) содержалось бы не 18, а 20 электронов (Ru — d6s2, 8 электронов и по 6 электронов от каждого бензольного кольца). Чтобы иметь в валентной оболочке 18 электронов, структура рутеноцена должна быть искажена таким образом, чтобы одно из бензольных колец участвовало в связывании лишь двумя пи-связями. Именно такая структура XXXVIII найдена для перметильного производного рутеноцена (рис. 16). В отличие от неполярного симметричного хромоцена IX молекула XXXVIII характеризуется достаточно высоким дипольным моментом 2,03 D в растворе. Другой аналогичный пример — искажение пятичленного циклопентадиенового кольца в сэндвичевом вольфрамдикар-бонильном комплексе XXXIX (рис. 16), позволяющее вывести одну пи-связь (два электрона) из общего связывания. Атом вольфрама вносит шесть, два карбонильных лиганда — четыре, плоский циклопен-тадиенильный фрагмент — пять, а деформированный — три электрона.
Необычная структура карбонила кобальта Со2(СО)8 также объясняется тем, что в ней достигается 18-электронная конфигурация валентной оболочки. Мостиковые карбонильные группы образуют многоцентровые связи, при формальном рассмотрении они отдают по одному электрону на оболочку каждого атома кобальта. Диамагнетизм Со2(СО)8 свидетельствует о спаривании электронов кобальта и образовании связи Со—Со. Действительно, расстояние Со—Со составляет, по данным рентгеноструктурных исследований, всего 0,25 нм. Аналогичным образом, в комплексе XJLII следует ожидать наличия двойной связи Rh=Rh (рис. 17).
Правило 18 электронов имеет немало исключений, и его следует рассматривать только как один из факторов, способствующих образованию стабильной структуры координационного соединения. Отклонения от правила связаны часто с пространственными ограничениями, не допускающими координации центральным атомом необходимого для заполнения 18-электронной оболочкой числа лигандов. Например, ясно, что ион V3+ (d2) должен координировать восемь двухэлектронных лигандов, чтобы заполнить валентную оболочку полностью. Однако пространственные возможности допускают только октаэдрическую координацию. Особенно важным отклонением от требований правила 18 электронов являются плоскоквадратные тетракоординированные и плоские трикоординированные комплексы. Как следует из схемы орбитальных взаимодействий, приведенной на рис. 18, а—в, в обоих этих случаях рz -АО центрального атома остается отключенной от связывания с лигандами, так как ее узловая плоскость совпадает с плоскостью, в которой располагаются оси сигма-орбиталей лигандов L. Из рисунка следует, что при этом образуется в сумме только восемь связывающих и несвязывающих орбиталей комплекса, на которых могут разместиться лишь 16 электронов. Следовательно, в случае плоских тетра- и трико-ординированных структур переходных металлов устойчивой является 16-электронная конфигурация.
Действительно, рассмотрим электронную конфигурацию центрального атома Pt в соли Цейзе XXV. Этиленовый пи-лиганд и три сигма-лиганда С1- дают каждый по два электрона, т. е. всего восемь электронов, в валентную оболочку. Учитывая заряд комплексного аниона —1, заряд центрального иона (или число окисления центрального атома) определяют как — 1 —(—3)= +2. Ион Pt2+(d8) дает в валентную оболочку восемь электронов. Общая сумма валентных электронов, определяемая таким образом, равна 16 (8 + 8). Шестнадцать электронов содержатся также в валентных оболочках плоских трикоординированных комплексов [Fe (SiNMe2)3], XXVII, и др.
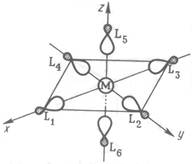
Рис. 1.

Рис. 2.
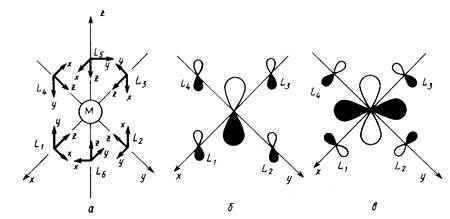
Рис.4.
Рис. 5.
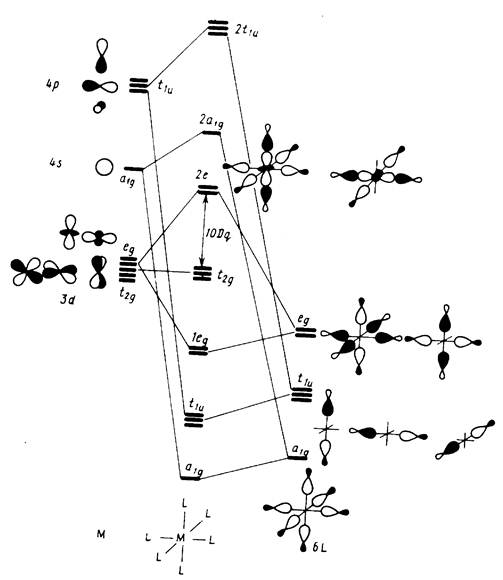
Рис. 3.
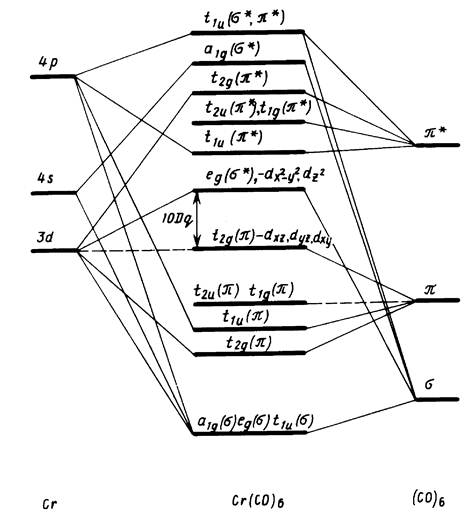
Рис. 6.
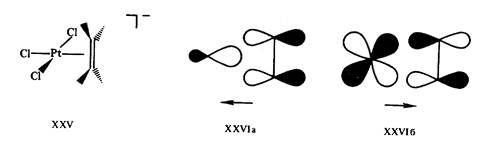
Рис. 7.
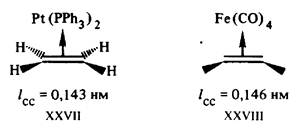
Рис. 8. Рис. 9.
Рис. 10.
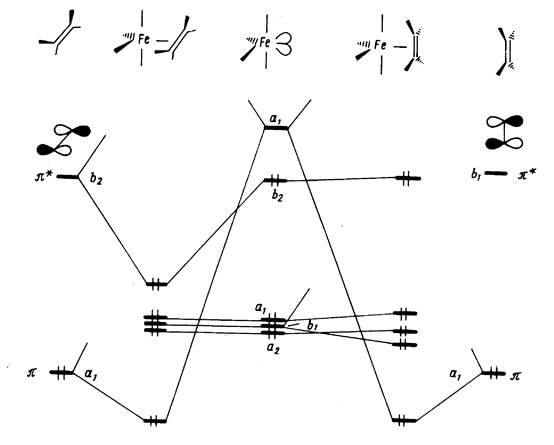
Рис. 11.
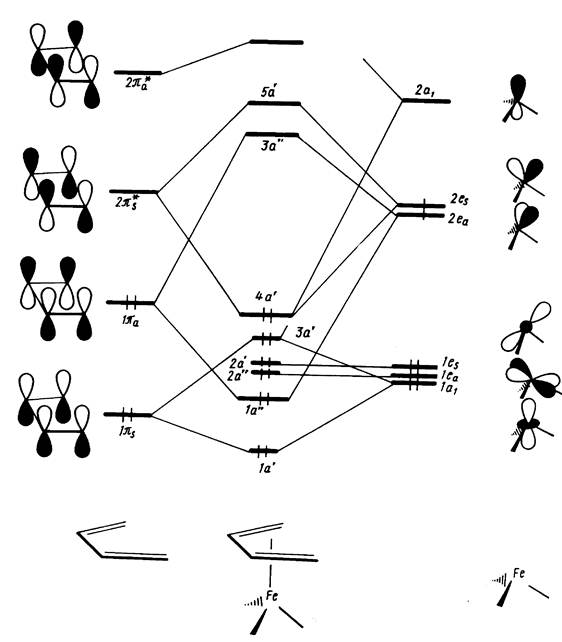
Рис. 12.
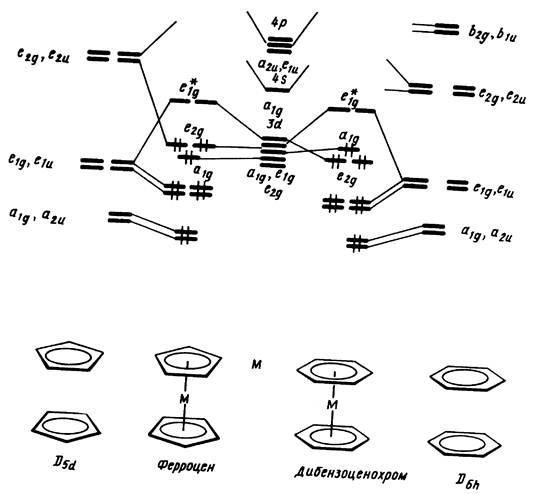
Рис. 13.
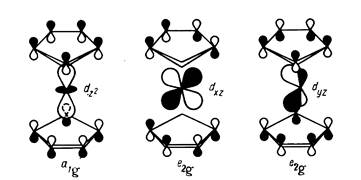
Рис. 14.
Рис. 15.

Рис. 16.

Рис. 17.
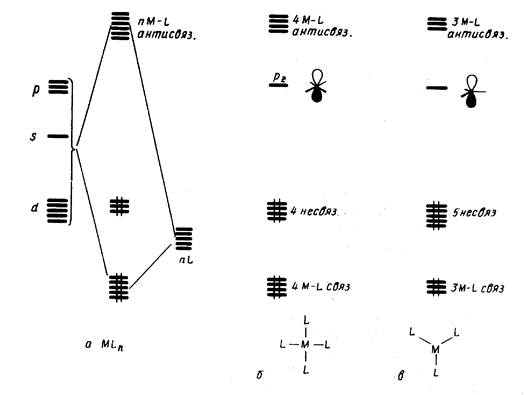
Рис. 18.
Похожие работы
... - + H3O+, внутрисферные превращения лимандов, например, координированных нитрилов R-CЇN (R - органический радикал) в амидины [Pt(R-CЇN)2Cl2] + 2NH3 [Pt()2Cl2] и другие превращения. Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных ...
... ;à НbО2- + ННb + СО2 Кислотно-основные свойства лигандов, связанных с комплексообразователем, часто выражены более ярко, чем кислотно-основные свойства свободных лигандов. 4. Комплексные соединения в аналитической химии 4.1 Качественный анализ катионов Первая группа катионов В первую аналитическую группу катионов входят ионов калия K+, натрия Na+, аммония NH4+ и магния Mg2+. ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
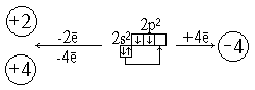
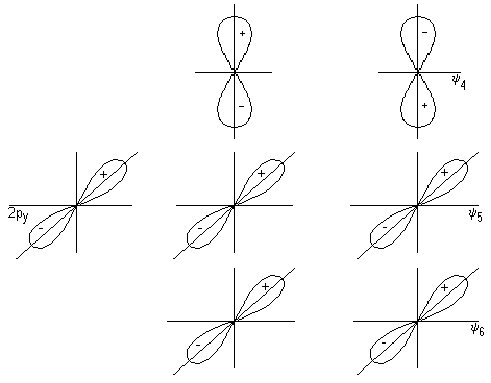
0 комментариев