Лабораторная работа
Тема: ”Теория электролитической диссоциации”
Опыт № 1. Разная сущность взаимодействия разбавленной и концентрированной серной кислоты с металлами
Оборудование и реактивы: Штатив с пробирками, цинк в гранулах, концентрированная серная кислота, химический стакан, дистиллированная вода, шпатель.
Ход работы: В сухую пробирку кладут 2-3 кусочка цинка, приливают 2-3 мл концентрированной серной кислоты. Затем кислоту с цинком переливают в другую пробирку, в которой налита вода (в 5 раз больше взятого объема кислоты). Разъяснить наблюдаемые явления, написать уравнения реакций.
Техника безопасности: 1. Кислоту с цинком переливать в пробирку с водой, а не наоборот 2. После окончания опыта пробирки положить в кристаллизатор с небольшим количеством воды.
Утилизация. Промыть гранулы цинка, высушить и поместить в склянку с цинком. В полученном разбавленном растворе находится серная кислота и сульфат цинка. Добавьте в раствор гранулы цинка, оксид цинка, карбонат цинка или гидрокарбонат цинка до прекращения их растворения. Раствор фильтруют и выпаривают. Кристаллы сульфата цинка используйте в качестве реактива, оставшиеся вещества на фильтре промыть, высушить и перенести в склянку.
Опыт № 2. Свойства сухой извести и ее раствора
Оборудование и реактивы: Сухой фенолфталеин, гидроксид кальция (сухой), химический стакан, штатив с пробирками, колба с дистиллированной водой, стеклянная палочка, шпатель.
Ход работы: В сухую пробирку насыпают немного порошка гашеной извести и добавляют небольшое количество сухого фенолфталеина. Пробирку энергично встряхивают. Затем в пробирку добавляют немного воды. Объяснить наблюдаемое явление. Выразить процессы химическими уравнениями.Утилизация. Смесь из пробирки перенести в емкость-нейтрализатор со щелочным раствором.
Опыт № 3. Изменение степени гидратации ионов меди в процессе растворения
Оборудование и реактивы: Кристаллический хлорид меди (II), его концентрированный раствор, колба с дистиллированной водой, штатив с пробирками, мерный цилиндр, шпатель.
Ход работы: Концентрированный раствор хлорида меди и его кристаллы имеют зеленую окраску, обусловленную наличием негидратированных и частично гидратированных катионов меди (Cu2+. 2H2O). Разбавленный раствор имеет голубую окраску, присущую гидратированным ионам двухвалентной меди (Cu2+. 4H2O). Берут пять пробирок, в каждую наливают 4-5 мл хлорида меди (конц.):
первая пробирка – для контроля;
вторая пробирка – добавляют 1 мл воды;
третья пробирка – добавляют 2 мл воды;
четвертая пробирка – добавляют 3 мл воды;
пятая пробирка – добавляют 4 мл воды.
Наблюдается постепенный переход от зеленой до голубой окраски, то есть увеличивается степень гидратации ионов меди.
Утилизация. Все растворы хлорида меди слить и оставить для естественной кристаллизации или подвергнуть выпариванию. Концентрированный раствор или кристаллы соли использовать вновь.
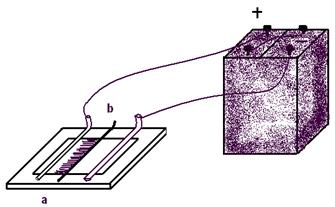
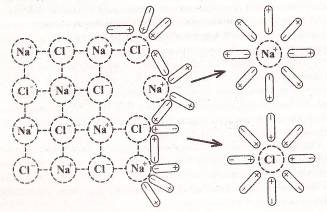
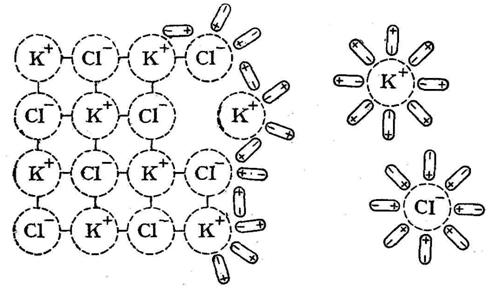
Опыт № 4. Определение степени электролитической диссоциации различных веществ
Оборудование и реактивы: Прибор для определения электролитической проводимости, в U-образных трубках: раствор аммиака, раствор серной кислоты, раствор хлорида натрия, хлорид натрия (кристал.), раствор уксусной кислоты, спирт, шпатель.
Ход работы: В U-образные трубки поместить различные вещества и растворы. Опускают электроды в U-образные трубки (все сразу) и включают в сеть. Объяснить наблюдаемые явления.
Техника безопасности: 1. Включать прибор в сеть в том случае, если все электроды погружены в U-образные трубки.
2. Обеспечить хороший контакт металлических проводников.
3. После окончания опыта вынуть электроды, промыть их и высушить.
Опыт № 5. Демонстрация теплового эффекта растворения
Оборудование и реактивы: Манометр с подкрашенной жидкостью, две пробирки, две стеклянные палочки, аммиачная селитра, гранулы гидроксида натрия, колба с дистиллированной водой, шкала, шпатель.
Ход работы: На одно из колен первого и второго манометра надеваем резиновые трубки. Их концы соединяем с пробирками через пробку со вставленной в неё газоотводной трубкой. Пробирки помещаем в химические стаканы, в которых проводим растворение гидроксида натрия и аммиачной селитры. При растворении гидроксида натрия выделяется тепло, в результате этого происходит расширение воздуха в пробирке и уровень жидкости в манометре повышается. При растворении аммиачной селитры в воде наблюдается поглощение тепла, что приводит к сжатию воздуха в пробирке, в результате этого уровень жидкости в манометре понижается. Объяснить наблюдаемые явления физико-химическими процессами при растворении.
Утилизация: Использовать полученные растворы щелочи и нитрата аммония в лаборатории.
Опыт № 6. Движение ионов в электрическом поле
Оборудование и реактивы: U-образная трубка, раствор нитрата калия, кристалличекий перманганат калия, прибор для электролиза, шпатель.
Ход работы: На дно U-образной трубки помещаем несколько кристалликов перманганата калия, завернутых в фильтровальную бумагу. Затем в трубку наливают 1% раствор нитрата калия так, чтобы электроды были погружены в раствор. В оба конца вставлены угольные электроды. Прибор готовят за 5-10 мин. до эксперимента. За это время перманганат успевает раствориться и окрашенный раствор займет нижнюю часть трубки. Прибор подключают к источнику тока с напряжения 10-12 в. Через несколько минут окрашенные ионы MnO4- смещаются к аноду. Это замечается по перемещению малиновой окраски в ту часть жидкости, в то колено U-образной трубки, где находится анод.
Примечание: Успешное проведение опыта зависит от равномерного окрашивания нижней части раствора перед подведением напряжения к электродам, а также не следует увеличивать напряжение для более быстрого проведения опыта. Увеличение напряжения приводит к перемешиванию раствора и окрашенных слоев.
Техника безопасности: 1. Соблюдать все меры предосторожности при работе с источником тока, выпрямитель должен быть заземлен.
Утилизация: Слить содержимое U-образной трубки в емкость-нейтрализатор.
Опыт № 7. Реакции обмена между электролитами
Оборудование и реактивы: Штатив с пробирками, разбавленные растворы углекислого натрия, азотной кислоты, хлорида меди, гидроксида калия, гидроксида натрия, серной кислоты, сульфата натрия, соляной кислоты, хлорида магния, сульфата меди, твердый карбонат калия, шпатель.
Провести химические реакции между следующими веществами:
а) соль + щелочь:
MgCl2 + NaOH®
CaCO3 + NaOH ®
K2SO4 + NaOH ®
б) соль + сольK2SO4 + BaCl2 ®
CaCO3 + MgCl2®
K2SO4 + MgCl2 ®
в) соль + кислота
K2SO4 +H3PO4®
CaCO3 + HNO3®
K2CO3 +HCl ®
NaCl + H2CO3®
Указать признаки протекания реакций. Сформулировать условия взаимодействия названных классов веществ друг с другом (см. пункты: а, б, в).
Утилизация: Содержимое пробирок (а) перенести в емкость-нейтрализатор. Туда же поместить содержимое пробирок с солями бария (б). Остальные жидкости можно слить в раковину, т. к. в них не содержится токсичных веществ.
Похожие работы
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... важно для выяснения механизмов электролиза, электрокатализа, электрокристаллизации, коррозии металлов и др., для совершенствования механизмов разделения веществ - экстракции и ионного обмена. Исследование свойств электролитов стимулируется энергетическими проблемами (создание новых топливных элементов, солнечных батарей, электрохимических преобразователей информации), а также проблемами защиты ...
... . Реакция среды в этом случае зависит от соотношения констант диссоциации соответствующих основания и кислоты. Усилить гидролиз можно разбавлением раствора, нагреванием системы. 2. Химические реакции Химические реакции (химические явления) – это процессы, в результате которых одни вещества превращаются в другие. Признаками осуществления химических реакций являются: – изменение цвета; ...
... электролита в растворе и принимает максимальное значение a = 1 в бесконечно разбавленном растворе. так как процесс диссоциации является эндотермическим, то степень диссоциации слабого электролита в водных растворах будет увеличиваться с повышением температуры. Константой электролитической диссоциации К называется постоянная химического равновесия в растворе электролита: , где [К+], [A-] и [KA] - ...
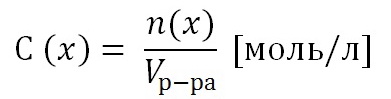
0 комментариев