Навигация
Электролиты и их свойства
Введение
Водные растворы солей, кислот и оснований обладают некой особенностью — они проводят электрический ток. При этом безводные твердые соли и основания, а также безводные кислоты тока не проводят; почти не проводит тока и чистая вода. Очевидно, что при растворении в воде подобные вещества подвергаются каким-то глубоким изменениям, которые и обусловливают электропроводность получаемых растворов.
Например, при прохождении тока через раствор серной кислоты, происходит разложение воды на составные части – водород и кислород, выделяющиеся на пластинах, соединенных соответственно с отрицательным и положительным полюсами батареи. Такого рода растворы, разлагающиеся химически при прохождении через них тока, будем называть электролитами, а сам процесс разложения вещества электрическим током – электролизом.
1. Определение электролитов
Можно сказать, что электролиты – это вещества, в которых в заметной концентрации присутствуют ионы, обусловливающие прохождение электрического тока (ионную проводимость). Электролиты также имеют название проводников второго рода.
В узком смысле слова электролиты – вещества, молекулы которых в растворе, вследствие электролитической диссоциации, распадаются на ионы. Среди электролитов различают твердые, растворы электролитов и ионные расплавы. Растворы электролитов часто также называют электролиты. В зависимости от вида растворителя электролиты делятся на водные и электролиты неводные. К особому классу относятся высокомолекулярные электролиты – полиэлектролиты.
В соответствии с природой ионов, образующихся при электролитической диссоциации водных растворов, выделяют солевые электролиты (в них отсутствуют ионы Н+ и ОН-), кислоты (преобладают ионы Н+) и основания (преобладают ионы ОН-). Если при диссоциации молекул электролитов число катионов совпадает с числом анионов, то такие электролиты называют симметричными (1,1 -валентными, например, КСl, 2,2-валентными, например, CaSO4, и т.д.). В противном случае электролиты называют несимметричными (1,2-валентные электролиты, напр. H2SO4, 3,1-валентные, например, А1(ОН)3, и т.д.). В зависимости от способности к электролитической диссоциации электролиты условно разделяют на сильные и слабые. Слабые электролиты характеризуются, прежде всего, константой и степенью диссоциации, а сильные активностью ионов.
1.1 Слабые электролиты. Константа и степень диссоциации
Молекулы слабых электролитов лишь частично диссоциированы на ионы, которые находятся в динамическом равновесии с недиссоциирующими молекулами. К слабым электролитам относятся многие органические кислоты и основания в водных и неводных растворителях. Степень диссоциации зависит от природы растворителя, концентрации раствора, температуры и других факторов( <1). Один и тот же электролит при одинаковой концентрации, но в различных растворителях образует растворы с различной степенью диссоциации.
В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации — ионами. Например, в водном растворе уксусной кислоты устанавливается равновесие
![]()
![]() СНзСООН Н+ + СН3СОО-
СНзСООН Н+ + СН3СОО-
Константа которого (константа диссоциации) связана с концентрациями соответствующих частиц соотношением:
К = [н+] [сн3соо-]
[сн3соо]
Степенью диссоциации а электролита называется доля его молекул, подвергшихся диссоциации, т. е. отношение числа молекул, распавшихся в данном растворе на ионы, к общему числу молекул электролита в растворе.
В случае электролита MX, диссоциирующего на ионы М+ и Х-, константа и степень диссоциации связаны соотношением (закон разбавления Оствальда)
К = а2С/1 - а
где С — молярная концентрация электролита, моль/л.
Если степень диссоциации значительно меньше единицы, то при приближенных вычислениях можно принять, что 1 - а![]() 1. Тогда выражение закона разбавления упрощается:
1. Тогда выражение закона разбавления упрощается:
К = а2С
Отсюда
![]()
![]()
Последнее соотношение показывает, что при разбавлении раствора (т. е. при уменьшении концентрации электролита С) степень диссоциации электролита возрастает.
Если в растворе электролита MX степень его диссоциации равна а, то концентрации ионов М+ и Х- в растворе одинаковы и составляют:
[М+]=[Х-]=аС
Подставив сюда значение а из предыдущего соотношения, находим:
[М+]=[Х-]=С![]() =
=![]()
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой К, а так называемым показателем константы диссоциации рК, который определяется соотношением
рК = - lg К
Очевидно, что с возрастанием К, т. е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислота.
При введении в раствор слабого электролита одноименных ионов (т. е. ионов, одинаковых с одним из ионов, образующихся при диссоциации электролита) равновесие диссоциации нарушается и смещается в направлении образования недиссоциированных молекул, так что степень диссоциации электролита уменьшается. Так, прибавление к раствору уксусной кислоты ее соли (например, ацетата натрия) приведет к повышению концентрации ионов СН3СОО - и, в соответствии с принципом Ле Шателье, равновесие диссоциации сместится влево.
![]()
![]() СНзСООН Н+ + СН3СОО-
СНзСООН Н+ + СН3СОО-
В растворах многоосновных кислот, а также оснований, содержащих несколько гидроксильных групп, устанавливаются ступенчатые равновесия, отвечающие последовательным стадиям диссоциации. Так, диссоциация ортофосфорной кислоты протекает в три ступени, каждой из которых отвечает определенное значение ступенчатой константы диссоциации. Поскольку К1 >> К2 >>К3, то в наибольшей степени протекает диссоциация по первой ступени, а при переходе к каждой последующей стадии степень диссоциации, как правило, резко уменьшается.
Н3РО4 ↔Н+ + Н2РО4- (К1=7,5 . 10-3)
Н2РО4- ↔ Н+ + НРО42- (К2=6,3 . 10-8)
НРО42- ↔ Н+ + РО43- (К3=1,3 . 10-12)
Диссоциация электролита приводит к тому, что общее число частиц растворенного вещества (молекул и ионов) в растворе возрастает по сравнению с раствором неэлектролита той же молярной концентрации. Поэтому свойства, зависящие от общего числа находящихся в растворе частиц растворенного вещества (коллигативные свойства), — такие, как осмотическое давление, понижение давления пара, повышение температуры кипения, понижение температуры замерзания — проявляются в растворах электролитов в большей степени, чем в равных по концентрации растворах неэлектролитов. Если в результате диссоциации общее число частиц в растворе электролита возросло в i раз по сравнению с числом его молекул, то это должно быть учтено при расчете осмотического давления и других коллигативных свойств. Формула для вычисления понижения давления ∆р пара растворителя приобретает в этом случае следующий вид:
∆р= р0 in2/п1+ in2
Здесь
р0 — давление насыщенного пара над чистым растворителем;
п2 — число молей растворенного вещества;
п1 — число молей растворителя;
i — изотонический коэффициент или коэффициент Вант-Гоффа.
Аналогично понижение температуры кристаллизации ∆tкрист и повышение температуры кипения ∆tкип раствора электролита находят по формулам
∆tкрист =iKm
∆tкип=iEm
где m — моляльная концентрация электролита, а К и Е — соответственно, криоскопическая постоянная и эбуллиоскопическая постоянная растворителя.
Наконец, для вычисления осмотического давления (Р, кПа) раствора электролита используют формулу
Р =iCRT
где С — молярная концентрация электролита, моль/л; R — газовая постоянная (8,31 Дж . моль-1. К-1); Т — абсолютная температура, К.
Нетрудно видеть, что изотонический коэффициент i может быть вычислен как отношение ∆р , ∆tкрист, ∆tкип, Р, найденных на опыте, к тем же величинам, вычисленным без учета диссоциации электролита (∆рвыч, ∆tкрист.выч, ∆tкип.выч, Рвыч):
i=∆р/∆рвыч=∆tкрист/∆tкрист.выч=∆tкип/∆tкип.выч=Р/ Рвыч
Изотонический коэффициент i связан со степенью диссоциации электролита а соотношением
i=1+a (k - 1) или ![]()
где k — число ионов, на которые распадается при диссоциации молекула электролита (для КСl k = 2, для ВаСl2 и Na2SO4 k =3 и т. д.).
Таким образом, найдя по опытным величинам ∆р, ∆tкрист и т. п. значение i, можно вычислить степень диссоциации электролита в данном растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение а выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворе.
Похожие работы
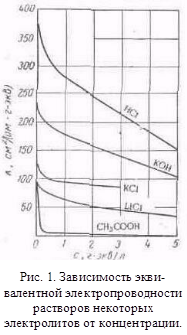
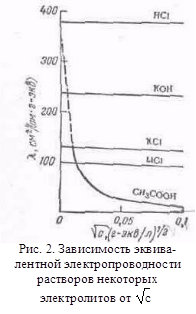
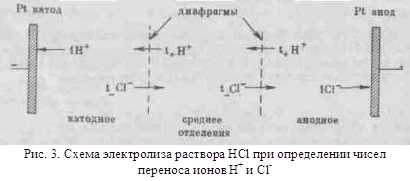
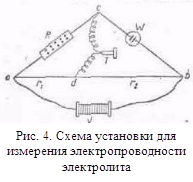
... с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например на кривых λ-с часто наблюдается минимум (аномальная электропроводность). 2. Подвижность ионов Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. Для вычисления электропроводности достаточно подсчитать число ионов, ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
... 17-25 кг/т алюминия, что на ~ 10-15 кг/т выше по сравнению с результатами для песчаного глинозёма. В глинозёме, используемом для производства алюминия, должно содержаться минимальное количество соединений железа, кремния, тяжелых металлов с меньшим потенциалом выделения на катоде, чем алюминий, т.к. они легко восстанавливаются и переходят в катодный алюминий. Нежелательно также присутствие в ...
0 комментариев