Навигация
Органические соединения натрия
1.2 Органические соединения натрия
Натрийорганические соединения сохраняют ряд общих черт с органическими соединениями лития, однако их специфика заключается: а) в преимущественной роли реакции металлирования при их синтезе, открытой П. П. Шорыгиным (1910 г.) и детально разработанной на примере получения органических соединений натрия; б) в большей реакционной способности, затрудняющей их синтетическое использование. Практическое значение органических соединений натрия связано с инициируемой ими реакцией полимеризации 1,3-бутадиена.
Способы получения. Металлирование (замена водорода натрием в органических соединениях). Металлирующими агентами могут быть натриевые производные предельных углеводородов, амид натрия в жидком аммиаке и металлический натрий. Металлированию подвергаются преимущественно следующие группы органических соединений: ароматические углеводороды, жирноароматические соединения, ацетиленовые углеводороды.
Непосредственным действием металлического натрия на ароматические соединения (бензол) нельзя заменить в них водород металлом. Реакция сводится к действию натрийалкила на металлируемый ароматический углеводород при 0—25°С:
![]()
Натрийорганические соединения, как и литийорганические соединения, обычно не выделяются в свободном виде и используются в растворах для дальнейших синтезов:
![]()
Ацетилен и монозамещенные ацетиленовые углеводороды металируются натрием или амидом натрия в жидком аммиаке. Действие амида натрия на винилацетилен приводит к винилацетилениду натрия, представляющему собой белые кристаллы, самовоспламеняющиеся на воздухе.
Металлический натрий присоединяется к диеновым углеводородам — 1,3-бутадиену в положения 1,4 и 1,2, образуя соответственно 1,4-динатрий-2-бутен и 3,4-динатрий-1-бутен (которые инициируют полимеризацию бутадиена). Металлический натрий может быть заменен алкилнатрием, например амилнатрием.
Химические свойства. В реакции металлирования углеводороды проявляют свойства слабых кислот. По существу реакция металлирования является реакцией вытеснения слабой кислотой еще более слабой кислоты из ее солей.
Порядок вытеснения из натриевых производных углеводородов позволяет составить ряд по возрастающей кислотности:
![]()
Натрийорганические соединения имеют ионный характер, причем анионом является остаток углеводорода (карбанион), а анионом — металл.
Натрийалкилы — сильные основания; так, этилнатрий — сильнейшее из известных оснований.
Натрийорганические соединения, как и органические соединения лития, при действии воды, спиртов и кислот разлагаются с замещением натрия водородом:
![]()
1.3 Органические соединения калия
Исследования в области калийорганических соединений сопряжены со значительными трудностями, связанными с их большой реакционной способностью, и в частности со склонностью органических соединений воспламеняться на воздухе. Реакционная способность органических соединений щелочных металлов возрастает в ряду:![]()
Калийорганические соединения удобно получать реакциями металлирования или из ртутьорганических соединений замещением менее реакционноспособной ртути на более реакционноспособный калий. Например, этилкалий образуется при действии на диэтилртуть металлическим калием:
![]()
Реакция присоединения металлоорганических соединений щелочных металлов к соединениям с двойными связями была впервые осуществлена К. Циглером (1928 г.) на примере взаимодействия фенилизопропилкалия со стильбеном. Течение реакции легко контролировать по обесцвечиванию фиолетово-красной окраски фенилизопропилкалия.
2. ЭЛЕМЕНТЫ ВТОРОЙ ГРУППЫ
Элементы второй группы имеют на внешней электронной оболочке два неспаренных электрона, поэтому они двухвалентны.
Преобладающее практическое значение имеют органические соединения двух металлов второй группы: магния и ртути.
Металл может быть связан с одним органическим остатком (алкилом или арилом), например R-Me-Hal: ![]() , бромид метилмагния, или с двумя органическими остатками (алкилами или арилами), например R-Me-R’:
, бромид метилмагния, или с двумя органическими остатками (алкилами или арилами), например R-Me-R’: ![]() , диэтилртуть.
, диэтилртуть.
2.1 Органические соединения магния
Магнийорганические соединения были широко введены в практику органического синтеза В. Гриньяром (1900 г.) и нашли большое применение в органической химии. Образование натнийорганинческих соединений наблюдал за год до этого учитель В. Гриньяра — Ф. Барбье.
Получены магнийорганические соединения почти всех классов органических веществ. Синтезы при участии магнийорганических соединений являются одним из важных препаративных методов в органической химии; описано свыше 20 тысяч синтезов при помощи магнийорганических соединений.
Способы получения. 1. В среде эфира. Магнийорганические соединения образуются обычно при взаимодействии галогеноалкилов (арилов) с металлическим магнием в среде сухого эфира. Реакция идет при отсутствии влаги. В некоторых случаях реакцию инициируют, добавляя каталитические количества йода или дибромэтана.
2. Безэфирный метод синтеза. Главным препятствием к использованию магнийорганнческих соединений в промышленном органическом синтезе является применение огнеопасного этилового эфира в качестве растворителя. Поэтому были разработаны безэфирные методы синтеза магнийорганических соединений.
Образование магнийорганических соединений из галогеноалкилов и магния катализируется галоидными солями или кислородными соединениями различных металлов (Hg, Al, Sn) и неметаллов (Si, Sb, P) или их алкильными производными. Например, образование магнийорганического соединения в среде ароматических углеводородов (бензола, толуола) инициируется каталитическим количеством тетраэтоксисилана:
![]()
Полученное магнийорганическое соединение далее может быть использовано для синтеза кремнийорганических соединений:
![]()
3. Синтез винильных магнийорганических соединений в тетрагидрофуране. Долгое время были безуспешными попытки синтеза магнийорганических соединений с винильными радикалами из галогенвинилов и магния. Причиной этих неудач была незначительная подвижность галогенов при двойной связи. Однако применение в качестве реакционной среды тетрагидрофурана, а также тетрагидропирана, этиловых и дибутиловых эфиров этиленгликоля позволило осуществить эту реакцию (Г. Норман, 1954 г.):
![]()
Реакционная способность винильных магнийорганических производных так же высока, как алкильных магниевых соединений, они широко используются в реакциях введения винильного остатки в органические соединения (реакция винилирования).
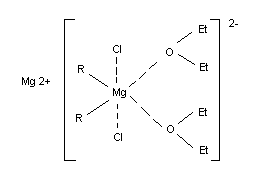
Строение магнийорганических соединений может быть выражено простой формулой R—Mg—Hal, пригодной для оценки стехиометрии реакции. Однако в действительности магнийорганические соединения имеют более сложное строение, определяемое многими фактами (природой органического радикала, галогена и растворителя).
Мономерные формы (R—Mg—Hal) преобладают при низких концентрациях, в нуклеофильных растворителях и для бромидов и иодидов. Равновесие смещается к димерным (![]() ) и полимерным формам при увеличении концентрации магнийорганического соединения и для хлоридов. Мономерные магнийорганические соединения могут содержать равновесную смесь: алкилмагнийгалогениды (
) и полимерным формам при увеличении концентрации магнийорганического соединения и для хлоридов. Мономерные магнийорганические соединения могут содержать равновесную смесь: алкилмагнийгалогениды (![]() ), диалкилмагниевые соединения (
), диалкилмагниевые соединения (![]() ), ионные магнийорганические соединения (
), ионные магнийорганические соединения (![]() ,
,![]() ,
,![]() ). Несмотря на их небольшую концентрацию, они играют существенную роль в реакциях:
). Несмотря на их небольшую концентрацию, они играют существенную роль в реакциях:
![]()
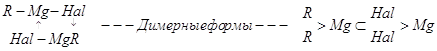
Магнийорганические соединения сольватируются растворителями (например, этиловым эфиром), образуя кристаллические комплексы, в которых установлено взаимодействие между атомами магния и кислорода.
Химические свойства. Магнийорганические соединения не выделяются в свободном виде, обладают высокой реакционной способностью и непосредственно вводятся в дальнейшие реакции. Они вступают в реакции обмена, остаток Mg — Hal замешается водородом, алкильными радикалами, различными металлами и неметаллами. Однако наиболее характерной является реакция присоединения магнийорганических соединений к двойным поляризованным связям. Как раз эти реакции определили выдающуюся роль магнийорганических соединений в органическом синтезе. Основное значение этих реакций заключается в образовании новых углерод-углеродных связей.
Взаимодействие с соединениями, содержащими подвижный атом водорода. Вода, спирты, кислоты разлагают магнийорганические соединения с образованием углеводородов:
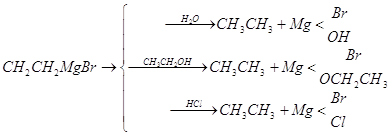
Исходя из этой реакции, Л. А. Чугаевым и Ф. В. Церевитиновым был разработан классический количественный газометрический метод определения подвижного водорода в органических соединениях (метод Чугаева—Церевитинова).
Магнийорганические соединения металлируют ацетилен и образуют дибромдимагнийацетилен (Ж. Иоцич):
![]()
Окисление магнийорганических соединений до спиртов:

Взаимодействие магнийорганических соединений с альдегидами, кетонами и сложными эфирами завершается синтезом первичных, вторичных и третичных спиртов.
Такой тип превращений магнийорганических соединений имеет наибольшее синтетическое значение преимущественно для получения третичных спиртов. В этом случае магний присоединяется к более электроотрицательному атому кислорода ![]() -группы, и образовавшиеся алкоголяты гидролизуются водой:
-группы, и образовавшиеся алкоголяты гидролизуются водой:
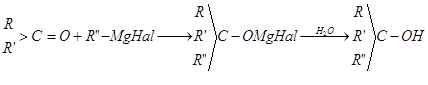 , где:
, где:
![]()
С помощью магнийорганических соединений можно получать также альдегиды, кетоны, кислоты. Магнийорганические соединения используются для синтеза элементоорганических соединений фосфора, кремния, ртути, бора, германия, олова.
Похожие работы
... соединение металлоорганический Вывод В работе были рассмотрены важнейшие способы получения алкилсиланов: · взаимодействие металлоорганических соединений с алкилхлорсиланами; · взаимодействие гидридов металлов с алкилхлорсиланами; · каталитическое диспропорционирование соединений, содержащих алкилгидридсилановый фрагмент; · гидрирование алкилхлорсиланов и тетраалкилсиланов. У ...
... (2,2,5,5-тетраметил-3-имидазолин-3-оксид-4-ил)фенилметанолу и 2,2,5,5-тетраметил-4-триэтилгермил-3-имидазолин-3-оксиду. Подобраны условия, позволяющие провести литиирование 5,5-диметилпирролин-1-оксида и последующую реакцию с электрофильными реагентами селективно по альдонитронной группе на фоне активной метиленовой группы. Реакция литиированного производного альдонитрона 1,2,2,5,5-пентаметил ...
... лабораторную практику принадлежит выдающемуся французскому химику В. Гриньяру. В 1900 г. он усовершенствовал метод синтеза, предложив разделить реакцию на две стадии: 1 - образование смешанного магнийорганического соединения в эфирной среде: RX + Mg → RMgX, где R - углеводородный радикал, а Х - галоген; 2 - взаимодействие RMgX с соединением, содержащим карбонильную группу, приводит к ...
... информационной плотности, что весьма важно для развития современных технических средств записи, накопления и хранения информации. 7. Важнейшие открытия в химии XXI века 2001 Уильям Ноулз, Риоджи Нойори и Барри Шарплесс «За исследования, используемые в фармацевтической промышленности - создание хиральных катализаторов окислительно-восстановительных реакций». 2002 Джон Фенн и Койчи Танака «За ...


0 комментариев