Навигация
Подтверждено дериватофафическим анализом
Электропроводность ТЭЛ определяли методом переменного тока. Ее значения возрастали с 1,2 при увеличении температуры от 20 до 60°С При этом элекфонная составляющая проводимости менялась с 6,010 до 1,Г108 См см»1. Интервал потенциалов стабильного состояния ТЭЛ в анодной области, со-гласно потенциодинамическим исследованиям с использованием блокирующего электрода из пирофафита, составляет 4,1 В при 20» С и 3.6 В при 60»С (относительно литиевого электрода сравнения). Разложение ГЭЛ сопровождается выделением молекулярного йода.
Рассчитанная кажущаяся энергия активации электропроводности ТЭЛ составила 0,48 еВ, что согласуется с литературными данными. Полученные значения электропроводности в целом коррелируют с величинами, рассчитанными амперным характеристикам модельной системы Li/LisNJj/Li Исследование, системы гальваностатическим методом позволило установить, что синтезированный электролит без значительных омических потерь (менее 120 мВ) способен пропускать токи более говорить о перспективности Li5NJ2 в качестве ТЭЛ для электрохимических систем различного .назначения.
Значения бестоковых потенциалов электродов на границе с U5NI2, приведенные в табл. 1 относительно Li электрода сравнения, показывают, что снижение содержания лития в составе СВГ приводит к смещению потенциала электрода в положительную сторону, одновременно увеличивается его температурный коэффициент. Соединения C4Li и Сб1л потенциально могут быть использованы в качестве анодов. Однако лишь разряд C4Li протекает с достаточными токами (100 - 150 мкА/см2) с незначительной поляризацией (до 100-110 мВ). C6Li окисляется с невысокими скоростями и с поляризуемостью электрода в 3-5 раз выше, чем литиевый анод. Повторный заряд обоих электродов, согласно вольтамперным характеристикам, протекает практически одинаково, со значительно меньшими токами и с более высоким перенапряжением, по сравнению с литием. С одной стороны, это указывает на невозможность получения C4Li электрохимическим внедрением, с другой - позволяет заключить, что на данном этапе исследований использование СВГ с литием в качестве анодов исследуемой системы менее эффекгивно, чем чистого металла.
Таблица 1.
Значения бестокового потенциала Е и его температурного коэффициента ДЕ/At для LiCx/Li5NJ2 при 25СС (относительно литиевого электрода сравнения).
| Состав активного материала электрода | Li | C4Li | C6Li | C,2Li | С |
| Е,В | 0 | 0,027 | 0,133 | 0,180 | 2,794 |
| ДЕ/At, мВ/град | -0,534 | -0,533 | 0,166 | 0,245 | 0,786 |
Результаты исследований ряда СВГ с хлоридами металлов в качестве катодов сведены в табл. 2. Согласно гальваностатическим измерениям, все соединения электрохимически обратимы, их разряд сопровождается внедрением катионов Li+ в структуру СВГ, а заряд - соответственно процессами деинтеркалации:
Таблица 2. Разрядные характеристики систем Li/ LisNJj/CBF
| Т | Соединения внедрения гр - а | ||||
| dCtiCif | 0,1*е4, | CwKnCIj | MHCtS | ||
| НРЦ. в | 25 | 3.1(1 | 2,89 | 3,00 | 3.02 |
| ГЦ в при I 20 мкА/см» | 40 0 75 | 1,08 1,82 2.04 | 2,11 2,52 2,81 | 2,10 2,32 2,51 | 2.12 2,31 2,43 |
| i мкА/см | 20 40 60 | 60 91 230 | 77 208' 812 | 67 IDS 160 | 63 120 252 |
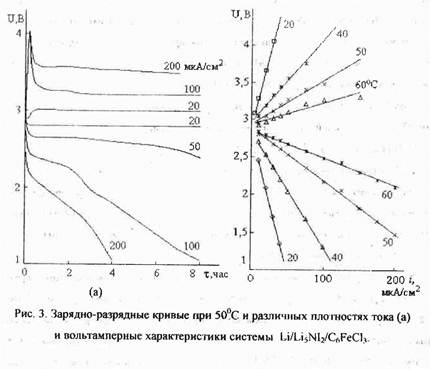
Наилучшие результаты получены для электрода Q.FeCb (рис.3), обеспечивающего разрядные токи до 200-250 мкА/см2 при среднем напряжении порядка 1,9-1,7 В. При разряде до 1 В токами, не превышающими 100 мкА/см2 катод работает с коэффициентом использования и циклируемостью. Близкими к 100 %. При увеличении тока К снижается до 30-40 % из-за диффузионных затруднений.
Макетные испытании при 20ч - 60 ( с сообщением 5-ИО зарядно-разрядных циклон покачали перспективность применения системы Li/[JsNI2/(JeCli в качестве перезаряжаемого твердоэлеюролишого ХИТ.
Глава 5 посвящена разработке методики синтеза новых ТЭЛ на основе комплексных соединений цинка, изучению их свойств и оценке возможности практического применения
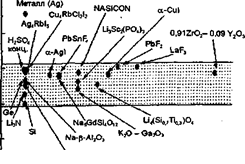
Поиск новых твердофазных ионопроводящих структур обусловлен не только стремлением упростить сложные технологии получения известных 1 ЭЛ, но и необходимостью формирования надежного контакта между электролитом и реагентами, что достижимо при использовании пластичных, прессуемых соединений. Кроме того, проводимость известных ТЭЛ в основном определяется подвижностью одного вида ионов, что ограничивает выбор анодных и катодных реагентов. Участие в ионном переносе ряда ионов может значительно упростить выбор электродных материалов и расширить потенциальные возможности электрохимических систем с ТЭЛ. Основой подобных электролитов, удовлетворяющих сформулированным требованиям, могут служить комплексные соединения цинка В литературе отсутствуют достаточные сведения о синтезе соединений состава Me2[Znr2(OH)2], где Ме - Li, К, Na, а Г - С1, Вт, I, не описано и их применение в качестве ГЭЛ.
В основу синтеза заложена реакция нейтрализации кислого раствора соли щелочью при точном поддержании рН реакции:
H2[Znr2(OH)2] + 2МеОН -» Me[Znr2(OH)2]4, + 2Н20 (4)
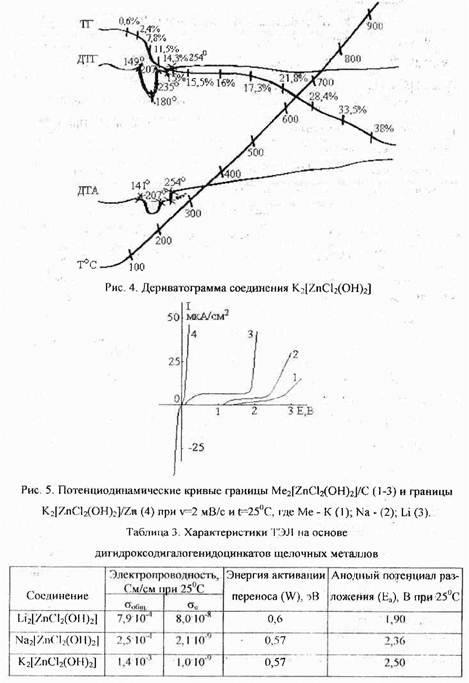
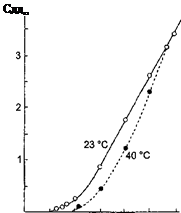
По разработанной методике получены 9 соединений (различные комбинации Me и Г), состав которых подтвержден дериватографическим, рентгенофазовым и химическим анализами Например, для соединения K2[ZnCl2(OH)2] согласно ДТА (рис. 4) убыль массы образца соответствует стехиометрическим потерям кристаллизационной воды в анализируемом веществе.
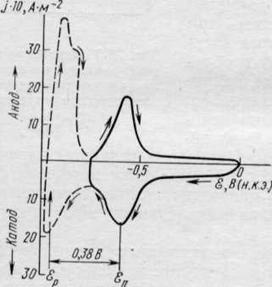
Исследование синтезированных соединений методами переменного тока, хроновольтамперометрией с блокирующим электродом из пирографита (рис.5) и потенциостатического включения для систем Zn/Me[Znr2(OH)2]/Zn при различных температурах показало, что свойства твердого электролита наиболее сильно проявляются у хлоридных комплексов цинка (табл. .3) Бромидные и иодидные комплексы имеют меньшую электропроводность и стабильность. Согласно данным табл. 3 и рис 5, наибольшими потенциалом анодного разложения и электропроводностью, одновременно с меньшей долей электронной проводимости обладает соединение K2[ZnCl2(OH)2] (табл.3, рис.5). Па границе с ТЭЛ этого состава цинковый электрод работает обратимо с невысокой поляризуемостью (рис. 5, кривая 4, табл. 4). Экстраполяция значений реальных энергий активации на г = 0 дает А, = 51,1 кДж/моль (0,53 эВ) и Ак = 51,9 кДж/моль (0,54 эВ). Практическое равенство А указывает на электрохимическую обратимость цинкового электрода на границе с ТЭЛ состава K2[ZnCl2(OH)2]. Сопоставимые значения реальной энергии активации и энергии активации переноса (W, табл.3), с одной стороны, свидетельствуют о минимальных энергетических потерях при переходе катионов Zn2' через границу электролит - электрод, с другой, позволяют утверждать, что в системе Zn/K2[ZnCl2(OH)2]/Zn ионный перенос осуществляется преимущественно катионами цинка. Это подтверждается и образованием на катодах из различных материалов осадков металлического цинка с выходом по току, близким 1. единице.
Таблица 4 Кинетические параметры цинкового электрода на границе с K2Zn C2(OH)2
| Плотность тока | 20°С | зог | 40V | snV | |||||
| обмена мкА/см2 | п,52 | 1,05 | 1,58 | 2,6 | |||||
| Перенапряжение, В | ем | 0.2 | 0,3 | 0,4 | 0,5 | ||||
| Энергия активации, кДж/моль | К Ак | 44,5 | 41,4 | 349 | 29,2 | 27,6 | |||
| 38,2 | 43,9 | 44.5 | 38,2 | 31,2 | |||||
Замена в вышеприведенной системе одного цинкового электрода на натрий с последующим циклированием выявила возможность обратимого замещения Zn2 я составе ТЭЛ на катионы натрия. При этом электропроводность электролита снижается. По-видимому, это объясняется затрудненностью диффузии носителей заряда при замещении одного двухвалентного катиона на два одновалентных, а также возможными при этом структурными изменениями ТЭЛ. Оценка проводимости цинкатного Электролита по протону была осуществлена с применением модельной системы {C)Ni(OH)2/K2ZnCI2(OH)2/Zn. Обратимое окисление гидрата закиси никеля и образование гидридов цинка на цинковом противоэлектрод подтверждает наличие прогонной проводимости исследуемого ТЭЛ, и позволяет предположить, что перенос протонов через фазу электролита осуществляется по иному механизму, чем транспорт катионов металла. Электропроводность электролита, определенная, но омическому участку вольтамнернон характеристики исследуемой системы, составила 1,5-^2,210 ' См. Однако, в связи z тем, что диффузия Н' затруднена и в самом оксидно-никелевом электроде, полученное значение не может быть однозначно отнесено к протонной проводимости ТЭЛ. Селективная электропроводность цинкатных электролитов по различным катионам определяется материалом анода, то есть электродом, генерирующим положительные ионы. Полученные результаты указывают на своеобразие структуры синтезированных цинкатных ТЭЛ и имеют важное практическое и теоретическое значение Проведенные исследования в этом направлении носят предварительный оценочный характер.
Результаты исследований ряда соединений внедрения (табл.5) с цинковым и натриевым анодами показ, что катод из СиС12 работает обратимо, с постадийным восстановлением кап она интеркалата до меди. Для СВГ с хлоридом железа высокая циклируемость сохраняется в пределах перехода Fe' /Fe , более глубокое восстановление приводит к потере емкости электрода при последующем заряде.
Таблица 5. Электрические характеристики систем с твердым электролитом состава KZnCyOH.
| № п/п | Система | НРЦ, В | Ucp, в при i=50 мкА/см | 1к.„ мкА/см |
| ] | Zn/Q.FeCb | .1,65 | 1,35 | 938 |
| 2 | Zn/CsCuCI2 | 1*4» | 1,0 | 229 |
| 3 | n/CMMoCl | 1,47 | 1,1 | 260 |
| 4. | Ne/CsCuClj | 3,25 ; | 1.8 | 124 |
Таким образом, экспериментально подтверждена перспективность применения синтезированных соединений в качестве ТЭЛ химических источников тока и электрохимических приборов.
Основные выводы
1.Установлено, что сульфиды пятивалентной сурьмы на границе с А1 восстанавливаются по схеме: Sb3 —> Sb —> Sb —> Sb. Стабильное никилирование возможно лишь по последней стадии Более глубокому обратимому анодному окислению сурьмы препятствует образование Na2S.
2.Впервые показано, что электрохимическое восстановление соединения внедрения графита C5C11CI2 на границе с полиаиюминатом натрия протекает по механизму топохимических реакций с внедрением Na в структуру СВГ и образованием соединений состава CuCTNaCI и C5Cu2NaCI. Выявлены условия перезаряжаемое системы. Определены разрядные характеристики.
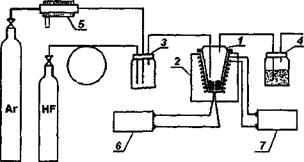
3.Отработана методика и изготовлено лабораторное оборудование для синтеза ТЭЛ состава U5NI2 с электропроводностью порядка 1.2-И,7 Ом»'см»1 (при 20-60 С). При этом электронная составляющая на 4-5 порядков ниже. Электролит стабилен при напряжениях, обеспечивающих работу перезаряжаемого литиевого анода.
4.Выявлено, что на границе Li-CBI7 LisNl2 устанавливаются высокие отрицательные значения бестоковых потенциалов. Однако кинетические характеристики таких электродов значительно ниже, по сравнению с металлическим литием. На основании сравнительного анализа ряда катодов из СВГ' с хлоридами металлов предложена система с СС электродом для перезаряжаемого источника тока.
5.Впервые предложена простая методика синтеза и получены соединения состава Me[Zn2(OH)2] с различным сочетанием щелочного металла (Li, К, Na) и галогена (CI, Вг, имеющие свойства ТЭЛ. Установлено, что из них наибольшей электропроводностью и анодным потенциалом разложения и наименьшей долей электронной проводимости обладает K2[ZnCl2(011)2] Показана возможность селективного ионного переноса но катионам Zn и прогону, а также возможность замещения в ТЭЛ катионов цинка на ионы натрия.
Проведена экспериментальная проверка работоспособности цинкатных ТЭЛ с цинковым и натриевым анодами и рядом катодов из соединений внедрения графита. Рекомендована для использования в ХИТ и электрохимических приборах система Zn/K2ZnCl2(OH)2/C6FeCl.
Основные положения и результаты диссертационной работы изложены в следующих публикациях:
1. А.С. №880206 (СССР). МКИ Н01М 6/18. Твердый электролит химического источника тока и способ его получения / Михайлова A.M., Краснов В.В., Ефанова В.В. Заявлено 23.06.80. (Для служебного пользования)
2. А.С. №1094539 (СССР). МКИ Н01М 6/18. Химический источник тока/ Краснов В.В, Михайлова A.M., Мирошниченко В.Ю. Заявлено 23.07.82.
3. Михайлова А.М, Краснов В.В. Поведение пористого полииодидного электрода в твердом электрод тлге RbAIs // Химические источники тока.- Саратов. - С.121-128.
4. Михайлова A.M., Ефанова В.В., Краснов В.В. Литиевый твердофазный химический источник тока. Электрохимическая энергетика. Тез. докл. II Всесоюзной научи, конф. - Москва, 19!!4.- С.43.
5. А.С. №1365909 (СССР). МКИ Н01М 6/18. Способ изготовления электрода сравнения / Шило В.И., Фабер О.Е., Краснов В:В., Тихонова Т.С. Заявлено 29.04.85. (Для служебного пользования)
6. Финаенов А.И., Краснов В.В., Новиков Ю.В., Квачева Л.Д., Ефремов Б.Н. Катодное восстановление слоистых соединений графита на основе хлоридов металлов в неводных электролитах // Тез. докл. VII Всесоюзной конф. по электрохимии.- Черновцы, 1988,-Т. 1.-С. 178.
7. А.С. №1545893 iCCCP). МКИ Н01М 6/18. Химический источник тока резервного типа/ Финаенов А.И., Попова С.С., Краснов В.В., Головина Н.Н., Авдеев В.В., Аким В.Я., Семененко К.Н. Заявлено 4.01.88. (Для служебного пользования).
8. А.С. №1616332 (СССР). МКИ HOIM 6/18. Электрод сравнения/Краснов
9. В.В., Финаенов А.И. Заявлено 9.01.88. (Для служебного пользования)
10. Финаенов А.И., Краснов В.В., Новиков Ю.В., Квачева Л.Д., Ефремов Б.Н. Влияние природы растворителя на электрохимическую активность слоистых соединений графита на основе хлоридов металлов // Химия и физика соединений внедрения. Тез. докл. Первой Всесоюзной конф
11. Красной В.В., Апостолов С П., Мопякина Л.А., Никольская И.В., Годунов И.А., Шкиров В.А. Положительное решение о выдаче патента на изобретение от 28.02.96. V/ 11. Патент. Россия. №2083-723 кл. С 01 В 31/04. Способ получения бисульфата графита и реактор для его осуществления / Финаенов А.И, Авдеев В.В., Апостолов СП., Краснов В.В., Монякина Л.А., Никольская И.В. Опубл. 10.07.97, Приоритет 28.04.95.
12. Краснов В.В., Финаенов А.И. Электрохимическое поведение СВГ на основе хлоридов металлов на границе с твердым электролитом // Современные электрохимические технологии. Тез. докл. юбил. научно-техиич. конф. - Саратов. 1996.- С.101.
13. Апостолов С.П., Финаенов А.И., Краснов В.В. Особенпосш электрохимического синтеза бисульфата графита // Современные электрохимические технологии. Тез. докл. юбил, научно-технич конф,- Саратов.- С. 102-103.
14. Апостолов С.П., Краснов В,В., Авдеев В.В., Финаенов А.И. Выбор условий электрохимического синте'за бисульфата графита // Изв. вузов. Химия и химическая технология,- 1997.- Т.40, №1.- С.113-117.
15. Апостолов С.П., Краснов В.В., Финаенов А.И. Электрохимический синтез гидросульфата графита в потенциосгатическом режиме// ЖПХ,- 1997.- Т.70, №4.-С.602-607.
16. Краснов В.В., Финаенов А.И., Попова СС, Чеботарева СА. Циклическая вольтамперометрия сурьмы и ее сульфидов на границе с рглиноземом // Тез. докл. Всероссийской конференции молодых ученых. Современные проблемы теоретической и экспериментальной химии,- Саратов, 1997- С.278-279.
17. Краснов В.В., Попова СС, Финаенов А.И., Чеботарева СА О способах формирования электрода сравнения в трехэлектродных ячейках с твердым электролитом/ Сарат. гос. техн. ун-т. Технол. ин-т.- Энгельс,- 12с.:Рус. Деп. в ВИНИТИ.
18. Краснов В.В., Финаенов А.И., Попова С.С, Шакирова СА. Новые соединения и электрохимические системы для химических источников тука с твердым электролитом // Тез. докл. Междунар. конф. «Композит»,- Саратов.- С. 125-126.
19. Заявка № 98105523/25(005544) (Россия). МКИ COIB3J./04 С25В 1/00. Реактор для электрохимического окисления графита/ Авдеев ВВ., Финаенов А.И., Апостолов СП,, Краснов В.В., Яковлев А.В., Сеземин В.А., Сорокина H.Ii., Гверезовская О.А., Никольская И.В., Мопякина Л,А. Положительное решение о выдаче патента на изобретение от 12.) 1.98.
|
|
Похожие работы
... постановка задачи, сформулированы ее цели, описывается научная и практическая значимость работы. В первой главе приводится анализ литературных данных по проблеме ионной и электронной эмиссии из твердых катионпроводящих электролитов и инжекции ионов в электродные материалы. Рассматриваются проблемы ионного транспорта в твердых электролитах и смешанных ионно-электронных проводниках. Во второй ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
... чаще всего к росту металлического перенапряжения. Значительное его повышение наблюдается в присутствии поверхностно-активных катионов типа тетразамещенного аммония. Высокая чувствительность процесса электроосаждения металлов к чистоте растворов указывает на то, что присутствие не только электролитов, но и любых веществ, особенно обладающих поверхностно-активными свойствами, должно играть здесь ...
... является промывная вода. Глава 4. Катодное поведение металлов и графита в разбавленных Cr-содержащих растворах. Повышение эффективности электрохимического способа очистки промывных и сточных вод от ионов Сг (VI) предусматривает изучение как анодных, так и катодных процессов в разбавленных хромсодержащих электролитах.Т. к. электровосстановление Сг (VI) на графитовом материале протекает легко, то ...
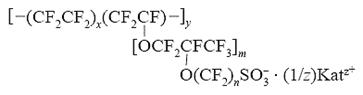

0 комментариев