Навигация
Осмос, осмотическое давление. Уравнение Вант-Гоффа и осмотический коэффициент
34. Осмос, осмотическое давление. Уравнение Вант-Гоффа и осмотический коэффициент.
Осмос – самопроизвольное движение молекул растворителя через полупроницаемую мембрану, разделяющую растворы разной концентрации, из раствора меньшей концентрации в раствор с более высокой концентрацией, что приводит к разбавлению последнего. В качестве полупроницаемой мембраны, через маленькие отверстия которой могут селективно проходить только небольшие по объему молекулы растворителя и задерживаются крупные или сольватированные молекулы или ионы, часто служит целлофановая пленка – для высокомолекулярных веществ, а для низкомолекулярных – пленка из ферроцианида меди. Процесс переноса растворителя (осмос) можно предотвратить, если на раствор с большей концентрацией оказать внешнее гидростатическое давление (в условиях равновесия это будет так называемое осмотическое давление, обозначаемое буквой ). Для расчета значения в растворах неэлектролитов используется эмпирическое уравнение Вант-Гоффа:
= C · R · T,
где С – моляльная концентрация вещества, моль/кг;
R – универсальная газовая постоянная, Дж/моль · К.
Величина осмотического давления пропорциональна числу молекул (в общем случае числу частиц) одного или нескольких веществ, растворенных в данном объеме раствора, и не зависит от их природы и природы растворителя. В растворах сильных или слабых электролитов общее число индивидуальных частиц увеличивается вследствие диссоциации молекул, поэтому в уравнение для расчета осмотического давления необходимо вводить соответствующий коэффициент пропорциональности, называемый изотоническим коэффициентом.
i · C · R · T,
где i – изотонический коэффициент, рассчитываемый как отношение суммы чисел ионов и непродиссоциировавших молекул электролита к начальному числу молекул этого вещества.
Так, если степень диссоциации электролита, т.е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, равна и молекула электролита распадается при этом на n ионов, то изотонический коэффициент рассчитывается следующим образом:
i = 1 + (n – 1) · ,(i > 1).
Для сильных электролитов можно принять = 1, тогда i = n, и коэффициент i (также больше 1) носит название осмотического коэффициента.
Явление осмоса имеет большое значение для растительных и животных организмов, поскольку оболочки их клеток по отношению к растворам многих веществ обладают свойствами полупроницаемой мембраны. В чистой воде клетка сильно набухает, в ряде случаев вплоть до разрыва оболочки, а в растворах с высокой концентрацией солей, наоборот, уменьшается в размерах и сморщивается из-за большой потери воды. Поэтому при консервировании пищевых продуктов к ним добавляется большое количество соли или сахара. Клетки микроорганизмов в таких условиях теряют значительное количество воды и гибнут.
Осмотическое давление обеспечивает движение воды в растениях за счет различия осмотических давлений между клеточным соком корней растений (5-20 бар) и почвенным раствором, дополнительно разбавляемом при поливе. Осмотическое давление обусловливает в растении подъем воды от корней до вершины. Таким образом, клетки листьев, теряя воду, осмотически всасывают ее из клеток стебля, а последние берут ее из клеток корня.
49. Рассчитать ЭДС медно-цинкового гальванического элемента, в котором концентрация ионов Сu 2 + равна 0,001 моль/л, а ионов Zn2+ 0,1 моль/л. При расчетах учтите стандартные значения ЭДС:
ε о (Zn 2+ /Zn 0) = – 0,74 В и ε о (Cu 2 + /Cu 0) = + 0,34 В.
Для расчета величины ЭДС используется уравнение Нернста 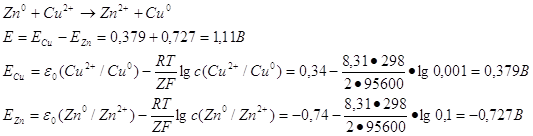
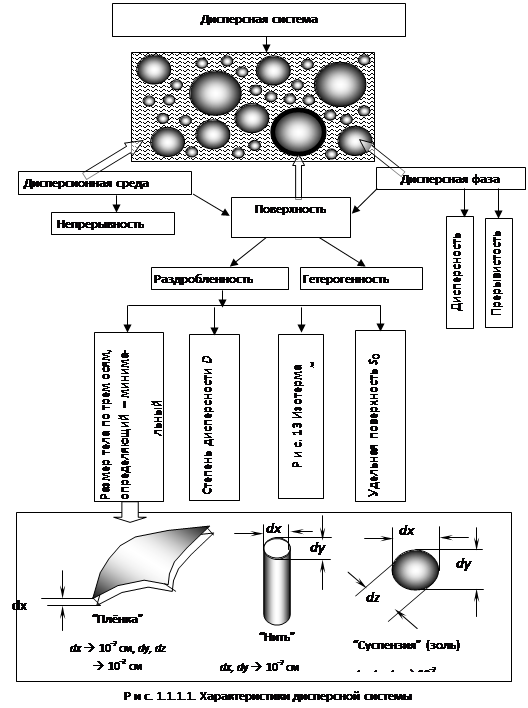
54. Методы получения дисперсных систем, их классификация и краткая характеристика. Какой метод получения дисперсных систем с термодинамической точки зрения наиболее выгоден?
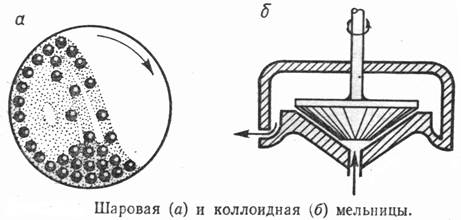
Метод диспергирования. Заключается в механическом дроблении твердых тел до заданной дисперсности; диспергирование ультразвуковыми колебаниями; электрическое диспергирование под действием переменного и постоянного тока. Для получения дисперсных систем методом диспергирования широко используют механические аппараты: дробилки, мельницы, ступки, вальцы, краскотерки, встряхиватели. Жидкости распыляются и разбрызгиваются с помощью форсунок, волчков, вращающихся дисков, центрифуг. Диспергирование газов осуществляют главным образом с помощью барботирования их через жидкость. В пенополимерах, пенобетоне, пеногипсе газы получают с помощью веществ, выделяющих газ при повышенной температуре или в химических реакциях.
Несмотря на широкое применение диспергационных методов, они не могут быть применимы для получения дисперсных систем с размером частиц -100 нм. Такие системы получают кондесационными методами.
В основе конденсационных методов лежит процесс образования дисперсной фазы из веществ, находящихся в молекулярном или ионном состоянии. Необходимое требование при этом методе – создание пересыщенного раствора, из которого должна быть получена коллоидная система. Этого можно достичь при определенных физических или химических условиях.
Физические методы конденсации:
1) охлаждение паров жидкостей или твердых тел при адиабатическом расширении или смешивании их с большим объемом воздуха;
2) постепенное удаление (выпаривание) из раствора растворителя или замена его другим растворителем, в котором диспергируемое вещество хуже растворяется.
Так, к физической конденсации относится конденсация водяного пара на поверхности находящихся в воздухе твердых или жидких частиц, ионов или заряженных молекул (туман, смог).
Замена растворителя приводит к образованию золя в тех случаях, когда к исходному раствору добавляют другую жидкость, которая хорошо смешивается с исходным растворителем, но является плохим растворителем для растворенного вещества.
Химические методы конденсации основаны на выполнении различных реакций, в результате которых из пересыщенного раствора осаждается нерастворенное вещество.
В основе химической конденсации могут лежать не только обменные, но и окислительно-восстановительные реакции, гидролиза и т.п.
Дисперсные системы можно также получить методом пептизации, который заключается в переводе в коллоидный «раствор» осадков, частицы которых уже имеют коллоидные размеры. Различают следующие виды пептизации: пептизацию промыванием осадка; пептизацию поверхностно – активными веществами; химическую пептизацию.
Например, свежеприготовленный и быстро промытый осадок гидроксида железа переходит в коллоидный раствор красно-бурого цвета от добавления небольшого количества раствора FeCl3 (адсорбционная пептизация) или HCl (диссолюция).
Механизм образования коллоидных частиц по методу пептизации изучен довольно полно: происходит химическое взаимодействие частиц на поверхности по схеме:
![]()
Далее агрегат ![]() адсорбирует ионы Fe+3 или FeO+, последующие образуются в результате гидролиза FeCl3 и ядро мицеллы получает положительный заряд. Формулу мицеллы можно записать в виде:
адсорбирует ионы Fe+3 или FeO+, последующие образуются в результате гидролиза FeCl3 и ядро мицеллы получает положительный заряд. Формулу мицеллы можно записать в виде:
![]()
или
![]()
С точки зрения термодинамики, наиболее выгодным является метод диспергирования.
69. Рассчитать величину среднеквадратичного смещения частицы гидрозоля с радиусом частиц 10-6 м за 5 с при температуре 283 К и вязкости дисперсионной среды 1,7·10-7 Па·с.
Решение.
1) Коэффициент диффузии для сферической частицы рассчитывается по уравнению Эйнштейна:
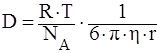 ,
,
где NА – число Авогадро, 6 10 23 молекул/моль;
h – вязкость дисперсионной среды, Н · с/м2 (Па · с);
r – радиус частицы, м;
R – универсальная газовая постоянная, 8,314 Дж/моль · К;
T – абсолютная температура, К;
число 3,14.
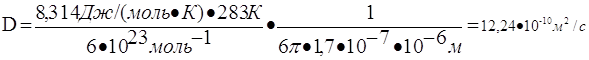
2) Среднее квадратичное смещение:
![]() ·D·
·D·
где ![]() среднее квадратичное смещение (усредненная величина сдвига) дисперсной частицы, м2;
среднее квадратичное смещение (усредненная величина сдвига) дисперсной частицы, м2;
время, за которое происходит смещение частицы (продолжительность диффузии), с;
D коэффициент диффузии, м2 . с-1.
![]() ·D·=2*12,24*10-10*5=12,24*10-9 м2
·D·=2*12,24*10-10*5=12,24*10-9 м2
Ответ: ![]() 12,24*10-9 м2.
12,24*10-9 м2.
Похожие работы
... 103 [1/см] (рис. 1.1.1.3); б) микрогетерогенные системы, для них D = 103 - 105 [1/см]; в) ультрамикрогетерогенные системы, для них D = 105 - 107 [1/см]. 2. По агрегатному состоянию дисперсной фазы и дисперсионной среды. Эта классификация была предложена Оствальдом (см. табл. 1.1.1.1). 3. По структуре дисперсные системы различают: 1) свободные дисперсные системы, когда ...
... , чтобы подчеркнуть, что дисперсной средой является жидкость. Если дисперсной средой является вода, то такие золи называют гидрозолями, а если органическая жидкость – органозолями. Дисперсные системы могут быть свободнодисперсными и связнодисперсными в зависимости от отсутствия или наличия взаимодействия между частицами дисперсной фазы. К свободнодисперсным системам относятся аэрозоли, ...
... , и мел осядет на дно стакана, жидкость станет прозрачной. Под действием силы тяжести частицы твердого вещества седиментируют. Это aw кое доказательство того, что наша система получилась Грубодисперсной. Получить дисперсную систему карбонат кальция-вода можно химическим способом: пропусканием углекислого газа через известковую воду (раствор гидроксид кальция). При этом раствор мутнеет. Полученная ...
... фазы от молекул другой фазы. Адгезия сопровождается уменьшением поверхностной энергии (при совмещении разных фаз энергия Гиббса системы уменьшается на величину работы адгезии): Wc = - DG. Для общего описания дисперсных систем обычно используют понятие дисперсность, характерезующее степень измельченности дисперсной фазы. Дисперсность выражается ...



0 комментариев