Навигация
Изучение эффективности действия различных фильтрующих загрузок в процессе обезжелезивания воды
1. Изучение эффективности действия различных фильтрующих загрузок в процессе обезжелезивания воды
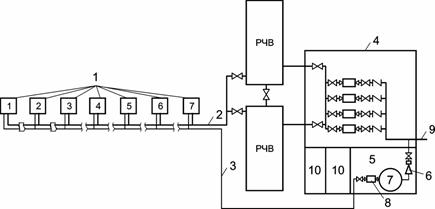
Для создания простейшей установки обезжелезивания воды мы выбрали метод фильтрования через фильтрующую загрузку с каталитическим действием.
Пробные опыты проводили в малом масштабе, используя в качестве емкости для фильтрования капельные воронки объемом 50 мл. Объем фильтрующей загрузки составлял 30 мл. Рабочим раствором являлся 0,0005 М раствор соли Мора, который готовили непосредственно перед экспериментом во избежание окисления железа кислородом воздуха (методика приготовления раствора дана в приложении 1). Раствор имел кислотность рН ~ 4-5 и содержал 28 мг/л Fe2+, что примерно в 100 раз превышает ПДК (в питьевой воде ПДК 0,3 мг/л) и примерно в 10 раз выше содержания железа в подземных источниках (см. таблицу 1).
Наличие двух- и трехвалентного железа в воде после фильтрования определяли с помощью капельного анализа (методика анализа дана в приложении 2).
а) Получение марганцевого катализатора
Для получения фильтрующей загрузки с каталитическим действием надо было выбрать способ формирования каталитического слоя на носителе. В литературе [8] предлагаются следующие реакции для получения марганец(IV) оксида: t
Mn(NO3)2 → MnO2 + 2NO2↑ (6)
2KMnO4 + 3C2H5OH → 2MnO2 + 2H2O + 2KOH + 3CH3CHO (7)
2KMnO4 + 3 MnSO4 + 2H2O → 2MnO2 + K2SO4 + 2H2SO4 (8)
Первая реакция - разложение марганец(II) нитрата (уравнение 6) - проводится при сильном нагревании и сопровождается выделением токсичного газообразного оксида азота(IV), по этим причинам использование ее в бытовых условиях неприемлемо. Во второй реакции - окисление этанола - также образуется токсичный продукт ацетальдегид (уравнение 7). Кроме того, мы учитывали, что использование этилового спирта для очистки воды может вызвать непонимание у рядового потребителя.
Таким образом, наиболее приемлемым способом получения является взаимодействие между перманганатом калия и солями двухвалентного марганца (например, уравнение 8).
б) Загрузка на основе катионита
По литературным данным [11] марганцевый катализатор окисления можно приготовить на основе любого катионита в Mn2+-форме, пропуская через него раствор перманганата калия. Мы испытали в качестве первой фильтрующей загрузки полистирольный сульфокатионит КУ-2-8 , который был в школьной лаборатории.
Обменная емкость катионита составляет 1,65 мэкв/мл [5]. Теоретически за счет ионного обмена порция объемом 30 мл может поглотить 1386 мг железа.
m(Fe2+) = 1,65 мэкв/мл · 30 мл · 28 мг/мэкв = 1386 мг
Такая масса железа содержится в 49,5 литрах нашего рабочего раствора. Нас интересовало, целесообразно ли использовать катионит в качестве носителя катализатора, или лучше использовать его по прямому назначению, то есть для ионообменного извлечения катионов металлов из воды.
Для формирования каталитического слоя мы обработали катионит следующим образом: пропустили через него 3-кратный объем 1 М раствора MnCl2 (перевели в Mn2+-форму),затем пропустили такой же объем 0,5%-ного раствора перманганата калия и промыли водой (4 раза по 50 мл). В результате поверхность катионита покрылась слоем оксида марганца, на котором должно было происходить ускоренное окисление содержащегося в воде железа и удерживание его в фильтрующем слое в виде осадка Fe(OH)3.
еоретически возможное количество марганец(IV) оксида на поверхности катионита составляло:
m(MnO2) = 1,65 мэкв/мл · 30 мл · 87 мг/мэкв :2 = 2153 мг
Через модифицированный катионит мы пропустили 6,5 литров воды до проскока трехвалентного железа (см. таблицу 2). Количество выходящего трехвалентного железа постепенно увеличивалось. Двухвалентное железо обнаружилось несколько позже, что, скорее всего, объясняется более низкой чувствительностью капельного анализа на Fe2+ (см. приложение 2).
Таким образом, на катионите, модифицированном марганцевым катализатором, удалось задержать 28 мг/л · 6,5 л = 182 мг железа, то есть в 7,6 раза меньше теоретически возможного ионообменного поглощения.
В конце опыта поверхность катионита покрылась рыхлым черным слоем. Окислительная способность пленки иссякла, скорее всего, за счет блокирования активной поверхности в результате адсорбции соединений железа.
Описанная в литературе [11] методика регенерации каталитического слоя путем промывки 0,1%-ным раствором перманганата калия не привела к восстановлению реакционной способности нашего катионита, а наоборот ухудшила его действие (см. таблицу 2).
После проделанных опытов мы пришли к следующему выводу:
использование катионита как носителя каталитического слоя нецелесообразно, так как, во-первых, не удается регенерировать катализатор;
во-вторых, объем очищенной воды оказался значительно ниже, чем расчетное количество для ионообменного поглощения; в-третьих, катионит – это специальное вещество, малодоступное населению, а нам хотелось сделать установку из веществ, доступных рядовому потребителю.
Таблица 2. Очистка воды путем фильтрования через катионит с каталитическим слоем (объем загрузки 30 мл).
| Объем фильтрованной воды | Содержание Fe3+ в момент проскока | Содержание Fe2+ в момент проскока |
| 6,4 л 6,5 л 6,6 л 6,7 л | − ~ 0,3 мг/л ~ 0,5 мг/л ~ 1 мг/л | − − − − |
| После регенерации катализатора 0,1%-ным раствором KMnO4 | ||
| 0,1 л 0,2 л 0,3 л 0,4 л 0,5 л | ~ 1 мг/л ~ 2 мг/л ~ 3 мг/л ~ 3 мг/л ~ 5 мг/л | ≤ 3 мг/л ~ 4 мг/л ~ 5 мг/л ~ 5 мг/л ~ 6 мг/л |
в) Загрузки на основе песка
Основную часть наших опытов мы провели, используя в качестве фильтрующей загрузки обыкновенный силикатный строительный песок. Перед использованием песок тщательно отмывали от мелких частиц многократным взмучиванием и сливанием мутной воды. Затем песок сушили и просеивали через сито.
Для формирования слоя марганцевого катализатора первоначально мы испытали описанную в литературе [11,13] систему « восстановитель MnCl2 – окислитель KMnO4», а такжеготовый препарат MnO2.Затем стали искать замену хлориду марганца в реакции с марганцовкой, так как эту соль можно достать только в химической лаборатории. Основным критерием отбора вещества-восстановителя была его общедоступность, а также отсутствие психологического отторжения (химиофобии), так как это вещество должно использоваться населением в процессе очистки питьевой воды.
Из доступных веществ на роль восстановителя годятся железный купорос FeSO4 · 7H2O (продается в хозяйственных магазинах), этиловый спирт С2Н5ОН и аскорбиновая кислота С6Н8О6 (витамин С, продается в аптеке).
Мы решили, что использование железного купороса в процессе обезжелезивания воды вызовет психологическое отторжение у потребителей (хотя в литературе описана работа установки [9], в которой используется система « восстановитель FeSO4 – окислитель KMnO4»). В реакции окисления этилового спирта перманганатом калия образуется токсичный альдегид. В результате наш выбор остановился на аскорбиновой кислоте.
Окисление аскорбиновой кислоты перманганатом калия является многостадийным и сложным процессом [17] (см. приложение 7). Состав продуктов окисления зависит от условий реакции и количественного соотношения компонентов, но в любом случае они не токсичны для организма человека.
Мы проделали ряд опытов, чтобы подобрать оптимальное соотношение между компонентами окислительно-восстановительной реакции.
При избытке аскорбиновой кислоты происходит восстановление перманганата до двухвалентного марганца, при этом раствор мгновенно обесцвечивается. При недостатке восстановителя образуется красно-коричневый раствор K2MnO4.
Опытным путем мы установили, что для образования MnO2 надо взять растворы аскорбинки и марганцовки с одинаковой массовой долей, например, 0,5% или 1%, и смешать их в равных объемных отношениях.
Процесс окисления при этом можно описать следующей схемой:
2H+ + MnO4− + C6H8O6 → C6H6O6 + MnO2↓ + 2H2O (9)
аскорбиновая дегидроаскорбиновая
кислота кислота
Для формирования на поверхности песка слоя марганцевого катализатора были использованы различные технологические приемы:
1) последовательное пропускание растворов через фильтрующую загрузку;
2) тщательное смешивание сухого оксида марганца с песком;
3) смешивание фильтрующей загрузки со свежеполученной суспензией MnO2;
4) последовательное добавление растворов окислителя и восстановителя к песку с тщательным перемешиванием и отстаиванием.
При любом способе обработки песок сильно темнел и становился коричневым за счет образования слоя MnO2. При фильтровании воды по мере расходования оксида марганца песок осветлялся. В момент проскока в слое песка были видны лишь небольшие темные зоны. Удалению катализатора с носителя способствовала повышенная кислотность нашего рабочего раствора (рН ~ 4-5), а также то, что железо присутствовало в сульфатной форме, а не в карбонатной форме, как в большинстве подземных водоисточников.
В очищенной воде рН повышалось до 6, следовательно, часть кислоты тратилась на растворение восстановленных оксидов марганца.
Mn2O3 + 6H+ → 2Mn3+ + 3H2O (10)
или MnO + 2H+ → Mn2+ + H2O (11)
В таблице 3 представлены результаты опытов по использованию загрузок на основе песка для очистки воды от железа.
Из полученных данных следует, что технологические приемы формирования каталитического слоя не влияют на эффективность работы фильтрующих загрузок.
Объем очищенной воды зависит от количества оксида марганца, находящегося в фильтрующем слое. По нашей оценке в загрузках на основе песка объемом 30 мл содержалось примерно 300 мг MnO2, то есть в ~ 7 раз меньше, чем на катионите такого же объема, поэтому и объем воды, очищенной на песчаных фильтрах, был на порядок меньше, чем при использовании катионита.
Можно было бы сделать вывод о целесообразности применения в качестве фильтрующей загрузки чистого препарата MnO2, однако это вещество является мелкодисперсным порошком, и для использования его в качестве фильтрующей загрузки необходимо гранулирование оксида либо использование крупнодисперсного природного минерала (пиролюзит), чтобы скорость фильтрования была приемлемой для эксперимента.
Таблица 3. Очистка воды путем фильтрования через загрузки на основе силикатного песка.
| Фильтрующая загрузка объемом 30 мл | Объем фильтрованной воды до проскока Fe3+ | Объем фильтрованной воды до проскока Fe2+ |
| Чистый песок | − | 0,1 л |
| Песок, обработанный последовательно пропусканием растворов 1М MnCl2 и 0,5%-ным KMnO4 | 0,5 л | 0,6 л |
| Песок, содержащий 5% по объему оксида MnO2 | 0,65 л | 0,8 л |
| Песок, смешанный с суспензией MnO2, полученной из 10 мл этилового спирта и 10 мл 0,5%-ного раствора KMnO4 | 0,35 л | 0,5 л |
| Песок, смешанный с 20 мл 0,5%-ного раствора KMnO4 и 20 мл 0,5%-ного раствора аскорбиновой кислоты | 0,55 л | 0,65 л |
Наш рабочий раствор по составу не соответствовал белорусским природным железосодержащим водам, так как содержал сульфатное, а не гидрокарбонатное железо, имел повышенную кислотность и концентрацию железа на порядок выше, чем в подземных водозаборах. Тем не менее, определенный объем воды очищался очень качественно.
Логично сделать вывод, что, если раствор эффективно очищается от сульфатного железа, то от гидрокарбонатного он должен очищаться еще эффективнее [11,13]. Мы решили укрупнить масштаб эксперимента и проверить данный вывод на практике.
Похожие работы
... . Это является свидетельством того, что кольматаж скважин, имеющий место при эксплуатации установок обезжелезивания, сосредоточивается только в прифильтровой зоне и легко снимается при периодических обработках скважин. Выводы При проектировании и строительстве водозаборов с внутрипластовой очисткой воды от железа повышенные требования должны предъявляться к конструкции и качеству сооружаемых ...
... агрегатов, при этом происходят как физические, так и химические процессы. Патрон служит только опорным каскадом для фильтрующего слоя гидроксида железа. При обезжелезивании природных вод на патронных фильтрах .первой стадии процесса является фильтрование с постепенным закупориванием пор фильтрующей перегородки. Эта стадия заканчивается по достижении определенного соотношения объема твердых ...
... раз в год проводится химическая промывка мембранных аппаратов специальными кислотными и щелочными реагентами для удаления накопленных загрязнений. При конструировании систем очистки воды на основе метода ультрафильтрации основной задачей, встающей перед проектировщиком, является правильное определение продолжительности прямого фильтрования, а также частоты и интенсивности обратных промывок. Эти ...
... метода для обеззараживания природных и сточных вод. В их числе такие документы, как Методические указания МУ 2.1.4.719-98 "Санитарный надзор за применением ультрафиолетового излучения в технологии подготовки питьевой воды"; МУ 2.1.5.732-99 "Санитарно-эпидемиологический надзор за обеззараживанием сточных вод ультрафиолетовым излучением"; МУ 2.1.2.694-98 "Использование ультрафиолетового излучения ...
0 комментариев