Навигация
Приготовление и эксплуатация установки обезжелезивания воды
2. Приготовление и эксплуатация установки обезжелезивания воды
Предлагаемая нами установка по обезжелезиванию воды может использоваться в сельской местности, на даче, в походе, то есть, в тех случаях, когда необходима локальная очистка воды от избытка железа.
Необходимые вещества и материалы:
1) пустая 2-литровая пластиковая бутылка с пробкой;
2) марлевый тампон;
3) отмытый и просеянный песок – объем 0,5 л;
4) 2 пол-литровые банки или бутылки для приготовления растворов;
5) 1 пакетик перманганата калия, масса 5 г, цена – 80 рублей;
6) 2 пакетика аскорбиновой кислоты, масса 1 пакета 2,5 г, цена – 240 рублей.
7) палочка или ложка для перемешивания;
8) стакан для измерения объема растворов;
9) емкость для очищенной воды.
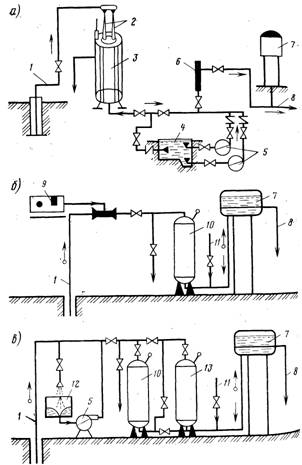
У пластиковой бутылки аккуратно отрезать дно на высоте примерно 4-5 см. Из отрезанного дна получается хорошая крышка от пыли. Чтобы она хорошо одевалась, надо сделать на основной части бутылки несколько вертикальных разрезов длиной примерно 1 см. В горлышко бутылки плотно вставить марлевый тампон.
Бутылку закрепить горлышком вниз с помощью проволоки или веревочной петли. Закрутить пробку, засыпать в бутылку пол-литра подготовленного песка.
Приготовить растворы. Для этого в одной банке растворить пакетик марганцовки в полулитре воды, а в другой – два пакетика аскорбиновой кислоты в таком же объеме воды.
Вылить в бутылку с песком стакан раствора марганцовки, перемешать палочкой для равномерного распределения раствора по всему объему. Добавить туда же стакан раствора аскорбиновой кислоты и сразу же еще раз перемешать. Оставить смесь на полчаса для формирования каталитического слоя. Песок должен приобрести темно-коричневую окраску.
Открыть пробку в нижней части бутылки, слить избыток жидкости до уровня песка. Залить в бутылку воду для очистки от железа. Система готова для фильтрования. Первый литр воды надо вылить, а последующие можно использовать для питья и приготовления пищи.
Признаком отработки катализатора (окончания его действия) является осветление песка, особенно в верхней части загрузки.
В этом случае надо слить воду до поверхности песка и регенерировать каталитический слой, то есть повторить обработку раствором марганцовки и аскорбиновой кислоты, при этом надо уменьшить объемы растворов вдвое (на полстакана раствора марганцовки – полстакана раствора аскорбиновой кислоты). После регенерации фильтрующую загрузку надо промыть 1 литром воды. После промывки установка готова к эксплуатации.
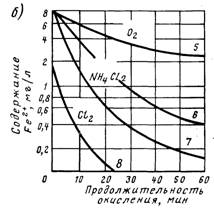
В таблице 4 представлены данные по работе нашей установки до и после регенерации каталитического слоя.
Таблица 4. Очистка воды путем фильтрования через песок с марганцевым катализатором (объем загрузки 500 мл).
| Объем фильтрованной воды | Содержание Fe3+ в момент проскока | Содержание Fe2+ в момент проскока |
| 8,0 л 8,5 л 9,0 л 9,5 л 10,0 л | − − − − − | − ≤ 3 мг/л ~ 5 мг/л ~ 7 мг/л ~ 10 мг/л |
| После регенерации катализатора | ||
| 7,0 л 7,5 л 8,0 л 8,5 л 9,0 л | − − − − − | − ≤ 3 мг/л ~ 4 мг/л ~ 4 мг/л ~ 7 мг/л |
3. Экономическая оценка предлагаемой нами установки обезжелезивания воды
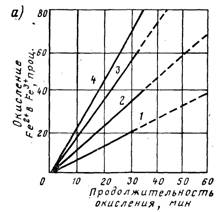
Из данных, представленных в таблице 4, следует, что наша установка за один цикл очищает примерно 7-8 литров воды, содержащей первоначально 28 мг/л двухвалентного железа. При фильтровании природной воды объем очищенной воды может существенно увеличиться, так как содержание железа в естественных источниках в несколько раз меньше (см. таблицу 1). Таким образом, при полученной продуктивности установки можно рассчитать ее себестоимость и сравнить ее с ценой фильтров, поступающих в продажу.
Суммарная стоимость реагентов для приготовления растворов равна:
80 руб.(5 г KMnO4) + 240 руб.(2,5 г С6Н8О6) + 240 руб.(2,5г С6Н8О6)= 560 руб.
Этого количества хватает на три цикла, то есть примерно для получения 25 литров воды. В настоящее время один из самых дешевых фильтров в Центральном универмаге г. Минска стоит 20 тысяч 130 рублей (фильтр «Аквафор»). Его ресурс – 1000 литров воды. Расчет показывает, что для очистки 1000 литров нашего рабочего раствора на нашей установке надо израсходовать 22 тысячи рублей, для природной воды эта сумма может быть намного меньше. Следовательно, по экономической оценке наша установка может успешно конкурировать с фирменными фильтрами.
Выводы
Таким образом, в результате проделанной работы:
1) выбран способ обезжелезивания воды, наиболее приемлемый для воспроизведения в школьных и бытовых условиях;
2) отработана методика капельного анализа для определения наличия железа в очищенной воде;
3) изучена эффективность действия фильтрующих загрузок с марганцевым катализатором на основе катионита и силикатного песка;
4) изучена возможность формирования каталитического слоя на силикатном песке из веществ, доступных рядовому потребителю;
5) выработаны рекомендации для населения по приготовлению и эксплуатации простейшей установки обезжелезивания воды.
Список используемых источников информации
1. Аткинс Р. Биодобавки. Природная альтернатива лекарствам. ООО «Попурри», Минск, 2004.
2. Белянин Б.В., Эрих В.Н. Технический анализ нефтепродуктов и газа. Изд. «Химия», Ленинград, 1975.
3. Горбачев В.В., Горбачева В.Н. Витамины. Макро- и микроэлементы. Справочник. Книжный Дом Интерпрессервис, Минск, 2002.
4. Горошко Н.Н., Цобкало Ж.А., Ильина Н.И. Методические рекомендации по подготовке к практическому туру олимпиады по химии. Журнал «Хімія: праблемы выкладання», № 2, 2005.
5. Грищенко М., Квитинский А. Влияние сорбции метилоранжа на обменную емкость сульфокатионита. Научно-исследовательская работа по химии. СШ № 64, Минск, 2002 г.
6. Казьмин В. Йод и железо для вашего здоровья. Изд. БАРОпресс, Ростов-на-Дону, 2005.
7. Какова ситуация с питьевой водой в Беларуси в целом? Журнал «Вода», июнь, 2004.
8. Карякин Ю.В., Ангелов И.И. Чистые химические вещества, «Химия», Москва, 1974 г.
9. Ковалев А.Я.. Еще раз об обезжелезивании воды. Журнал «Вода», сентябрь, 2003.
10. Ковалев А.Я. Обезжелезивание воды – что это? Журнал «Вода», июль, 2003.
11. Кульский Л.А. и др. Справочник по свойствам, методам анализа и очистке воды. Часть 2. Изд. «Наукова думка», Киев, 1980.
12. Моисеева Е. Глоток воды во время зноя летнего. Газета «Минский курьер», №195(707), 25.08.05.
13. Николадзе Г.И. Обезжелезивание природных и оборотных вод. Стройиздат, Москва, 1978.
14. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Изд. «Химия», Санкт-Петербург, 1994.
15. Самойлов И.В. Как очистить воду. Изд. «Феникс», Ростов-на-Дону, 2000.
16. Фильтры разные нужны. Газета «Комсомольская правда в Беларуси», 28 сентября 2005 г.
17. Химическая энциклопедия, том 1. Изд. «Советская энциклопедия», Москва, 1988.
Приложение 1
Методика приготовления рабочего раствора [12]
Для приготовления 0,1 М раствора надо в раствор 50 мл концентрированной серной кислоты в 200 мл воды внести 40 г соли Мора Fe(NH4)2(SO4)2·6H2O, после растворения разбавить водой до 1 литра.
Для приготовления 0,0005 М раствора (рабочий раствор) надо отмерить пипеткой 5 мл 0,1 М раствора и разбавить водой до 1 литра.
Приложение 2
Методика количественного определения концентрации раствора Fe3+ [14]
Определение с(Fe3+) основывалось на нахождении количества свободного йода, выделяемого при окислении ионами железа (III) йодид-ионов:
FeCl3 + KI = KCl + FeCl2 + 1/2I2, или
Fe3+ + I- = Fe2+ + 1/2I2
с помощью раствора тиосульфата натрия:
Na2S2O3 + 1/2I2 = 1/2Na2S4O6 + NaI, или
S2O32- + 1/2I2 = 1/2S4O62- + I-.
Расчет концентрации с(Fe3+) производился по формуле:
с(Fe3+) = с(Na2S2O3) · Vср(Na2S2O3)/ V(Fe3+),
где Vср – среднее арифметическое из трех параллельных измерений.
Перед началом анализа необходимо было стандартизировать раствор тиосульфата по приготовленному из фиксанала раствору дихромата калия, то есть надо было определить с помощью данного раствора тиосульфата количество свободного йода, выделяемого при окислении йодид-ионов стандартным раствором дихромата калия. c(K2Cr2O7) равна 0,01667моль/л.
K2Cr2O7 + KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Расчет концентрации с(Na2S2O3) производился по формуле:
с(Na2S2O3) = 6 · c(K2Cr2O7) · V (K2Cr2O7)/ Vср(Na2S2O3),
где Vср – среднее арифметическое из трех параллельных измерений.
Экспериментальные данные
Анализ тиосульфата натрия.
Реагенты: 0,05 М раствор H2SO4, 5%-ный раствор KI, 0,01667 М раствор K2Cr2O7, 0,5% раствор крахмала, ~ 0,02 М раствор Na2S2O3.
Ход анализа: В колбу для титрования внести 10 мл раствора серной кислоты, затем 5 мл раствора KI и 2 мл раствора K2Cr2O7. Колбу поместить в темное место на несколько минут до окончания реакции, а затем оттитровать тиосульфатом до обесцвечивания крахмала. (Крахмал добавлять, когда титруемый раствор станет бледно-желтым)
Наши результаты: 1 опыт – 10 мл раствора Na2S2O3
2 опыт – 10,1 мл раствора Na2S2O3
3 опыт – 10 мл раствора Na2S2O3
Vср(Na2S2O3) = 10 мл
Таким образом,
с(Na2S2O3) = 6 · 0,01667 · 0,002/0,01 = 0,02 моль/л.
Анализ сульфата железа(III).
Реагенты: 0,05 М раствор H2SO4, 5%-ный раствор KI, 0,001 М раствор Na2S2O3, 0,5% раствор крахмала, ~ 0,005 М раствор Fe2(SO4)3.
Ход анализа: В колбу для титрования внести 10 мл раствора серной кислоты, затем 5 мл раствора KI и 5 мл раствора Fe2(SO4)3. Колбу поместить в темное место на несколько минут до окончания реакции, а затем оттитровать тиосульфатом до обесцвечивания крахмала. (Крахмал добавлять, когда титруемый раствор станет бледно-желтым)
Наши результаты: 1 опыт – 43,4 мл раствора Na2S2O3
2 опыт – 43,0 мл раствора Na2S2O3
3 опыт – 43,8 мл раствора Na2S2O3
Vср(Na2S2O3) = 43,4 мл
Таким образом, с(Fe3+) = 0,001 · 0,0434/0,005 = 0,0087 моль/л.
Капельный анализ
Для определения концентрации железа в очищенной воде мы использовали капельный анализ на фарфоровых пластинках с углублениями.
Для проведения анализа необходимо было получить шкалу сравнения, то есть приготовить серию растворов с известной концентрацией Fe3+ и Fe2+.
а) Приготовление шкалы сравнения для анализа концентрации Fe3+[15]
Исходный раствор сульфата трехвалентного железа содержал 0,0087 моль/л Fe3+, то есть 487 мг/л ионов Fe3+. Для получения раствора, содержащего 10 мг/л Fe3+, надо взять 20,5 мл исходного раствора и разбавить водой до 1 литра. Для получения растворов меньшей концентрации надо взять соответственно: 7 мг/л - 14,4 мл 0,0087 М раствора и разбавить до 1 литра;
5 мг/л - 10,3 мл 0,0087 М раствора и разбавить до 1 литра;
3 мг/л - 6,2 мл 0,0087 М раствора и разбавить до 1 литра;
1 мг/л - 2,1 мл 0,0087 М раствора и разбавить до 1 литра;
0,5 мг/л - 100 мл раствора с концентрацией 5 мг/л и разбавить до 1 литра;
0,3 мг/л - 100 мл раствора с концентрацией 3 мг/л и разбавить до 1 литра;
0,1 мг/л - 100 мл раствора с концентрацией 1 мг/л и разбавить до 1 литра.
Для колориметрического определения трехвалентного железа в воде использовалась способность ионов Fe3+ образовывать в присутствии избытка роданида аммония (калия) ряд железородановых комплексов, начиная с [Fe(CNS)]2+ и кончая [Fe(CNS)6]3-. Эти комплексы придают раствору окраску от желтовато-розовой до красной в зависимости от концентрации железа в растворе. По интенсивности окраски можно сделать заключение о приближенном содержании количества железа в воде. Для капельного анализа использовался 50%-ный раствор КCNS.
Ход анализа концентрации Fe3+:
В углубление капельной пластинки вносится 2 капли исследуемого раствора и туда же добавляется 2 капли 50%-ного раствора КCNS. В соседние углубления капельной пластинки вносится по 2 капли растворов с известным содержанием железа, туда также добавляется раствор роданида калия. Путем сравнения интенсивности окрашивания делается вывод о содержании железа в воде.
Наша шкала сравнения для анализа содержания трехвалентного железа выглядела приблизительно таким образом:
~10 мг/л ~5 мг/л ~3 мг/л ~1 мг/л ~0,5 мг/л ≤ 0,3 мг/л
б) Приготовление шкалы сравнения для анализа концентрации Fe2+[15]
Исходный раствор соли Мора содержал 28 мг/л Fe2+. Для получения раствора, содержащего 20 мг/л Fe2+, надо взять 71,4 мл исходного раствора и разбавить водой до 100 мл. Для получения растворов меньшей концентрации надо взять соответственно:
15 мг/л - 53,6 мл исходного раствора и разбавить до 100 мл;
10 мг/л - 35,7 мл исходного раствора и разбавить до 100 мл;
7 мг/л - 25 мл исходного раствора и разбавить до 100 мл;
5 мг/л - 17,8 мл исходного раствора и разбавить до 100 мл;
4 мг/л - 14,3 мл исходного раствора и разбавить до 100 мл;
3 мг/л - 10,7 мл исходного раствора и разбавить до 100 мл;
1 мг/л - 3,6 мл исходного раствора и разбавить до 100 мл;
Для колориметрического определения двухвалентного железа в воде использовалась способность красной кровяной соли, гексацианоферрата(III) калия K3[Fe(CN)6], образовывать в присутствии ионов Fe2+ комплексное соединение темно-синего цвета – турнбулевую синь. Реакция является самой чувствительной на ионы Fe2+ и фармакопейной, однако она не позволяет определять двухвалентное железо на уровне ПДК 0,3 мг/л.
Гексацианоферрат(III) калия образует красно-коричневые кристаллы, переходящие при растирании в желтый порошок, легко растворяющийся в воде с зеленоватым окрашиванием жидкости. Для капельного анализа использовался 25%-ный раствор K3[Fe(CN)6].
Ход анализа концентрации Fe2+:
В углубление капельной пластинки вносится 2 капли исследуемого раствора и туда же добавляется 2 капли 25%-ного раствора K3[Fe(CN)6]. В соседние углубления капельной пластинки вносится по 2 капли растворов с известным содержанием железа, туда также добавляется раствор гексацианоферрата(III) калия. Путем сравнения интенсивности окрашивания делается вывод о содержании двухвалентного железа в воде.
Наша шкала сравнения для анализа содержания двухвалентного железа выглядела приблизительно таким образом:
![]()
![]()
![]()
![]()
![]()
![]() ~20 мг/л ~15мг/л ~10 мг/л ~7 мг/л ~3 мг/л ≤ 1 мг/л
~20 мг/л ~15мг/л ~10 мг/л ~7 мг/л ~3 мг/л ≤ 1 мг/л
Схема окисления аскорбиновой кислоты
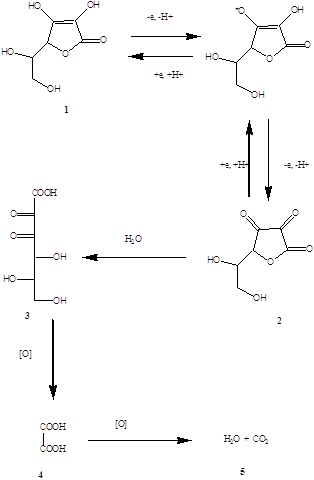
Аскорбиновая кислота (формула 1) – восстановитель. В водных растворах окисляется обратимо до дегидроаскорбиновой кислоты (формула 2) и далее необратимо до 2,3-дикетогулоновой (формула 3), а затем до щавелевой кислот (формула 4). В итоге щавелевая кислота окисляется до углекислого газа и воды.
В организме человека и животных аскорбиновая кислота проходит те же стадии превращения, что и при ее окислении.
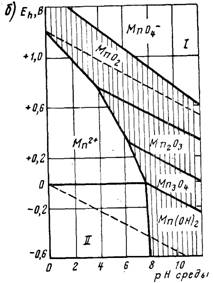
Схема восстановления перманганата калия
KMnO4 → K2MnO4 → MnO2 → Mn2O3 → MnO
Оксиды марганца MnO2, Mn2O3, MnO нерастворимы в воде. Оксид MnO обладает слабоосновными свойствами и в кислой среде образует соли Mn(II).
Оксид Mn2O3 под действием разбавленных серной или азотной кислот переходит в MnO2 и соль Mn(II).
Диоксид MnO2 - самое распространенное соединение марганца в природе (минерал пиролюзит). Активный MnO2, получаемый взаимодействием водных растворов MnSO4 и KMnO4, - окислитель в органической химии [16].
Марганец - важнейший микроэлемент
Марганец необходим для жизнедеятельности организмов. Недостаток марганца в организме человека может вызвать ряд заболеваний. Минимальная суточная доза составляет 4 мг, лечебная доза от 5 до 35 мг [1, 16].
Марганец – важный антиоксидант. Отмечена способность марганца защищать клетки от разрушительного воздействия избытка железа, порождающего огромное количество свободных радикалов. Марганец укрепляет ткани артерий, делая их более устойчивыми к образованию холестериновых атеросклеротических бляшек. Дефицит марганца вызывает повышенную вероятность развития рака и тенденцию к суицидальному поведению.
Прием марганца улучшает баланс глюкозы в крови сахарным диабетом. Будущим отцам марганец необходим для нормальной подвижности сперматозоидов. При недостатке марганца в организме беременных повышается вероятность аномалий развития плода, в том числе дефектов нервной трубки, из которой формируется нервная система ребенка. Для профилактики и лечения заболеваний костей марганец имеет не меньшее значение, чем кальций.
Марганец необходим для роста, размножения, заживления ран, максимально продуктивной работы мозга, а также нормального метаболизма сахаров, инсулина и холестерина. При отсутствии в организме оптимальных запасов этого микроэлемента повышается вероятность развития ревматоидного артрита, катаркты, множественного склероза и эпилепсии.
Недостаток марганца в почве приводит к его недостатку в продуктах питания. Еще одна причина недостатка марганца – прием железа и кальция, действующих как антагонисты марганца [1].
Образцы фильтрующих загрузок
Катионит КУ-2-8 Катионит КУ-2-8 после обработки с марганцевым раствором FeSO4 катализатором
Силикатный песок Силикатный песок без катализатора с марганцевым катализатором
Набор реагентов для приготовления установки обезжелезивания воды
1 пакет KMnO4, цена 80 рублей
Похожие работы
... . Это является свидетельством того, что кольматаж скважин, имеющий место при эксплуатации установок обезжелезивания, сосредоточивается только в прифильтровой зоне и легко снимается при периодических обработках скважин. Выводы При проектировании и строительстве водозаборов с внутрипластовой очисткой воды от железа повышенные требования должны предъявляться к конструкции и качеству сооружаемых ...
... агрегатов, при этом происходят как физические, так и химические процессы. Патрон служит только опорным каскадом для фильтрующего слоя гидроксида железа. При обезжелезивании природных вод на патронных фильтрах .первой стадии процесса является фильтрование с постепенным закупориванием пор фильтрующей перегородки. Эта стадия заканчивается по достижении определенного соотношения объема твердых ...
... раз в год проводится химическая промывка мембранных аппаратов специальными кислотными и щелочными реагентами для удаления накопленных загрязнений. При конструировании систем очистки воды на основе метода ультрафильтрации основной задачей, встающей перед проектировщиком, является правильное определение продолжительности прямого фильтрования, а также частоты и интенсивности обратных промывок. Эти ...
... метода для обеззараживания природных и сточных вод. В их числе такие документы, как Методические указания МУ 2.1.4.719-98 "Санитарный надзор за применением ультрафиолетового излучения в технологии подготовки питьевой воды"; МУ 2.1.5.732-99 "Санитарно-эпидемиологический надзор за обеззараживанием сточных вод ультрафиолетовым излучением"; МУ 2.1.2.694-98 "Использование ультрафиолетового излучения ...
0 комментариев