Навигация
Пакета аскорбиновой кислоты, цена 240 × 2 = 480 рублей
2 пакета аскорбиновой кислоты, цена 240 × 2 = 480 рублей
Приложение 3
Опыт по очистке природной воды
Для опыта использовалась вода из деревни Курганы Минского района.
Наличие железа в данной воде определялось с помощью капельного анализа. По нашей оценке первоначальное содержание двухвалентного железа составляло примерно 3 мг/л, а трехвалентного – примерно 0,5 мг/л.
Необходимые вещества и материалы:
1) пустая 1-литровая пластиковая бутылка с пробкой;
2) марлевый тампон;
3) отмытый и просеянный песок – объем 0,25 л;
4) 0,1 л 0,5%-ного раствора перманганата калия;
5) 0,1 л 0,5%-ного раствора аскорбиновой кислоты;
6) палочка для перемешивания;
7) мерный цилиндр для измерения объема очищенной воды;
8) фарфоровые пластинки для капельного анализа;
9) 50%-ный раствор калий роданида;
10) 25%-ный раствор гексацианоферрата(III) калия.
Описание опыта:
В специально подготовленную бутылку, закрепленную в кольце штатива, внесли 0,25 л песка, затем влили 0,1 л 0,5%-ного раствора перманганата калия, смесь перемешали, добавили 0,1 л 0,5%-ного раствора аскорбиновой кислоты, еще раз тщательно перемешали и оставили смесь на 30 минут для формирования каталитического слоя.
Через нижнее отверстие слили избыток жидкости, добавили дважды по 0,5 л воды для промывания загрузки.
После промывания загрузки начали очистку природной воды от железа. Скорость пропускания воды через установку составляла 1 л/час.
В нашем распоряжении было 2 л природной воды. Пробы очищенной воды для капельного анализа отбирали через каждые 0,25 л. С помощью капельного анализа железо в пробах не было обнаружено.
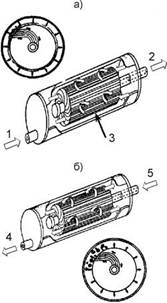
Вверху: фильтрующая загрузка на основе катионита;
внизу: фильтрующая загрузка на основе песка.
Приложение 4
Методика приготовления рабочего раствора [15]
Для приготовления 0,1 М раствора надо в раствор 50 мл концентрированной серной кислоты в 200 мл воды внести 40 г соли Мора Fe(NH4)2(SO4)2·6H2O, после растворения разбавить водой до 1 литра.
Для приготовления 0,0005 М раствора (рабочий раствор) надо отмерить пипеткой 5 мл 0,1 М раствора и разбавить водой до 1 литра.
Методика количественного определения концентрации раствора Fe3+ [4]
Определение с(Fe3+) основывалось на нахождении количества свободного йода, выделяемого при окислении ионами железа (III) йодид-ионов:
FeCl3 + KI = KCl + FeCl2 + 1/2I2, или
Fe3+ + I- = Fe2+ + 1/2I2
с помощью раствора тиосульфата натрия:
Na2S2O3 + 1/2I2 = 1/2Na2S4O6 + NaI, или
S2O32- + 1/2I2 = 1/2S4O62- + I-.
Расчет концентрации с(Fe3+) производился по формуле:
с(Fe3+) = с(Na2S2O3) · Vср(Na2S2O3)/ V(Fe3+),
где Vср – среднее арифметическое из трех параллельных измерений.
Перед началом анализа необходимо было стандартизировать раствор тиосульфата по приготовленному из фиксанала раствору дихромата калия, то есть надо было определить с помощью данного раствора тиосульфата количество свободного йода, выделяемого при окислении йодид-ионов стандартным раствором дихромата калия. c(K2Cr2O7) равна 0,01667моль/л.
K2Cr2O7 + KI + 7H2SO4 = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7H2O
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
Расчет концентрации с(Na2S2O3) производился по формуле:
с(Na2S2O3) = 6 · c(K2Cr2O7) · V (K2Cr2O7)/ Vср(Na2S2O3),
где Vср – среднее арифметическое из трех параллельных измерений.
Экспериментальные данные
Анализ тиосульфата натрия.
Реагенты: 0,05 М раствор H2SO4, 5%-ный раствор KI, 0,01667 М раствор K2Cr2O7, 0,5% раствор крахмала, ~ 0,02 М раствор Na2S2O3.
Ход анализа: В колбу для титрования внести 10 мл раствора серной кислоты, затем 5 мл раствора KI и 2 мл раствора K2Cr2O7. Колбу поместить в темное место на несколько минут до окончания реакции, а затем оттитровать тиосульфатом до обесцвечивания крахмала. (Крахмал добавлять, когда титруемый раствор станет бледно-желтым)
Наши результаты: 1 опыт – 10 мл раствора Na2S2O3
2 опыт – 10,1 мл раствора Na2S2O3
3 опыт – 10 мл раствора Na2S2O3
Vср(Na2S2O3) = 10 мл
Таким образом, с(Na2S2O3) = 6 · 0,01667 · 0,002/0,01 = 0,02 моль/л.
Анализ сульфата железа(III)
Реагенты: 0,05 М раствор H2SO4, 5%-ный раствор KI, 0,001 М раствор Na2S2O3, 0,5% раствор крахмала, ~ 0,005 М раствор Fe2(SO4)3.
Ход анализа: В колбу для титрования внести 10 мл раствора серной кислоты, затем 5 мл раствора KI и 5 мл раствора Fe2(SO4)3. Колбу поместить в темное место на несколько минут до окончания реакции, а затем оттитровать тиосульфатом до обесцвечивания крахмала. (Крахмал добавлять, когда титруемый раствор станет бледно-желтым)
Наши результаты: 1 опыт – 43,4 мл раствора Na2S2O3
2 опыт – 43,0 мл раствора Na2S2O3
3 опыт – 43,8 мл раствора Na2S2O3
Vср(Na2S2O3) = 43,4 мл
Таким образом, с(Fe3+) = 0,001 · 0,0434/0,005 = 0,0087 моль/л.
Похожие работы
... . Это является свидетельством того, что кольматаж скважин, имеющий место при эксплуатации установок обезжелезивания, сосредоточивается только в прифильтровой зоне и легко снимается при периодических обработках скважин. Выводы При проектировании и строительстве водозаборов с внутрипластовой очисткой воды от железа повышенные требования должны предъявляться к конструкции и качеству сооружаемых ...
... агрегатов, при этом происходят как физические, так и химические процессы. Патрон служит только опорным каскадом для фильтрующего слоя гидроксида железа. При обезжелезивании природных вод на патронных фильтрах .первой стадии процесса является фильтрование с постепенным закупориванием пор фильтрующей перегородки. Эта стадия заканчивается по достижении определенного соотношения объема твердых ...
... раз в год проводится химическая промывка мембранных аппаратов специальными кислотными и щелочными реагентами для удаления накопленных загрязнений. При конструировании систем очистки воды на основе метода ультрафильтрации основной задачей, встающей перед проектировщиком, является правильное определение продолжительности прямого фильтрования, а также частоты и интенсивности обратных промывок. Эти ...
... метода для обеззараживания природных и сточных вод. В их числе такие документы, как Методические указания МУ 2.1.4.719-98 "Санитарный надзор за применением ультрафиолетового излучения в технологии подготовки питьевой воды"; МУ 2.1.5.732-99 "Санитарно-эпидемиологический надзор за обеззараживанием сточных вод ультрафиолетовым излучением"; МУ 2.1.2.694-98 "Использование ультрафиолетового излучения ...
0 комментариев