Навигация
Cd(NO3)2 (нитрат кадмия) – применяется для окраски фарфора и стекла
2.4.4 Cd(NO3)2 (нитрат кадмия) – применяется для окраски фарфора и стекла.
Физические и химические свойства. – бесцветные кристаллы, Тпл 350˚С, плотность 2,455, растворимость в воде 142г/100г (15ºС), 682г/100г (100ºС).
2.4.5 CdCO3 (карбонат кадмия) – встречается в природе в виде минерала отавита. Применяется в стекловаренном производстве для получения сульфоселенида кадмия. Получается осаждением из растворов солей карбонатами щелочных металлов или аммония.
Физические и химические свойства. – белые кристаллы, разлагаються около 400˚С, плотность 4,258, в воде практически не растворим, растворим в кислотах.
2.4.6 CdSO4(сульфат кадмия) – применяется как сырье для получения металлического Сd и СdS; как компонент электролита для гальванического кадмирования и для нормального элемента Вестона. Получается растворением металлического Сd, СdO, Сd(ОН)2 или СdСО3 в H2SO4; окислением СdS кислородом.
Физические и химические свойства. – бесцветные кристаллы, Тпл 1000˚С, плотность 4,691, растворимость в воде 76,7г/100г (20ºС), 61г/100г (100ºС).
2.4.7 CdS (сульфид кадмия) – встречается в природе в виде минерала гринокита. Применяется как пигмент для красок; для окраски стекла, фарфора, резины и других материалов; в пиротехнике. Получается нагреванием смеси порошков Сd и S; действием Н2S на Сd или CdO; восстановлением СdSO4 окисью углерода или водородом.
Физические и химические свойства. – возгоняется при 1350˚С, плотность 4,8, не растворим в воде, щелочах, растворим в концентрированных HCl и HNO3.
2.5 ЦИНКСодержание цинка в земной коре 7·10-3%, встречается в природе в составе многих минералов (галмей, цинковая oбманка и др.). Применяется для получения сплавов с цветными металлами (латунь, томпак, нейзильбер); в производстве гальванических элементов и аккумуляторов для защиты стальных изделий от коррозии. Получается электролизом растворов солей цинка.
Физические свойства. Голубовато-серебристый металл. Тплавл. 419,5°; Ткип 906,2°; плотность 7,14; растворяется в кислотах и щелочах. Нижний предел взрывоопасной концентрации цинковой пыли в воздухе 480 г/м3, Твоспл. 600°.
ПДК в воде 1,0 мг/л, в воздухе рабочей зоны ZnO 0,5мг/м3, ВДД ZnСO3 2,0мг/м3, фосфатов и нитрата 0,5 мг/м3.
2.5.1 ZnO (окись цинка) – встречается в воздухе рабочих помещений в виде аэрозоля везде, где Zn нагрет выше температуры его плавления. Применяется в качестве белого пигмента для красок; в качестве наполнителя резины; в производстве стекла, керамики, спичек, целлулоида, типографских красок, зубного цемента, косметических средств; в гальванотехнике и текстильной промышленности. Получается прокаливанием ZnCO3; сжиганием металлического Zn.
Физические свойства. Белый кристаллический порошок, Твозг. 1800°; плотность 5,6; растворимость в воде 0,00016 г/100 г (20°). Растворяется в кислотах и щелочах.
ПДК для окиси цинка 0,5 мг/м3, для атмосферного воздуха 0,05мг/м3.
2.5.2 ZnCl2 (хлорид цинка) – применяется для консервирования древесины; в целлюлозно-бумажной промышленности; в производстве вискозных волокон, цинковых красок; в качестве флюса при горячем цинковании, лужении и паянии. Получается растворением цинковых отходов в соляной кислоте.
Физические свойства. Бесцветные гигроскопичные кристаллы. Тплавл. 315º;Ткип. 730°; плотность 2,91; растворимость в воде 375 г/100 г (20°).
ПДК для дыма хлорида цинка 1 мг/м3.
2.5.3 ZnSO4·7H2O (сульфат цинка, цинковый купорос) – применяется в производстве вискозы; в гальванотехнике; для приготовления минеральных красок; для консервирования древесины. Получается растворением цинковых отходов в серной кислоте.
Физические свойства. Бесцветные кристаллы, устойчивые до 38,8°. При более высоких температурах обезвоживается. Плотность 1,97; растворимость. в воде 165 г/100г (20°).
2.5.4 [CH3(CH2)16COO]2Zn (стеарат цинка) – применяется как свето- и термостабилизатор поливинилхлорида. Получается при взаимодействии стеариновой кислоты с Zn.
Физические свойства. Порошок, нерастворимый в воде и не смачиваемый ею. Растворяется в бензине, толуоле, скипидаре, диоктилфталате.
ПДК (США)=10 мг/м3.
2.5.5 Цинкалкилдитиофосфаты – применяются в виде добавок к нефтепродуктам как ингибиторы коррозии. Малотоксичные соединения.
2.6 ВОЛЬФРАМВольфрам мало распространен в природе, основной способ получения вольфрама – переработка вольфрамовых руд, которые содержат 0,15-0,5%WO3, или концентратов – 55-65%WO3. Встречается в природе в виде минералов вольфрамита и шеелита или входит в виде примеси в другие минералы. Применяется для получения сплавов(50%), легированных сталей 8-20% W, 35-45% для твердых сплавов на основе WС (95%) используемых в электротехнической, радиотехнической и рентгеновской аппаратуре. Получается обогащением вольфрамовых руд, переработкой концентратов в вольфрамовую кислоту или ее соли и восстановлением до металла.
Физические и химические свойства. Светло-серый твердый металл. Тплавл. 3410°; Ткип. 5930°; плотность 19,3; взаимодействует с кислородом выше 400°. В виде тонкодисперсного порошка проявляет пирофорные свойства.
2.6.1 WO2(окись вольфрама (IV)) – применяется в качестве катализатора. Получается восстановлением водородом WO3 при 600—650°; при нагревании выше 400° смеси порошкообразного W с WO3.
Физические и химические свойства. Порошок или кристаллы коричневого цвета. Тплавл. 1270°, Ткип. 1700°; плотность 12,11. При прокаливании на воздухе окисляется до WO3.
2.6.2 WO3(окись вольфрама (VI), вольфрамовый ангидрид) – применяется для получения металлического W и его соединений, карбидов, галогенидов, вольфраматов; как пигмент, для окрашивания керамических и стеклянных изделий; как катализатор при гидрогенизации и крекинге углеводородов. Получается прокаливанием вольфрамовой кислоты или ее солей, а также нагреванием W на воздухе выше 400°.
Физические и химические свойства. Порошок лимонно- или оранжево-желтого цвета. Тплавл. 1470°; плотность 7,16. Практически нерастворима в воде и кислотах (кроме HF).
2.6.3 H2WO4 (вольфрамовая кислота) – применяется в производстве W; как протрава и краситель в текстильной промышленности; как катализатор, адсорбент. Получается при действии сильных кислот на растворы вольфраматов щелочных металлов.
Физические и химические свойства. Желтый порошок. Плотность 5,5. Плохо растворяется в воде и кислотах (за исключением HF).
2.6.4 Na2WО4 (вольфрамат натрия) – применяется в виде кристаллогидрата Na2WО4·2H2O как протрава и краситель в текстильной промышленности; в производстве пигментов, устойчивых к действию света (фосфорно-вольфрамовые пигменты). Получается сплавлением WO3 с Na2CO3-или NaOH.
Физические свойства. Бесцветные кристаллы. Тплавл. 698°; плотность 4,18. Растворимость в воде 42,2% (20°), 49,2% (100°).
2.6.5 WCl6 (гексахлорид вольфрама) – применяется для нанесения покрытий на металлы. Получается взаимодействием порошкообразного W с сухим Cl2 при нагревании 500-800ºС.
Физические и химические свойства. Черно-фиолетовые кристаллы. Тплавл 275°; Ткип. 348°; плотность 3,52. Водой гидролизуется.
2.7 КОБАЛЬТСо – применяется в составе различных сплавов(65%); для изготовления сварочной проволоки; как катализаторы (10%): окисления NH3 в производстве НNО3; при гидрогенизации жиров и переработке масел, в качестве пигментов(10%). Получается сульфирующим обжигом кобальтсодержащего материала и другими пирометаллургическими методами. Кобальт переводят в раствор и отделяют от сопутствующих металлов, в том числе от никеля. В конечном итоге Co переходит в Со3О4, из которой получают металлический кобальт восстановлением (углем, водородом и др.) или алюмотермией, электролизом.
Физические и химические свойства. Твердый серебристый металл. Существуют две аллотропные модификации. Тплавл. 1492°; Ткип. 3100°; плотность 8,84. В воде практически нерастворим; растворяется в разбавленных НС1, H2SO4 и НNО3. В HF нерастворим. Со (III) весьма склонен к образованию комплексных соединений.
ПДК: сточные воды 1мг/л; питьевой 0,01 мг/л.
2.7.1 СоО (окись кобальта (II)) – применяется для производства катализаторов, как компонент твердых электролитов, пигментов. Получается нагреванием металлического кобальта на воздухе или прокаливанием Со(ОН)2 или СоСО3 без доступа воздуха.
Физические и химические свойства. Коричневые или оливково-зеленые кристаллы. Тплавл. 1935°; при 2800° разлагается с потерей кислорода. Растворимость в воде 0,313 мг/100 г; реагирует с кислотами.
2.7.2 Со3О4 (окись кобальта (II, III)) – применяется для производства катализаторов, для анализа, как компонент шихты для спецкерамики. Получается нагреванием выдержанного на воздухе СоО или прокаливанием Со2О3·Н2О.
Физические и химические свойства. Черные кристаллы. Плотность 6,07. При 900° разлагается, не доходя до плавления, теряя кислород и переходя в СоО. При более низких температурах поверхностно адсорбирует кислород до соотношения соответствующего Со2О3. Растворяется в расплавленном NaOH и в кипящем растворе Na2CO3. Не растворяется в НС1, НNО3 и царской водке. Реагирует с H2SO4.
2.7.3 Со2О3·Н2О (окись кобальта (III)) – применяется для производства катализаторов органического синтеза, в качестве пигмента, как адсорбент газовой хромотографии. Получается окислением окислов кобальта перекисями, бромом, перманганатом калия или осаждением щелочью из солей СО(III)
Физические свойства. Черный кристаллический порошок. При 300° обезвоживается с разложением и потерей кислорода. Растворимость. в воде за 30 суток 0,084 мг/100 г (37°).
2.7.4 CoSO4, CoSO4·7H2O (Сульфат кобальта) – применяется для получения кобальта; в стекольной и керамической промышленности в качестве пигмента. Получается: CoSО4 — окислением сульфида кобальта на воздухе или окиси кобальта в токе SO2; CoSO4 ·7Н2O – при взаимодействии окиси, гидроокиси или карбоната кобальта с H2SO4.
Физические свойства. CoSО4 — розовые гигроскопичные кристаллы. При 735º распадается на СоО и SО2. Плотность. 3,71 (25°); растворимость в воде 39,3 г/100 г (25°).
CoSO4·7H2O – карминно-красные кристаллы. Тплавл. 96,8º; плотность 1,948 (25°). При нагревании переходит в CoSO4·6H2O и CoSO4·H2O.
2.7.5 CoCl2, CoCl2·6H2O (хлорид кобальта) – применяется как протрава при крашении тканей, как катализатор, индикаторы влажности. Получается: CoCl2 — прокаливанием порошкообразного Со в атмосфере хлора или обезвоживанием гидратов; CoCl2·6H2O – растворением окислов, или карбоната кобальта в НС1.
Физические свойства. CoCl2—гигроскопичные блестящие голубые кристаллы. Тплавл.724°; Ткип. 1049°; плотность 3,356; растворимость в воде 52,9 г/100 г (20°). CoCl2·6H2O – розовые кристаллы. Плотность. 1,924.
2.7.6 СоСО3 (карбонат кобальта) – применяется для получения СоО и катализаторов. Физические свойства. Розовые кристаллы. При 400° начинает разлагаться. Плотность 4,13; растворимость в воде (под давлением СО2) 0,011 г/100 г (15°).
2.8 ОЛОВОСодержание олова в земной коре 8·10-3% масс., самородного не встречается, известно 16 минералов, одним из самых распространенных является касситерит (оловянный камень). Встречается олово в природе главным образом в виде минерала касситерита. Применяется для изготовления белой жести, припоев, бронзы, латуни, баббитов, типографских и легкоплавких сплавов, сплавов с титаном и другими металлами, фольги; для лужения; для приготовления зубных амальгам; как сырье для химикатов, для очистки металлургических газов от паров ртути. Получается восстановлением из соединений, образующихся при химической обработке концентратов касситерита.
Физические и химические свойства. Серебристо-белый металл. Один из естественных изотопов 124Sn слаборадиоактивен. Тплавл. 231,9°, Ткип. 2620°. Нижний предел взрывоопасной концентрации оловянной пыли в воздухе 190 г/м3. Устойчиво к кислороду воздуха. Реагирует с галогенами, S, SO3, H2S. Растворимо в минеральных кислотах и в щелочах.
2.8.1 SnO(окись олова (II)) - применяется для изготовления эмали для посуды и получения SnO2, как черный пигмент восстановитель в металлургии. Получается обработкой SnCl раствором щелочи и обезвоживанием выпавшего гидрата окиси при 110°. Разложением SnO2, гидроксида, оксолата,
Физические и химические свойства. Кристаллы. Тплавл. 1040°; Ткип. 1425°; плотность 6,45. Нагревание на воздухе ведет к окислению до SnO2, в вакууме происходит диспропорционирование до SnO2 и Sn.
ПДК – 0,05мг/м3.
2.8.2 SnO2(окись олова (IV)) – применяется для производства силикатных эмалей; глазурей; некоторых видов стекла (например, молочного); керамических изделий; как абразив для полировки мягких материалов. Получается окислением металлического олова при высокой температуре, реже – прокаливанием SnO2 ·nH2O или SnS; окислением SnO кислородом воздуха.
Физические и химические свойства. Белый порошок. Возгоняется при 1850°; плотность 7,04. Стойка к действию водных растворов кислот и щелочей.
ПДК – 0,05мг/м3.
2.8.3 SnCl2 (хлорид олова (II)) – применяется при синтезе органических красителей; в текстильной промышленности, как флюс при электросварке. Получается нагреванием Sn в токе газообразного НС1.
Физические и химические свойства. Белые кристаллы. Тплавл 247º, Ткип 652°; плотность 3,95 (25°). Растворимость в воде 83,9 г/100 г (0°), 269.8 г/100 г (15°). В водных растворах гидролизуется (дымит).
ПДК – 0,5мг/м3.
2.8.4 SnCl4 (хлорид олова (IV)) – применяется в текстильном производстве; как катализатор в синтезе красителей, для утяжеления шелка, обесцвечивания нефтяных масел. Получается действием Сl2 на Sn при высокой температуре. Растворением SnO2 в НС1 получают кристаллогидрат.
Физические и химические свойства. Бесцветная дымящая на воздухе жидкость (технический продукт обычно желтоватый). Тплавл. - 33°; Ткип. 114º, плотность 2,23. Хорошо растворяется в органических жидкостях. При растворении в воде гидролизуется до SnO2
Похожие работы
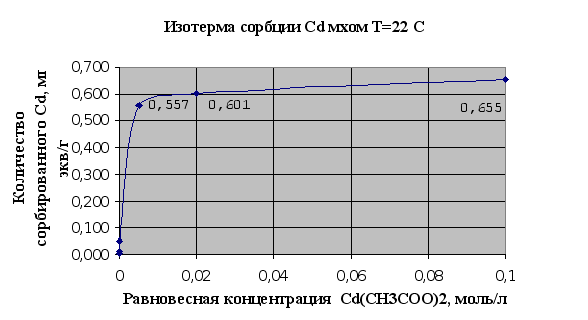
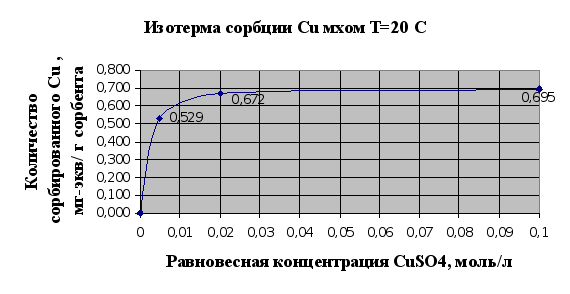
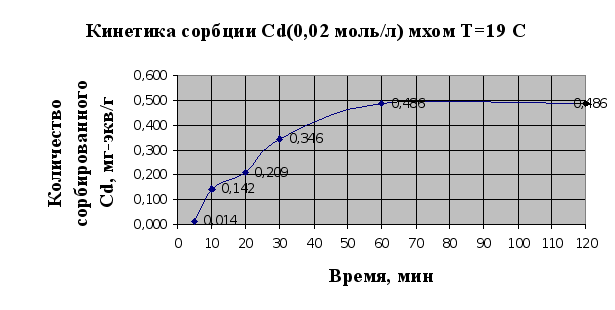
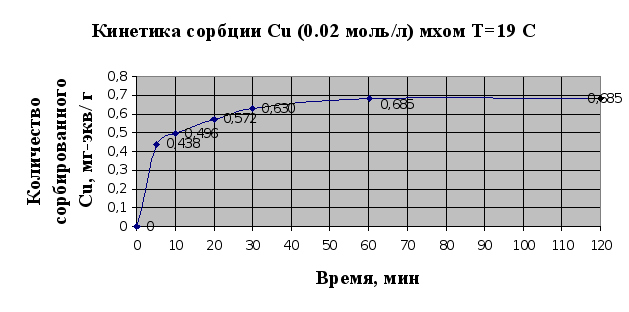
... Листов Пров. 1 2 Консульт. БГТУ 7140607 2004 Н. контр. Утв. Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой ...
... коробки противогаза на 45 г, после чего она уже непригодна. В случае резко повышенных концентрации применяют шланговые противогазы. Применяют также специальную одежду и перчатки. 2 Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды Ниже приведены основные сведения по нормированию содержания тяжелых металлов в воздухе, воде, почве, пищевых продуктах и кормах ...
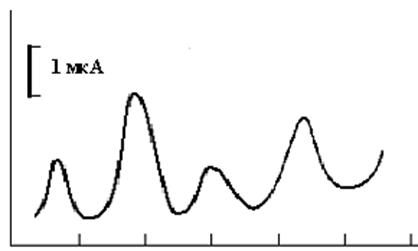
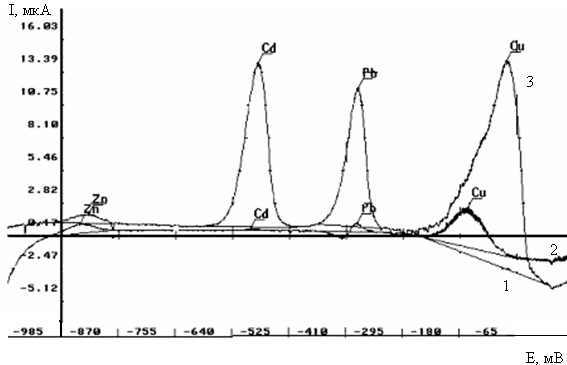
... повышения чувствительности определения мышьяка методом инверсионной вольамперометрии его обычно концентрируют на золотых и золото-графитовых электродах [28]. Работа посвящена разработке методики анализа воды на содержание мышьяка методом инверсионной вольтамперометрии с использованием золото-стеклоуглеродного электрода(ЗСУЭ), полученного методом «in situ»,что удешевляет анализ. Определены условия ...
... малая произрастает в большинстве стоячих водоемах по всей стране с разным уровнем загрязнения. Цель нашей работы следующая: Возможность использования ряски малой в качестве фиторемедиатора водоемов загрязнённых тяжелыми металлами и другими токсичными веществами. В работе были поставлены следующие задачи: 1. Возможность использование ряски малой для определения токсичности сточных вод и их ...


0 комментариев