Навигация
Hg(SCN)2 (роданид ртути (II)) – применяется в фотографии. Получается осаждением из разбавленных горячих водных растворов Hg(NO3)2 и NH4SCN
2.9.6 Hg(SCN)2 (роданид ртути (II)) – применяется в фотографии. Получается осаждением из разбавленных горячих водных растворов Hg(NO3)2 и NH4SCN.
Физические свойства. Бесцветные кристаллы. Разлагаются при нагревании выше 165ºС. Слабо растворяется в воде, лучше – в спирте.
2.9.7 Hg(ONC)2 (изоцианат ртути (II), гремучая ртуть) – применяется для изготовления капсюлей-детонаторов. Получается нагреванием ртути в смеси концентрированной HNO3 со спиртом.
Физические свойства. Желтовато-белые кристаллы. Плотность 4,42. Легко взрывается от удара или электрических искр, при нагревании, действии концентрированных кислот. Растворяется в спирте, нашатырном спирте, горячей воде; слабо – в холодной.
2.10 СВИНЕЦСодержание в земной коре 1,6·10-3%мас, известно около 80 минералов. Основные источники загрязнений металлургические предприятия не менее 89 тыс.т сточных вод. Встречается свинец в воздухе производственных помещений при нагревании. Применяется в производстве аккумуляторов, кабелей, сплавов; в химическом машиностроении; для защиты от γ-излучения; для получения тетраэтилсвинца и свинцовых пигментов. Получается обжигом PbS последующим восстановлением образовавшейся РbО коксом при 1500°; особо чистый Pb (99,99%)—электролитическим рафинированием.
Физические и химические свойства. Мягкий серый металл. Т.пл327,4º, Ткип. 1740º; плотность 11,3. В разбавленных кислотах практически нерастворим. Растворяется в HNO3, в мягкой воде, особенно хорошо в присутствии О2 воздуха и СО2. При нагревании непосредственно соединяется с О2 воздуха, галогенами, S, Te.
ПДК в воздухе рабочей зоны 0,01мг/м3, в атмосфере 0,003мг/л, в воде 0,03мг/л.
2.10.1 PbО (окись свинца (II), свинцовый глет) – применяется в производстве аккумуляторов, стекла, глазури, эмали олифы; в резиновой промышленности; для получения других соединений Pb. Получается окислением Pb на воздухе при 600°; при очистке Pb от примесей в металлургии; термическим разложением нитрата или карбоната свинца; кипячением Pb(ОН)2 с раствором NaOH.
Физические и химические свойства. Низкотемпературная α-модификация красного цвета (глет) и высокотемпературная β-модификация желтого цвета (массикот). Тплавл. 890°; Ткип. 1473°; плотность 9,53 (α); 8,0 (β); растворимость в воде глета 0,0017 г/100 г (20°), массикота 0,0023 г/100 г(22°). При нагреве на воздухе до 400—500° окисляется до сурика Pb3О4 и нестехиометрических окислов. Выше 200° восстанавливается Н2 и СО до металла.
2.10.2 Pb3О4 (ортоплюмбат свинца, сурик) – применяется для производства аккумуляторов, красок, эмалей, замазок; в цинкографии; книгопечатании; для получения PbО2. Получается нагреванием PbО в присутствии воздуха при 400—500º.
Физические и химические свойства. Красные кристаллы. При нагревании на воздухе выше 550° переходит в PbО. Плотность 8,79. В воде практически не растворяется. В разбавленной HNO3 разлагается с образованием PbО2 и солей Pb(II)
2.10.3 PbО2 (окись свинца (IV)) – применяется в производстве аккумуляторов; спичек; в качестве окислителя. Получается разложением сурика в HNO3; электролитическим окислением солей Pb(II) или действием на их растворы сильных окислителей.
Физические и химические свойства. Известны α и β-модификаций, обе черно-коричневого цвета. При нагревании на воздухе β-форма разлагается выше 280—300º до Pb3О4 и PbО, α-форма – выше 220—230°; плотность 9,67 (α); 9,33 (β). Нерастворима в воде. Сильный окислитель.
2.10.4 PbCl2 (хлорид свинца) – применяется для получения свинцовых пигментов. Получается растворением PbО или 2PbСО3·Pb(ОН)2 в НС1 или растворением гранулированного свинца в HNO3 и осаждением НС1.
Физические и химические свойства. Бесцветные кристаллы. Тплавл. 501°;Ткип. 956°; плотность 5,85, Растворимость в воде 0,673 г/100 г (0°); 3,25 г/100 г (100°). С С1- легко образует комплексные соединения типа MePbС13 и Me2PbCl4. При нагревании во влажном воздухе гидролизуется, а в присутствии Н2 или угля и паров Н2О восстанавливается до металла.
2.10.5 PbJ2 (йодид свинца) – применяется как пигмент для красок (желтая кассельская). Получается осаждением из растворов солей Pb(П) иодидами.
Физические свойства. Желтые кристаллы. Тплавл. 393°; Ткип. 868°; плотность 6,16. Растворимость в воде 0,07 г/100 г (20°), 0,436 г/100 г (100°).
2.10.6 PbСО3 (карбонат свинца) – встречается в виде минерала церуссита. Применяется для получения свинцовых белил. Получается пропусканием СО2 в водный раствор ацетата свинца.
Физические и химические свойства. Бесцветные прозрачные кристаллы. Разлагается при 315°; плотность 6,56. Растворимость в воде 1,1·10-5 г/100 г (20°). В присутствии СО2 растворимость возрастает вследствие образования Pb(НСО3)2. При кипячении в присутствии СО2 и воздуха образуется 2PbСО3·Pb(ОН)2. Взаимодействует с кислотами и щелочами.
2.10.7 2PbСО3·Pb(ОН)2(основной карбонат свинца, свинцовые белила) – применяется как пигмент для красок (в основном – в кораблестроении). Получается кипячением водного раствора PbСО3 при продувании СО2 и воздуха.
Физические и химические свойства. Бесцветные кристаллы или аморфный порошок. Разлагается при 400°; плотность 6,14. Растворяется в воде в присутствии СО2.
2.10.8 Pb(NO2)3 (нитрат свинца) – применяется в пиротехнике и для получения других соединений свинца. Получается растворением Pb, PbО или свинцовых белил в горячей разбавленной HNO3.
Физические и химические свойства. Бесцветные прозрачные кристаллы. Разлагается при 470°; плотность 4,53; n = 1,7815. Растворимость в воде 52,2 г/100 г (20°),. 127г/100г(100º). При 205—223º действует как сильный окислитель, распадаясь на PbО, NO2 и О2.
2.10.9 PbSO4 (сульфат свинца) – встречается в виде минерала англезита. Применяется как добавка к некоторым лакам и краскам (для повышения атмосферостойкости); для получения металлического Pb и других соединений Pb. Получается осаждением H2SO4 из растворов ацетата или нитрата свинца окислением металлического Pb или PbS дымящей H2SO4.
Физические и химические свойства. Бесцветные кристаллы. Разлагается при 1000ºС, плотность 6,2. Растворимость в воде 0,0045 г/100 г (25°); 0,0057 г/100 г (50°), растворим НС1, HNO3, H2SO4. В растворе соды переходит в карбонат свинца. Уголь и водород при температуре красного каления восстанавливают PbSO4 до сульфида.
2.10.10 PbS (сульфид свинца) – встречается в виде минерала галенита («свинцовый блеск») главного компонента свинцовых руд. Применяется для выплавки металлического Pb; для изготовления. фторосопротивлений. Получается сплавлением Pb с S; осаждением H2S из солей Pb(II).
Физические и химические свойства. Сине-серые кристаллы. Тплавл. 1114º, Ткип. 1281°; плотность 7,5. В воде, щелочах, разбавленных НС1 и H2SО4 практически нерастворим; растворяется разбавленной HNO3; конц. НС1 и H2SO3 разлагают PbS с выделением H2S; конц.HNO3 окисляет PbS до сульфата.
2.10.11 PbCrO4 (хромат свинца) – встречается в виде минерала крокоита («красная свинцовая руда»). Применяется в составе минеральных красок (кроны) и в качестве окислителя. Получается обменным взаимодействием нитрата свинца и хромата калия.
Физические и химические свойства. Желтые, оранжево-красные или темно-коричневые кристаллы. Разлагается при нагреве. Тплавл. 844°; плотность 6.12 (15º). Растворимость в воде 5,8·10-6 г/100 г (25°). Растворяется в минеральных кислотах. При нагревании выше температуры плавления обладает окислительными свойствами.
2.10.12 PbSiO3 (cиликат свинца) – применяется вместе с полисиликатами для приготовления глазурной фритты; в качестве стабилизатора в производстве пластмасс.
Физические и химические свойства. Бесцветные кристаллы. Тплав. 766º, плотность 6,49; п = 1,961, Нерастворим в воде, Реагирует с кислотами.
2.10.13 PbHAsO4 (гидроортоарсенат свинца, кислый джипсин) – применяется в качестве инсектицида. Получается взаимодействием нитрата свинца и гидроортоарсената натрия (обычно джипсив содержит еще основной арсенат свинца).
Физические свойства. Белые кристаллы. Разлагается при 200°С, плотность 5,79. В холодной воде нерастворим, в горячей слаборастворим.
2.10.14 Pb3(AsO4)2 (ортоарсенат свинца) – применяется для борьбы с вредителями сельского хозяйства. Получается взаимодействием ацетата свинца с арсенатом натрия или электролизом арсената натрия на свинцовом аноде.
Физические и химические свойства. Белые кристаллы. Т. плавл. 1042°(с разл.); плотность 7,30. Весьма слабо растворим в воде. Реагирует с HNO3.
2.10.15 Pb(C2H3O2)2, Pb(C2H3O2)2·3H2O (ацетат свинца, свинцовый сахар) – применяется при ситцепечатании и крашении тканей; для получения других соединений Pb, свинцовых белил и некоторых минеральных красок. Получается растворением РЬО в уксусной кислоте.
Физические и химические свойства. Бесцветные кристаллы. Безводный: Тплавл. 280°; плотность 3,25; растворимость в воде 19.7 г/100 г (0°). Трехводный: Тплавл. 75°; плотность 2,55. В горячей воде обе соли растворяются хорошо. Водная соль при плавлении переходит в безводную, на воздухе выветривается, переходя в карбонат.
2.11 СУРЬМА
Содержание сурьмы в земной коре 5·10-5% масс. Применяется в сплавах для типографских шрифтов и стереотипов, подшипников, дроби, пуль; при горячем цинковании кровельного железа, посуды; при изготовлении пластин свинцовых аккумуляторов. Получается сплавлением сурьмянистых руд, в основном сульфида сурьмы (Ш) с железной стружкой; образовавшиеся окислы сурьмы восстанавливают плавкой с углем; обогащенный концентрат выщелачивают щелочью и осаждают металлическую сурьму электролизом.
Физические и химические свойства. Серебристо-белый хрупкий металл. Тплавл. 627°; Т.кип. 1625°; плотность 6,684 (25°); нерастворима в воде.
ПДК в воздухе рабочей зоны 0,5мг/м3, в атмосфере воздуха 0,01мг/м3, в воде 0,05мг/м3.
2.11.1 Sb2O3 (Окись сурьмы (III)Сурьмянистый ангидрид) – применяется для красок, эмалей; как протрава в текстильной промышленности; для изготовления оптического стекла и получения металлической сурьмы. Получается обжигом сурьмянистых руд при 1000°. Чистую Sb2O3 получают гидролизом хлорида сурьмы (III) или окислением металлической сурьмы с последующей очисткой.
Физические и химические свойства. Устойчивая ниже 570° кубическая модификация – бесцветные кристаллы. Тплавл. 656°; Ткип. 1425°; плотность 5,19; легко возгоняется; растворимость в воде 0,0016г/100г(15°); 0,001 г/100 г (100°). Амфотерный окисел взаимодействует с кислотами и щелочами. Туман, образуемый парами Sb2O3, и ее взвешенная пыль устойчиво держатся в воздухе.
ПДК в воздухе рабочей зоны – 1,0мг/м3.
2.11.2 Sb2O5(Окись сурьмы (V), Сурьмяный ангидрид) – применяется в производстве стекла, керамики, красок и лаков; в текстильной, резиновой, фармацевтической промышленности, как компонент люминесцентных покрытий ламп дневного света. Получается окислением металлической сурьмы конц. HNO3 и прокаливанием образовавшегося гидрата окиси сурьмы.
Физические и химические свойства. Светло-желтые кристаллы. При нагреве выше 357° разлагается (образуя Sb2O4), не доходя до плавления. Плотность 3,78; растворимость в воде 0,3 г/100 г. Взаимодействует с НСl, HI; не вступает в реакцию с концентрированной HNO3; с расплавленными и водными щелочами образует антимонаты.
ПДК в воздухе рабочей зоны 2,0 мг/м3.
2.11.3 SbOKC4H4O6×0,5H2O (Антимонилтартрат калия, рвотный камень) – применяется в качестве протравы в ситцепечатании. Получается при действии Sb2O3 на водный раствор гидротартрата калия.
Физические свойства. Бесцветные кристаллы. При нагреве до 100° обезвоживается. Плотность 2,60; растворимость в воде 5,26 г/100 г (8,7°), 3,57 г/100 г (100°).
2.11.4 SbF3(Фторид сурьмы (III)) – применяется при электролитическом рафинировании металлической сурьмы в текстильной промышленности (протрава); при производстве тефлона, как фторирующнй агент в органическом синтезе. Получается растворением Sb2(SО4)3 или SbCl3 в плавиковой кислоте.
Физические свойства. Бесцветные кристаллы. Т. плавл. 292°, Т. кип. 319°, плотность 4,385; растворимость в воде 444,7 г/100 г (20°).
2.11.5 SbCl3 (Хлорид сурьмы (III) – применяется для получения чистой Sb2O3; в текстильной промышленности (протрава); в медицине. Получается хлорированием металлической сурьмы; растворением металлической сурьмы или ее окислов в НСl и Sb2S3 в горячей концентрированной НС1.
Физические и химические свойства. Бесцветные расплывающиеся на воздухе кристаллы. Т.плавл. 73,4°; т. кип. 218,6°; плотность 3,14. Взаимодействует с НС1 и H2SO4; с водой образует НС1 и SbOCl.
Похожие работы
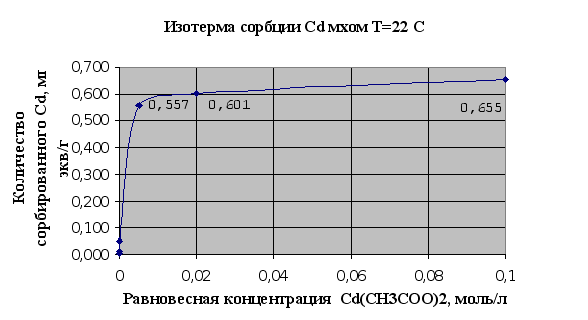
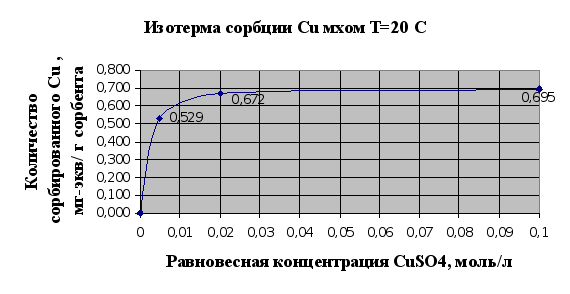
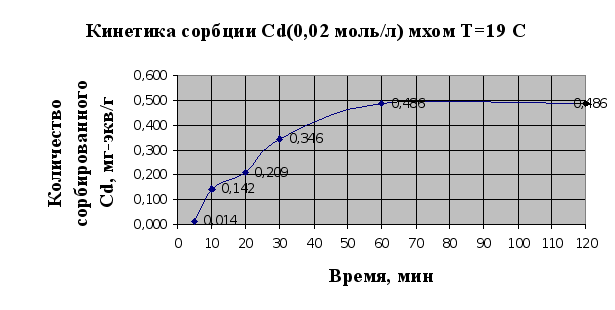
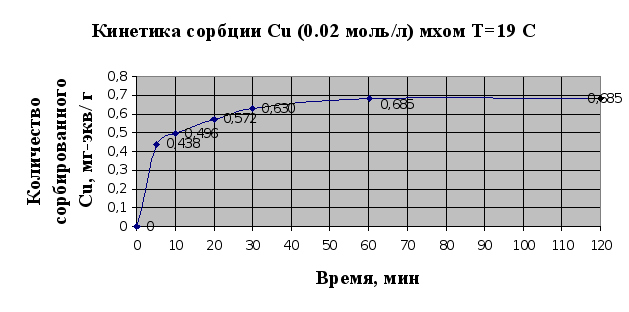
... Листов Пров. 1 2 Консульт. БГТУ 7140607 2004 Н. контр. Утв. Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой ...
... коробки противогаза на 45 г, после чего она уже непригодна. В случае резко повышенных концентрации применяют шланговые противогазы. Применяют также специальную одежду и перчатки. 2 Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды Ниже приведены основные сведения по нормированию содержания тяжелых металлов в воздухе, воде, почве, пищевых продуктах и кормах ...
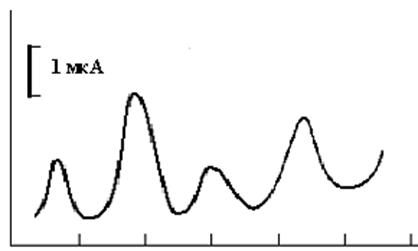
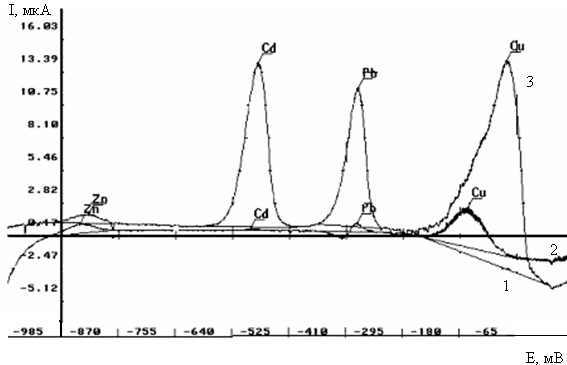
... повышения чувствительности определения мышьяка методом инверсионной вольамперометрии его обычно концентрируют на золотых и золото-графитовых электродах [28]. Работа посвящена разработке методики анализа воды на содержание мышьяка методом инверсионной вольтамперометрии с использованием золото-стеклоуглеродного электрода(ЗСУЭ), полученного методом «in situ»,что удешевляет анализ. Определены условия ...
... малая произрастает в большинстве стоячих водоемах по всей стране с разным уровнем загрязнения. Цель нашей работы следующая: Возможность использования ряски малой в качестве фиторемедиатора водоемов загрязнённых тяжелыми металлами и другими токсичными веществами. В работе были поставлены следующие задачи: 1. Возможность использование ряски малой для определения токсичности сточных вод и их ...


0 комментариев