Навигация
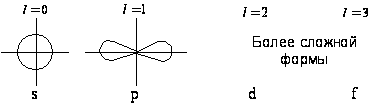
Общие свойства молекулярных орбиталей
Общие свойства МО хюккелевских УВ:
Альтернантность. Теорема парности.
Свойства корней векового детерминанта.
Матрица коэффициентов (составы МО).
Свойства коэффициентов.
Правило знаков.
Выравнивание зарядов в пи-системе.
Пучности и узлы пи-МО. Число узлов.
Хюккелевские циклы. Устйчивость
Ароматичность.
Правило Хюккеля 4n+2:1,(2),3,4,5,6,7,8,9.
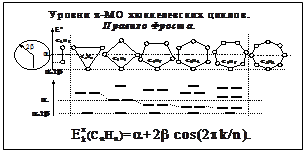
Моноциклические полиены
Циклы, граничные МО, электронные конфигурации, ароматичность.
Уровни МО: E=+2´[cos k (2/n)], "kÎ{0,1,2,n}. Правило ароматичности Хюккеля:
«В устойчивой ароматической оболочке число связывающих электронов равно
4n+2, "nÎ{0,1,2,n}» Этому правилу подчиняются соединения:
C5H5-; C6H6; C14H14; C18H18 ([18]-аннулен). Ароматичность проявляется в склонности к реакциям замещения, а не присоединения... . При 4<n<18 внутрь цикла попадают атомы H, которые искажают геометрию, и соединения уже неплоские.
Не ароматичны трёх- и четырёхчленные циклы. ЦИКЛОБУТАДИЕН не ароматичен!
Электронные конфигурации хюккелевских циклов:
| C3H3· | ·C4H4· | C5H5· | C6H6 | C7H7· | ·C8H8· | C14H14 | C18H18 | |
| Основная | a2e1 | a2e2 | a2e3 | a2e4 | a2e4(e*)1 | a2e4(e*)2 | ||
| C3H3+ | C4H4 | C5H5- | C6H6 | C7H7+ | C8H8 | C14H14 | C18H18 | |
| Устойчивая | a2 | (a2e2) | a2e4 | a2e4 | a2e4 | |||
| цикл. катион | неаром | аром. анион | аром | аром. катион | Неаром | аром | аром |
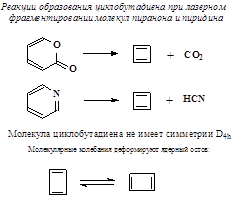
[14]-Аннулен плоский лишь при температуре t<-60oC [18]-Аннулен плоский даже при комнатной температуре. Он менее стабилен, чем бензол, но значительно стабильнее ациклического полиена (нонаена) C18H20. Гидрирование бензола – довольно жёсткий каталитический процесс
Напротив, известна реакция Зелинского. Тримеризация этина (ацетилена): 3 C2H2 ® C6H6. Механизмы электронного распределения в системах сопряжения. Классические валентные структуры. Уровни и электронная плотность.
Донорно-акцепторные соединения. Изоэлектронные неорганические (изоструктурные) аналоги органических структур. Соединения на основе нитрида бора. Связь BN.
Неорганические этан, этен и бензол. Боразол и боразон -аналоги бензола и алмаза.
Боразон-аналог алмаза (B¬N)n. Эти молекулы – изоэлектронные аналоги углеводородов:
H3B¬NH3 (аналог C2H6);
H2B¬NH2(аналог C2H4); цикл-(-HB¬NH-)3 (аналог C6H6).
Электронные распределения в системах:
|

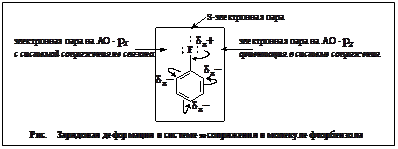
Замещение в ароматическом ряду Дезактивирующие ориентанты 1-го рода.
Сопряжение и зарядовая асимметрия. Обратное связывание в органической химии. Пример: пара-нитрофторбензол.
Треугольные циклы в методе МО ЛКАО. Симметрия и вырождение уровней.
Треугольные молекулярные циклы +C3H3; ·C3H3.
Наиболее глубоко располагаются уровни -МО. Над ними уровни -МО Вековой детерминант и диаграмма уровней. Хюккелевский детерминант треугольного цикла.
![]()
![]() X 1 1
X 1 1
Похожие работы
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... окисления +2. Железо образует достаточно большое количество комплексных соединений. Наиболее характерным для железа (II) и железа (III) является координационное число (КЧ) = 6 (реже 4 и 5). Способность к комплексообразованию более характерна для железа в С/О = +3. Рассмотрим некоторые комплексы железа и методы их получения. 1.3.1 Гексацианоферраты(II, III) Для железа (II) очень устойчивы ...
... (например, АЭС), с сельским хозяйством, с обезвреживанием промышленных отходов, охраной природы и др. История неорг. химии тесно связана с общей историей химии, а вместе с ней – с историей естествознания и историей человеческой цивилизации. Этапными для развития неорг. химии явились работы И. Берцелиуса, который в 1814 опубликовал таблицу атомных масс. А. Авогадро и Ж. Гей-Люссак открыли ...
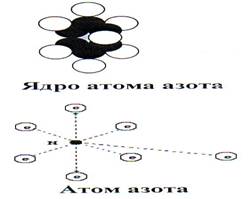
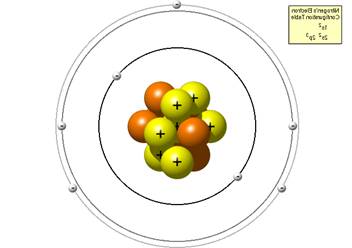
... увеличением порядкого номера. Эти элементы имеют 5 валентных электронов на наружном слое атома. Однако способность к присоединению электронов у них выражена значительно слабее, чем у элементов 7 и 6 группы [12,14]. Свойства азота. Изотопы, атом, молекула Строение ядра и электронных оболочек. В природе существуют два стабильных изотопа азота: с массовым числом 14 ( содержит 7 протонов и 7 ...
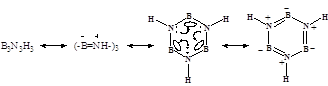


0 комментариев