Навигация
Получение дихлорэтана из этилена
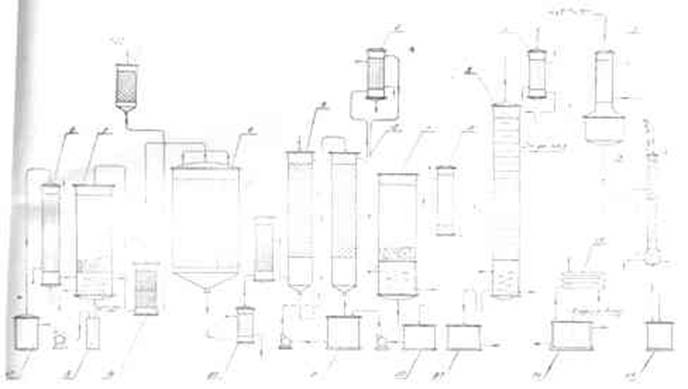
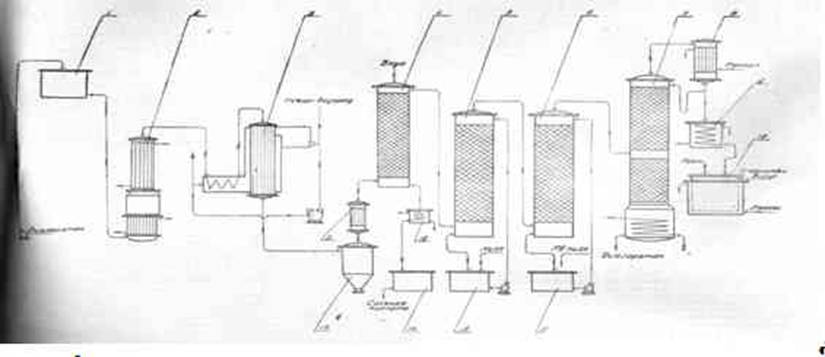
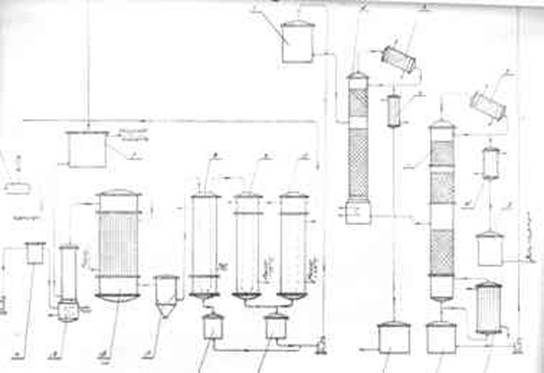
ПОЛУЧЕНИЕ ДИХЛОРЭТАНА ИЗ ЭТИЛЕНА
1. Товарные и технологические свойства дихлорэтана, области применения
Дихлорэтан (хлористый этилен) CH2Cl—CH2Cl — бесцветная летучая жидкость со специфическим запахом, напоминающим запах хлороформа (т.кип. 83,7°С; т.пл. -35,3°С; теплота испарения 77,3 ккал/кг). С водой образует азеотропную смесь (80,5% дихлорэтана), кипящую при 72оС. Дихлорэтан загорается с трудом, горит светящимся пламенем с зеленой каймой, при горении выделяется хлористый водород. Горящий дихлорэтан может быть легко погашен водой. Пары дихлорэтана образуют с воздухом взрывоопасные смеси с пределами взрываемости 4,8—15,9 %(об.).
Дихлорэтан смешивается во всех отношениях со спиртами, бензолом, ацетоном и многими другими органическими соединениями; хорошо растворяет масла, жиры, смолы, воска, каучук, алкалоиды, а также некоторые неорганические вещества, например серу, желтый фосфор, иод и др.
Дихлорэтан ядовит и обладает наркотическим действием, поэтому при работе с ним надо соблюдать осторожность. Вдыхание паров дихлорэтана вызывает головные боли, раздражение дыхательных путей, кашель и может привести к смерти. Предельно допустимая концентрация паров дихлорэтана в воздухе производственных помещений 10 мг/м3.
![]()
![]() Дихлорэтан применяется как растворитель в самых различных областях: для экстрагирования жиров, для очистки нефтепродуктов от парафина, для обезжиривания шерсти, мехов, а также металлических изделий перед хромированием или никелированием, для извлечения восков (монтан-воск) из бурых углей и т. д. Он является также полупродуктом для многих промышленных синтезов. Значительные количества дихлорэтана расходуются на получение хлористого винила.
Дихлорэтан применяется как растворитель в самых различных областях: для экстрагирования жиров, для очистки нефтепродуктов от парафина, для обезжиривания шерсти, мехов, а также металлических изделий перед хромированием или никелированием, для извлечения восков (монтан-воск) из бурых углей и т. д. Он является также полупродуктом для многих промышленных синтезов. Значительные количества дихлорэтана расходуются на получение хлористого винила.
2. Сырьевые источники: этиленовая фракция газов пиролиза нефтяного сырья и этиленовая фракция коксового газа.
3. Способы получения дихлорэтана.
Существуют несколько способов получения дихлорэтана из этилена:
1) взаимодействие этилена с хлором в среде жидкого дихлорэтана при 20—30° С;
2) пропускание этилена через жидкий хлор при повышенном давлении и температуре не выше 0° С;
3) взаимодействие этилена с хлором при повышенных температурах (до 120° С) над различными катализаторами .(CuCl2, FeCl3, SbCl5, животный уголь и др.);
4) взаимодействие этилена, хлористого водорода и кислорода воздуха над медным катализатором при 300°С:
CH2=CH2+2HCl+0,5О2 → СН2Сl—СН2Сl+Н2О
В промышленности распространен главным образом первый способ, технологически разработанный А. Ф. Добрянским с сотрудниками. Они доказали возможность использования для получения дихлорэтана не только чистого этилена, но и зтиленсодержащиж смесей, например этиленовой фракции газов пиролиза нефтяного сырья и этиленовой фракции коксового газа. По второму способу для достижения высокого выхода дихлорэтана требуются высококонцентрированный этилен и жидкий хлор. Кроме того, реакция образования дихлорэтана в этом случае протекает при избытке хлора, что приводит к образованию не только дихлорэтана, но и других продуктов хлорирования этилена. Недостатками остальных способов являются невысокий выход дихлорэтана вследствие образования побочных продуктов замещения, а также трудности очистки дихлорэтана.
4.Физикокохимические основы процесса получения дихлорэтана
Процесс получения дихлорэтана является гетерогенной сложной реакцией. Реакция необратимая эндотермическая, протекает без применения катализатора при низкой температуре.
Реакция присоединения хлора к этилену протекает с выделением большого количества тепла:
CH2=CH2+Cl2 → СН2Сl—СН2Сl ΔН= - 48 ккал
При получении дихлорэтана взаимодействием этилена с хлором в среде жидкого дихлорэтана, который растворяет оба газа, реакция протекает фактически в жидкой фазе. Благодаря этому достигается безопасность процесса (смесь газообразных хлора и этилена взрывоопасна) и улучшаются условия теплопередачи от реакционной массы к охлаждающему агенту. Отвод реакционного тепла значительно облегчается, и полностью устраняется возможность местных перегревов. Кроме того, в среде дихлорэтана процесс протекает аутокаталитически и скорость реакций значительно выше, чем при взаимодействии газообразных этилена и хлора При взаимодействии этилена с хлором, кроме продукта присоединения хлора по двойной связи (1,2-дихлорэтана), образуются также продукты замещения — трихлорэтан, тетрахлорэтан и высшие полихлориды:
CH2=CH2+2Cl2 → СН2Сl—СНСl2+HCl
CH2=CH2+3Cl2 → СНСl2—СНСl2+2HCl и т.д.
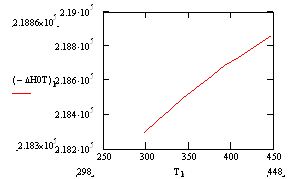
Реакции замещения ускоряются с повышением температуры (рис. 2). Из рисунка видно, что при температурах от —30 до —20е С получается почти исключительно дихлорэтан, в то время как при +20° С образуется преимущественно трихлорэтан. При дальнейшем повышении температуры происходит более глубокое замещение с образованием тетрахлорэтана. Лимитирование процесса происходит со стороны химической реакции. Согласно рис. 2 при увеличении температуры ускоряются реакции замещения, а при понижении температуры – выход дихлорэтана.
Состав получаемых продуктов резко изменяется, если в реакционную среду вводить свободный кислород. При этом образование продуктов замещения замедляется и даже прекращается. Объясняется это тем, что цепная реакция замещения в присутствии кислорода обрывается. Это обстоятельство значительно упрощает технологию производства дихлорэтана. Поэтому при добавлении кислорода можно проводить взаимодействие этилена с хлором при 20—30° С и отводить тепло реакции холодной водой без охлаждения рассолом требуемого при температурах ниже 0°С. Благодаря этому упрощается аппаратурное оформление процесса и понижается себестоимость дихлорэтана.
Механизм ингибирования кислородом реакции замещения атома водорода атомом хлора точно не выяснен. Предполагают, что образующиеся атомы хлора
Cl2 → Cl· +Cl·
Реагируют с кислородом по схеме
Cl2·+О2 → Cl – O – O·
Cl – O – O·→ Cl·
ClO· +ClO· → Cl2+O2 и т.д.
вследствие чего число атомов хлора значительно уменьшается.
Похожие работы
... отходы 1270,22 6,3511 2095,863 1,945 5. Потери 659,973 3,299865 1088,955 1 Итого 65997,3 329,9865 108895,5 100 4. Разработка контроля и автоматики технологического процесса производства поливинилхлорида Применение методов и средств автоматизации позволяет повысить производительность труда, уменьшить брак и потери. Конечной целью автоматизации является создание полностью ...
... гомологов этилена Ближайшие гомологи этилена - пропилен и бутилены - более активны в химическом отношении, чем сам этилен. Их реакции разнообразны и протекают с большей лёгкостью, и такие углеводороды начинают всё в большей степени использоваться в промышленном органическом синтезе. Алкирирование пропиленом бензола даст изопропилбензол (кумол), окислением которого получают фенол и ацетон. При ...
... достигала 63%.[8] Рассмотрен процесс превращения этиленгликоля в ацетальдегид. Предложены возможные варианты механизма этого процесса [9]. СН2 – ОН СН3СНО + Н2О СН2 – ОН Предложен метод получения ацетальдегида селективным гидрированием уксусной кислоты на катализаторе α-Fe2O3, нанесённом на основу SBN-15. СН3СООН + Н2 СН3СНО + Н2О Получена серия катализаторов, содержащих 20-60% &# ...
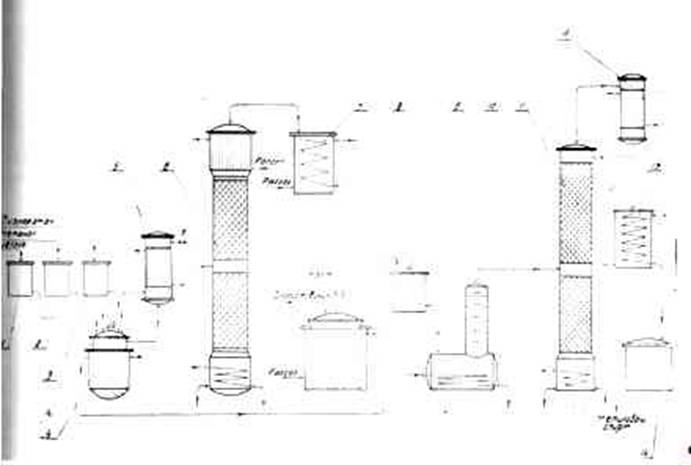
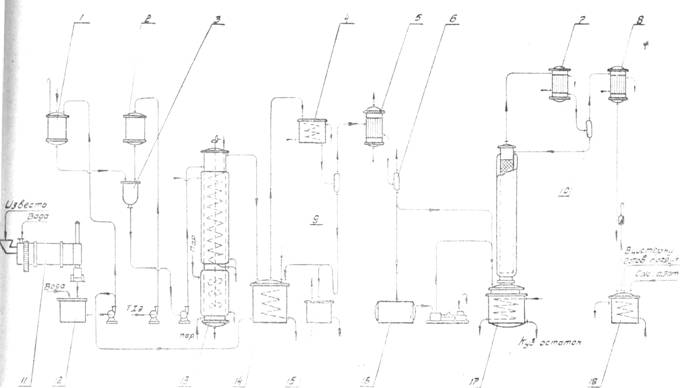
... Производство хлористого винила по Остросмысленскому Производство хлористого винила дегидрохлорированием дихлорэтана спиртовым раствором щелочи основано на работах, приведенных Остро-мысленским И. И. Получение хлористого винила осуществляется следующим образом (Схема 1). В реактор 4 из мерников 1 и 2 сливается 24%-ный раствор едкого натра и метиловый спирт в отношении по весу приблизительно ...

0 комментариев