Навигация
Аппаратурно-технологическая схема производства дихлорэтана
5. Аппаратурно-технологическая схема производства дихлорэтана
В промышленных условиях хлорирование этилена для получения дихлорэтана проводят в вертикальных цилиндрических хлораторах; тепло реакции отводится холодной водой, циркулирующей в змеевиках и рубашке аппарата. Хлоратор доверху заполнен дихлорэтаном, через который барботируют реагирующие газы — этилен и хлор. Газы должны быть предварительно тщательно осушены, так как влажный хлор, частично гидролизуясь, оказывает коррозионное действие на стальную аппаратуру. При достаточно полной осушке исходных газов всю реакционную аппаратуру и трубопроводы можно изготовлять из обычной углеродистой стали.
Этилен поступает с разделительных установок глубокого охлаждения достаточно осушенным, и дополнительной осушки его не требуется. Из этилена, выделяемого другими способами, например гиперсорбцией, влага должна быть удалена твердыми поглотителями или вымораживанием. Применять для осушки этилена серную кислоту не рекомендуется, так как в ее присутствии происходит осмоление и сульфирование непредельных углеводородов, содержащихся в этиленовой фракции. Для осушки хлора применяют концентрированную серную кислоту, но обычно хлор поступает с хлорного завода уже осушенным. При работе с недостаточно осушенными исходными газами требуется освинцовывать внутренние стенки хлоратора, охлаждающих змеевиков и мешалок.
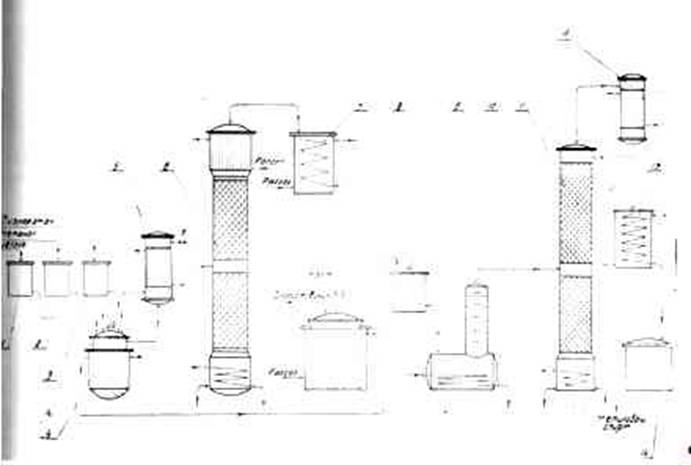
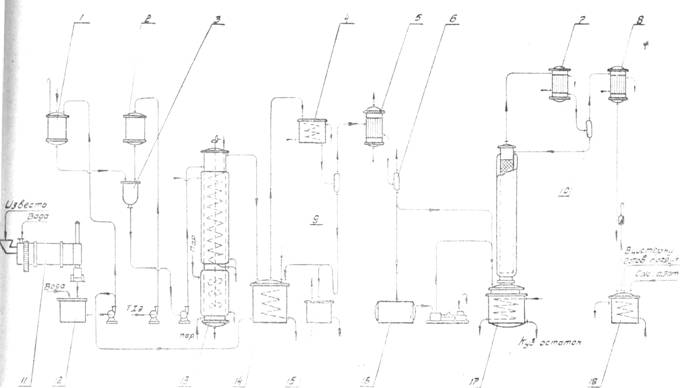
Технологическая схема промышленного производства дихлорэтана показана, на рис. 1. В газовой смеси, поступающей в хлоратор 1, должен содержаться избыток этилена (5—10% от стехиометрического количества), необходимый для полного связывания хлора. Присутствие хлора в реакционных газах недопустимо, так как взаимодействие хлора с углеводородами в неохлаждаемом трубопроводе может привести к повышению температуры и воспламенению углеводородов. Хлор, подаваемый в хлоратор, разбавляют
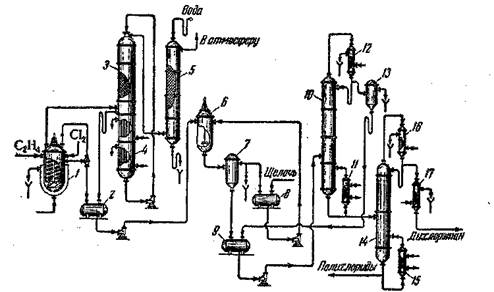
Рис.1. Схема производства дихлорэтана из этилена и хлора:
1 – хлоратор; 2 – сборник дихлорэтана-сырца; 3 – конденсатор смешения; 4 – холо-дильник; 5 – промывной скруббер; 6 – нейтрализатор; 7, 13 – разделители; 8 – сборник щелочи; 9 – сборник нейтрализованного дихлорэтана; 10, 14 – ректификационные колонны; 11, 15 – кипятильники; 12, 16 – дефлегматоры; 17 – холодильник.
воздухом (8—10% от объема реагирующих газов); это дает возможность проводить хлорирование этилена при 20—30°С.
Для лучшего контакта между реагирующими газами и более полного растворения их в дихлорэтане в хлораторе установлена пропеллерная мешалка. Образующийся дихлорэтан-сырец из хлоратора самотеком непрерывно перетекает в сборник 2.
Отходящие из хлоратора газы (непрореагировавший этилен) газообразные примеси, содержащиеся в исходном этилене и хлоре, воздух) увлекают значительное количество паров дихлорэтана и часть хлористого водорода, образующегося в результате реакций замещения. Поэтому из отходящих газов выделяют дихлорэтан либо абсорбцией растворителями (керосин и др.), либо конденсацией, как показано на схеме. Отходящие газы поступают в насадочный конденсатор смешения 3, смонтированный над холодилышком 4. В верхнюю часть конденсатора смешения подают из холодильника 4 охлажденный до —20о С дихлорэтан для орошения, насадки. Газы, поступающие в нижнюю часть конденсатора смешения, проходят насадку снизу вверх противотоком к дихлорэтану и охлаждаются до —15°С, благодаря чему почти все пары дихлорэтана конденсируются. Сконденсировавшийся дихлорэтан смешивается с дихлорэтаном, подаваемым на орошение, и поступает в холодильник 4, где вновь охлаждается до —20°С. Газы, отходящие из верхней части конденсатора смешения, отмываются водой в скруббере 5 от хлористого водорода и уходят в атмосферу.
Дихлорэтан-сырец из сборника 2 перекачивается в аппарат 6, где при перемешивании производится нейтрализация растворенного в дихлорэтане хлористого водорода 5—10%-ным раствором едкого натра. Нейтрализованный дихлорэтан отделяется в разделителе 7 от раствора щелочи и стекает в сборник 9, из которого поступает на осушку и ректификацию. Осушка дихлорэтана производится в ректификационной колонне 10, в нижней части которой поддерживается температура 75—85°С. Из колонны отгоняется азеотропная смесь дихлорэтана с водой, конденсирующаяся в дефлегматоре 12 и частично возвращаемая на орошение колонны 10. Дистиллят расслаивается в разделителе 13; вода направляется на очистную станцию и далее в канализацию, а дихлорэтан возвращается в сборник 9, Из кубовой части колонны 10 стекает обезвоженный дихлорэтан, поступающий далее в ректификационную колонну 14, где дихлорэтан-дистиллят отделяется от трихлорэтана и полихлоридов (кубовая жидкость).
6. Расчет материального баланса процесса хлорирования этилена
Данные для расчета:
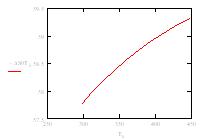
На основании табл. 4.1 [1] определяем выходы продуктов реакции при температуре 255 К:
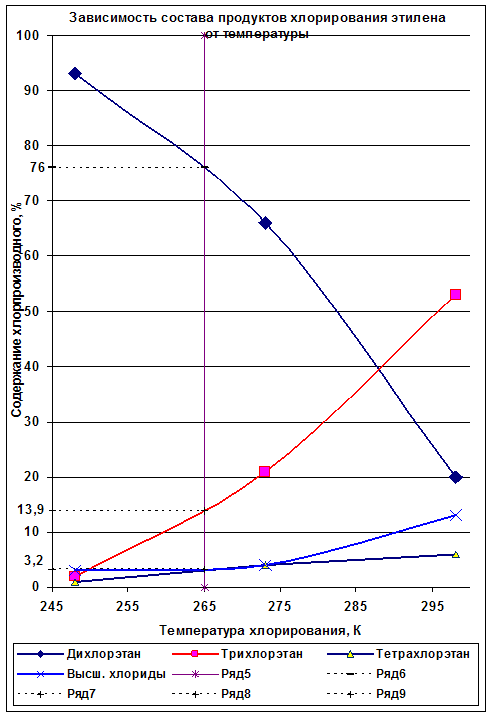
Рис. 2. Выход продуктов реакции.
На основании рис. 2 данные по выходу продуктов реакции сводим в табл. 1.
Таблица 1.
Выход продуктов реакции при Т=265К
| Состав продуктов хлорирования, %(масс.) | |
| Дихлорэтан | 76,0 |
| Трихлорэтан | 13,9 |
| Тетрахлорэтан | 3,2 |
| Высшие хлориды | 3,2 |
Избыток этилена в % от стехиометрии 10
В дихлорэтане растворяется 50 % хлористого водорода
Давление в системе, МПа 0,89
Производительность установки, т/год дихлорэтана 10000.
Число рабочих дней в году 350
Таблица 2.
Состав хлора и этиленовой фракции
| Состав хлора, %(об.) | Состав этиленовой фракции, %(об.) | |||||
| Cl2 | CO2 | H2 | N2 | C2H4 | C2H6 | C3H6 |
| 98 | 1,2 | 0,3 | 0,5 | 92,0 | 6,0 | 2,0 |
Часовая производительность установки по дихлорэтану составляет:
![]() .
.
При этом образуется:
Трихлорэтана ![]() ;
;
Тетрахлорэтана ![]() ;
;
Высших хлоридов ![]() ;
;
При взаимодействии хлора с этиленом протекают следующие реакции:
![]() (1)
(1)
![]() (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Исходя из этих реакций, определяем:
1. Расход этилена на образование ди-, три-, тетрахлорэтана и высших хлоридов:
![]()
или
![]() .
.
С учетом 10 %-ного избытка этилена его расход составит:
1,1·318,1=349,9 м3/ч
или
349,9·1,250=437,4кг/ч.
2. Расход этиленовой фракции (с учетом 10 %-ного избытка этилена):
![]() .
.
3. Расход хлора:
![]()
или
![]() .
.
4. Расход технического хлора:
![]() .
.
5. Количество образующегося хлористого водорода:
![]()
или
![]() .
.
6. Количество отходящих газов:
| Газы | Объем, м3/ч | Состав %(об.) | Количество, кг/ч |
| Этилен | 380,3·0,92-318,1=31,8 | 30,77 | (31,8:22,4)·28=39,8 |
| Этан | 380,3·0,06=22,8 | 22,08 | (22,8:22,4)·30=30,6 |
| Пропилен | 380,3·0,02=7,6 | 7,36 | (7,6:22,4)·42=14,3 |
| Двуокись углерода | 392,5·0,012=4,7 | 4,56 | (4,7:22,4)·44=9,3 |
| Азот | 392,5∙0,005=2,0 | 1,91 | (2,0:22,4)·28=2,5 |
| Водород | 392,5∙0,003=1,2 | 1,14 | (1,2:22,4)·2=0,1 |
| Хлористый водород | 66,5·0,5=33,3 | 32,18 | (33,3:22,4)·36,5=54,2 |
| ИТОГО: | 103,3 | 100,00 | 150,6 |
Отходящие газы насыщены парами дихлорэтана, количество которых можно рассчитать по формуле [2]:
![]() ,
,
где ![]() - количество паров дихлорэтана, уносимых газами, кг/ч;
- количество паров дихлорэтана, уносимых газами, кг/ч;
Gг – количество газов, пропускаемых через дихлорэтан, кг/ч;
φ – коэффициент насыщения (в данном случае φ=1 [2]);
р – давление пара над жидкостью (при Т=265 К р=0,0021 МПа рис. XIV [4]);
Мж – молекулярная масса дихлорэтана;
Мг – средняя молекулярная масса газовой смеси;
Р – общее давление в системе, МПа.
Находим среднюю молекулярную массу газовой смеси:
Мг=0,3077·28+0,2208·30+0,0736·42+0,0456·44+0,0191∙28+0,0114∙2+0,2487·36,5=32,64.
Унос паров дихлорэтана составит:
![]() .
.
Из реактора отводится жидкий дихлорэтан, количество которого составляет:
1190,5-1,1=1189,4 кг/ч.
Массовый расход сырья:
Масса газа при нормальных условиях равна его молярной массе, поделенной на объем, занимаемый одним молем, т.е. ![]() , где
, где ![]() - плотность газа при нормальных условиях.
- плотность газа при нормальных условиях.
Этиленовая фракция:
![]() ;
;
![]() ;
;
![]() ;
;
Технический хлор:
![]() ;
;
![]() ;
;
![]() ;
;
![]()
Массовый расход сырья составит:
Этиленовая фракция:
![]() ;
;
![]() ;
;
![]() ;
;
Хлор технический:
![]() ;
;
![]() ;
;
![]() .
.
![]()
Материальный баланс производства дихлорэтана сводим в таблицу 3:
Таблица 3
Материальный баланс производства дихлорэтана
| № п/п | Приход | кг/ч | № п/п | Расход | кг/ч |
| 1 | Этиленовая фракция | 482,3 | 1 | Дихлорэтан-сырец | 1561,5 |
| в том числе: | в том числе: | ||||
| Этилен | 437,4 | дихлорэтан | 1189,4 | ||
| Этан | 30,6 | трихлорэтан | 217,7 | ||
| Пропилен | 14,3 | тетрахлорэтан | 50,1 | ||
| высшие хлориды | 50,1 | ||||
| 2 | Хлор технический газообраный | 1231,0 | хлористый водород | 54,2 | |
| в том числе: | 2 | Отходящие газы | 150,6 | ||
| хлор | 1219,1 | в том числе: | |||
| двуокись углерода | 9,3 | этилен | 39,8 | ||
| водород | 0,1 | этан | 30,6 | ||
| азот | 2,5 | пропилен | 14,3 | ||
| двуокись углерода | 9,3 | ||||
| хлористый водород | 54,2 | ||||
| дихлорэтан | 1,1 | ||||
| водород | 0,1 | ||||
| азот | 2,5 | ||||
| ИТОГО: | 1713,3 | ИТОГО: | 1712,1 |
Расхождение баланса составляет:
![]() , что вполне допустимо.
, что вполне допустимо.
Конверсия исходного сырья.
Основным реагентом в сырье является этилен, поэтому конверсию рассчитываем по этилену, как отношение количества израсходованного этилена (Gн-Gк), где Gк – количество непрореагировавшего этилена, к общему его количеству в начале процесса Gн:
![]()
Селективность находим как отношение готового продукта Gп к прореагировавшему сырью Gc
![]()
Выход целевого продукта.
Если количество целевого (товарного) продукта Gп, то выход продукта Ф в расчете на сырье Gз составит
![]()
ЛИТЕРАТУРА
1. Кутепов А.М., Бондарева Т.И., Беренгартен М.Г. Общая химическая технология. Учебник для технических ВУЗов. – М.: «Высшая школа», 1990. – 512 с.
2. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза: Учебник для вузов. – М. Химия, 1988. – 592 с.
3. Общая химическая технология: Учеб. для химико-техн. спец. вузов. В 2-х т./под ред. проф. И.П.Мухленова. – М.: Высш. шк., 1984. – 263 с.
4. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. – Л.: Химия, 1987. – 576 с.
5. Паушкин Я.М., Адельсон С.В., Вишнякова Т.П. Технология нефтехимического синтеза, в двух частях. Ч. I. Углеводородное сырье и продукты его окисления. М.: «Химия», 1973. – 448 с.
Похожие работы
... отходы 1270,22 6,3511 2095,863 1,945 5. Потери 659,973 3,299865 1088,955 1 Итого 65997,3 329,9865 108895,5 100 4. Разработка контроля и автоматики технологического процесса производства поливинилхлорида Применение методов и средств автоматизации позволяет повысить производительность труда, уменьшить брак и потери. Конечной целью автоматизации является создание полностью ...
... гомологов этилена Ближайшие гомологи этилена - пропилен и бутилены - более активны в химическом отношении, чем сам этилен. Их реакции разнообразны и протекают с большей лёгкостью, и такие углеводороды начинают всё в большей степени использоваться в промышленном органическом синтезе. Алкирирование пропиленом бензола даст изопропилбензол (кумол), окислением которого получают фенол и ацетон. При ...
... достигала 63%.[8] Рассмотрен процесс превращения этиленгликоля в ацетальдегид. Предложены возможные варианты механизма этого процесса [9]. СН2 – ОН СН3СНО + Н2О СН2 – ОН Предложен метод получения ацетальдегида селективным гидрированием уксусной кислоты на катализаторе α-Fe2O3, нанесённом на основу SBN-15. СН3СООН + Н2 СН3СНО + Н2О Получена серия катализаторов, содержащих 20-60% &# ...
... Производство хлористого винила по Остросмысленскому Производство хлористого винила дегидрохлорированием дихлорэтана спиртовым раствором щелочи основано на работах, приведенных Остро-мысленским И. И. Получение хлористого винила осуществляется следующим образом (Схема 1). В реактор 4 из мерников 1 и 2 сливается 24%-ный раствор едкого натра и метиловый спирт в отношении по весу приблизительно ...

0 комментариев