Навигация
Кислотно-щелочное равновесие
Министерство образования Российской Федерации
Пензенский Государственный Университет
Медицинский Институт
Кафедра Травматологии, ортопедии и
военно-экстремальной хирургии
Курсовая работа
на тему:
«Кислотно-щелочное равновесие»
Пенза 2008
План
1. Определения
2. Значение pH
3. Уравнение Henderson—Hasselbalch
4.Буферы
5. Двуокись углерода
6. Метаболический ацидоз
7. Метаболический алкалоз
8. Респираторный алкалоз
9. Респираторный ацидоз
Литература
1. Определения
Кислотность любого раствора является мерой активности его водородных ионов. Активность водородных ионов прямо пропорциональна их концентрации в растворе, умноженной на коэффициент активности. Последний же определяется свободной подвижностью водородных ионов в данной жидкости и условно обозначается терминами, принятыми в теории Debye — Htickel.
[АН] и [НА] являются мерой активности водородных ионов, но не их концентрации. [НА] — это любая кислота, а |АН] — сложное основание. Общее уравнение кислотности любого раствора может быть теперь записано так:
Н* = К [Кислота] А[Основамие]
Следовательно, кислотность раствора равна отношению активности кислоты и основания, умноженному на константу диссоциации.
2. Значения рН
Концентрация водородных ионов даже в очень кислом растворе чрезвычайно низка. В так называемом нейтральном растворе количество водородных ионов (Н+) равняется количеству гидроксильных ионов (ОН). Термин "рН" относится к отрицательному логарифму концентрации водородных ионов.
3. Уравнение Henderson—Hasselbalch
рН = рК + |OgAiaienTOP протонов (основание) источник протонов (кислота)
Согласно уравнению Henderson—Hasselbalch, рН равен рК (отрицательный логарифм константы диссоциации) плюс логарифм отношения концентрации основания к соответствующей кислоте.
Около 80 % буферности экстрацеллюляриой жидкости определяется бикарбонатно-углекислой системой. Нормальная концентрация бикарбоната составляет в среднем 24 мЭкв/л, а нормальная концентрация углекислоты — 1,2 мЭкв/л. Таким образом, отношение бикарбоната к углекислоте в норме составляет 20:1. Логарифм от 20 составляет 1,3; прибавив 1,3 к 6,1 (рК бикарбонатно-углекислой системы), получаем 7,4, что является нормой рН для артериальной крови = 6,1 + 1,3 = 7,4.
Другой быстрый способ оценки рН по НСО3 и Н2СО3 базируется на использовании логарифмических таблиц. Нормальное отношение НСО3 и Н2СО3 составляет 20:1, а логарифм от 20 — 1,3. Поскольку логарифм от 16 составляет 1.0, а логарифм от 5 — 0,7, можно сделать вывод: если отношение НСО3 к Н2СО3 уменьшается наполовину, то рН снижается на 0,3.
Следовательно, рН при величинах НСО3, равных 12, и Н2СО3, равных 1,2 (РСо2 40 мм рт.ст.), составит 7,1. Если же показатель НСО3 снизится до 6, a PCOl останется равным 40 мм рт.ст., то рН составит 6,8.
4. Буферы
Множество различных метаболических и респираторных факторов обусловливают образование ионов водорода (или участвуют в этом процессе). Происходящие при этом изменения концентрации водородных ионов могли бы вызвать большие колебания рН, если бы не существовала группа веществ, называемых буферами, которые обладают способностью хотя бы частично нейтрализовать кислоты и основания. Кислотно-буферная способность любого вещества или раствора определяется количеством ионов водорода, которое образуется при участии этого вещества с изменением pH среды на одну единицу.
Общее буферное основание, или буферная способность, у взрослого мужчины составляет в среднем около 1000 мЭкв. Главными буферами крови являются гемоглобин, находящийся в эритроцитах, а также бикарбонат и белок плазмы. Наибольшая буферная способность в отношении двуокиси углерода обеспечивается гемоглобином, но за буфсрирование крови и интерстициальной жидкости в тот или иной момент ответственна, прежде всего, система бикарбонат — углекислота. Наиболее важными внутриклеточными буферами являются фосфат и белок. У пациентов с анемией, низким уровнем плазменного белка или уменьшенной мышечной массой буферная способность снижена, поэтому при заболевании или травме они склонны к значительным сдвигам рН. Даже относительно кратковременное ухудшение тканевой перфузии может вызвать у них тяжелый ацидоз.
Большинство буферных систем организма, прежде всего, нейтрализует кислоту. Вот почему человеческий организм, как правило, переносит кислотную нагрузку гораздо лучше, чем присутствие избытка оснований.
5. Двуокись углерода
Понятие "содержание двуокиси углерода" относится прежде всего к общему содержанию СО2 в крови, которое в норме составляет 24—31 мЭкв/л. Что касается плазмы, в понятие "содержание СО2" включают углекислоту, бикарбонат и карбаминовые соединения. Количество присутствующей угольной кислоты (в среднем около 1,2 мЭкв/л) можно определить путем умножения значения PCOl на 0,03. В норме концентрация бикарбоната в артериальной крови составляет в среднем 24 мЭкв/л. Концентрация карбаминовых соединений, содержащих различные формы СО2 в сочетании с белковыми аминогруппами, в среднем составляет около 0,5—1,5 мЭкв/л в зависимости от общих концентраций СО2 и белка. Таким образом, при обычных обстоятельствах артериальная концентрация бикарбоната приблизительно на 1,5—2,0 мЭкв/л ниже уровня СО2 артериальной крови. Поскольку венозное /со; в норме на 6—7 торр выше артериального PCOl, а венозное содержание бикарбоната приблизительно на 1,0 мЭкв/л выше его артериального уровня, содержание СО2 в венозной крови обычно на 2,5—3,0 мЭкв/л превышает артериальный уровень бикарбоната. Определение артериального бикарбоната по содержанию СО2 в артериальной или венозной крови иногда бывает более точным, чем его расчет по артериальным PCOl и рН. У пациентов с острым заболеванием концентрация бикарбоната не может быть надежно рассчитана на основании измерений рН и РСОл ввиду изменений в показателях рК (константа диссоциации для Н2СО3), наблюдаемых при различных метаболических нарушениях.
Двуокись углерода (летучая кислота) — продукция и транспорт
Около 12 000—20 000 мЭкв СО2 (или летучей кислоты) образуется в организме человека ежедневно в результате метаболизма углеводов, белков и жиров и выделяется через легкие. Ббльшая часть СО2, поступающего в легкие из периферических тканей, обеспечивается плазменным бикарбонатом и гемоглобином эритроцитов. Содержание СО2) присутствующего в артериальной крови в виде углекислоты, составляет в среднем около 1,2 мЭкв/л, что эквивалентно PCOl в 40 торр.
Выделение нелетучей углекислоты. Обычно почки экскретируют около 70 мЭкв углекислоты ежедневно, но у больных с ацидозом экскреция кислоты может возрасти четырехкратно. Почечная тубулярная экскреция кислоты нормально осуществляется тремя механизмами. 1. Прямое выделение водорода, при котором в норме ежедневно выводится лишь около 0,1 мЭкв кислоты. 2. Экскреция с буферами мочи, включающими Na2HPO4; таким образом выводится около 20 мЭкв кислоты в день. 3. Экскреция с аммонием (образуется в клетках дистальных канальцев из глютамина и других предшественников); при этом ежедневно выделяется примерно 50 мЭкв углекислоты.
В проксимальных канальцах натрий и бикарбонат абсорбируются независимо от влияния альдостерона, а ионы водорода выделяются в просвет канальцев в обмен на ион натрия. Если объем экстрацеллюлярной жидкости сокращается или имеет место дефицит натрия, то абсорбция натрия и бикарбоната в проксимальных канальцах возрастает, что может привести к так называемому метаболическому алкалозу сокращения. При вливании изотонического раствора хлорида натрия количество экстрацеллюлярной жидкости увеличивается, при этом абсорбция натрия и бикарбоната в проксимальных канальцах уменьшается.
В дистальных канальцах Н2СО3 диссоциируется на Н+ и HCO3. Здесь же Н+ и К+ выделяются в мочу в обмен на Na+. НСО3, образующийся в клетке, и Na+, абсорбируемый из просвета канальца, перемещаются на другую сторону канальцевой клетки и попадают в кровоток в виде NaHCO3.
Все, что повышает внутриклеточную концентрацию водородных ионов, увеличивает их выделение в просвет дистального канальца и повышает реабсорбцию натрия. При возникновении дефицита калия во внеклеточной жидкости ионы калия покидают тканевые клетки в обмен на водород, что приводит к интрацеллюлярному ацидозу и экстрацеллюлярному алкалозу. Кроме того, повышенное количество калия абсорбируется в дистальных канальцах в обмен на ионы водорода, которые затем экскретируются с мочой. Таким образом, больной с гипокалиемией и алкалозом может выделять парадоксально кислую мочу. И наоборот, гиперкалиемия вызывает интрацеллюлярный алкалоз, что уменьшает реабсорбцию бикарбоната в почках, обусловливая тем самым возникновение ацидемии.
Похожие работы
... обмена веществ - аммиак, амины, основные соли фосфорной кислоты). Кислые и щелочные продукты образуются также при различных патологических процессах. В связи с тем, что сдвиги в кислотно-щелочном равновесии компенсируются, концентрация водородных ионов меняется лишь в редких случаях. Поэтому рН крови определяют нечасто. Оценку состояния кислотно-щелочного равновесия дают при исследовании тех ...
... Н+ - это протон, т.е. атом водорода без своего орбитального электрона; Н+ в водном растворе присутствует как гидроксид-ион или Н3О +. Присоединение и отдача Н+ лежит в основе кислотно-щелочной химии. На сегодняшний день принята теория кислотно-щелочного отношения Бренстеда. Кислоты - вещества, которые в растворах отдают ионы водорода, т.е. являются донорами Н+. ( NH4+ - Н+ + NH3). Основания - ...
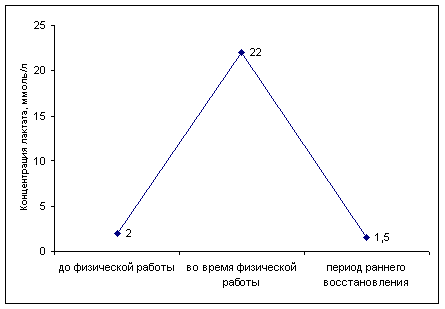
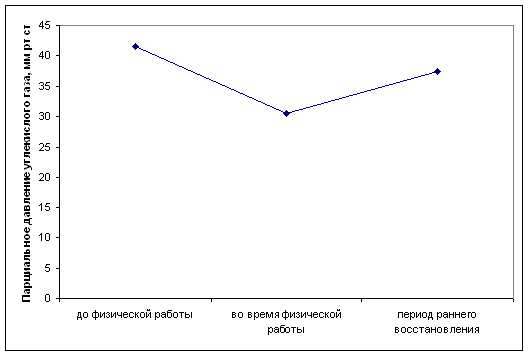
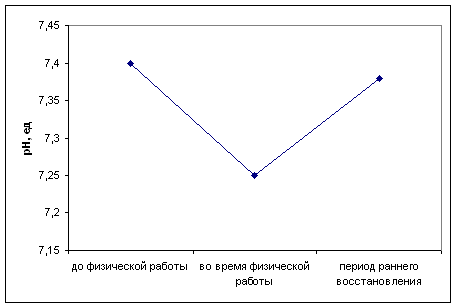
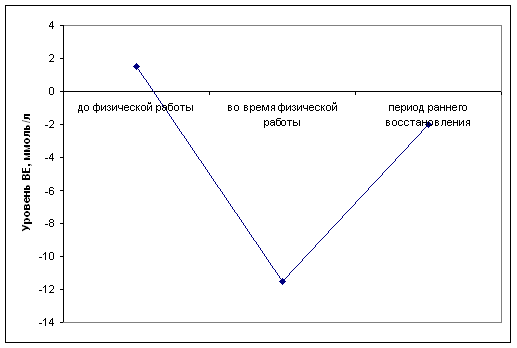
... определенной физической нагрузки связано с состоянием тренированности спортсмена. Накопление молочной кислоты в крови при выполнении физической работы ведет к развитию метаболического ацидоза, который клинически характеризуется снижением рН. В спортивной практике важно определять показатели КОС при стандартной и предельной физической работе с целью оценки адаптивных возможностей организма ...
... солевой формы белка при этом незначительно увеличивается, а "белка – кислоты" – эквивалентно уменьшается. И поэтому рН практически не изменится. Таким образом, рассмотренные системы показывают, что буферное действие раствора обусловлено смещением кислотно-основного равновесия за счет связывания добавляемых в раствор ионов Н+ и ОН- в результате реакции этих ионов и компонентов буферной системы с ...
0 комментариев