Навигация
Окисление ненасыщенных жирных кислот. Биосинтез холестерина. Мембранный транспорт
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИНФОРМАТИКИ И РАДИОЭЛЕКТРОНИКИ
Кафедра ЭТТ
РЕФЕРАТ
На тему:
«Окисление ненасыщенных жирных кислот. Биосинтез холестерина. Мембранный транспорт»
МИНСК, 2008
Окисление ненасыщенных жирных кислот.
В принципе происходит также как и насыщенных, однако имеются особенности. Двойные связи природных ненасыщенных жирных кислот имеют цис-конфигурацию, а в КоА эфирах ненасыщенных кислот, являющихся промежуточными продуктами при b окислении, двойные связи имеют транс-конфигурацию. В тканях есть фермент, изменяющий конфигурацию двойной связи цис- в транс-.
Метаболизм кетоновых тел.
Под термином кетоновые (ацетоновые) тела подразумевают ацетоуксусную кислоту, b-гидроксимасляную и ацетон. Кетоновые тела образуются в печени в результате деацилирования ацетоацетил КоА. Имеются данные, указывающие на важную роль кетоновых тел в поддержании энергетического гомеостаза. Кетоновые тела – своего рода поставщики топлива для мышц, мозга и почек и действуют как часть регуляторного механизма, предотвращающая мобилизацию жирных кислот из депо.
Биосинтез липидов.
Биосинтез липидов из глюкозы является важным звеном обмена у большинства организмов. Глюкоза, в количествах, превышающих непосредственные энергетические потребности может являться строительным материалом для синтеза жирных кислот и глицерина. Синтез жирных кислот в тканях протекает в цитоплазме клетки. В митохондриях в основном происходит удлинение существующих цепей жирных кислот.
Внемитохондриальный синтез жирных кислот.
Строительным блоком для синтеза жирных кислот в цитоплазме клетки служит ацетил КоА, который в основном происходит из митохондриального. Для синтеза необходимо наличие в цитоплазме углекислого газа и иона бикарбоната и цитрат. Митохондриальный ацетил КоА не может диффундировать в цитоплазму клетки, т.к. митохондриальная мембрана непроницаема для него. Митохондриальный ацетил КоА взаимодействует с оксалоацетатом, образуя цитрат и проникает в цитоплазму клетки, где расщепляется до ацетил КоА и оксалоацетата.
Имеется еще один путь проникновения ацетил КоА через мембрану – с участием карнитина.
Этапы биосинтеза жирных кислот:
Образование малонил КоА, путем связывания углекислого газа(биотин-фермент и АТФ) с коэнзимом А. Для этого необходимо наличие НАДФН2.
Образование ненасыщенных жирных кислот:
В тканях млекопитающих присутствуют 4 семейства ненасыщенных жирных кислот –
1.пальмитоолеиновая, 2.олеиновая, 3. линолевая,4.линоленовая
1 и 2 синтезируются из пальмитиновой и стеариновой кислот.
Биосинтез триглицеридов.
Синтез триглицеридов происходит из глицерина и жирных кислот (стеариновой, пальмитиновой, олеиновой). Путь биосинтеза триглицеридов происходит через образование глицерол-3-фосфата.
Глицерол-3-фосфат ацилируется и образуется фосфатидная кислота. Далее происходит дефосфорилирование фосфатидной кислоты и образование 1,2-диглицерида. Затем происходит этерификация молекулой ацил КоА и образование триглицерида. Глицерофосфолипиды синтезируются в эндоплазматической цепи.
Биосинтез насыщенных жирных кислот.
Непосредственным предшественником двууглеродных единиц в синтезе жирных кислот служит малонил КоА.
Полный синтез насыщенных жирных кислот катализируется особым синтетазным комплексом, состоящим из 7 ферментов. Синтетазная система, катализируюшая синтез жирных кислот в растворимой фракции цитоплазмы ответственна за следующую суммарную реакцию при которой одна молекула ацетил КоА и 7 молекул малонил КоА конденсируются с образованием одной молекулы пальмитиновой кислоты (восстановление осуществляется за счет НАДФН). Единственная молекула ацетил КоА, необходимая для реакции служит инициатором.
Образование малонил КоА:
1. Цитрат способен проходить через митохондриальную мембрану в цитоплазму. Митохондриальный ацетил КоА переносится на оксалоацетат с образованием цитрата, который может проходить через митохондриальную мембрану в цитоплазму с помощью системы переноса. В цитоплазме цитрат расщепляется до ацетил КоА, который взаимодействуя с углекислым газом превращается в малонил КоА. Лимитирующий фермент всего процесса синтеза жирных кислот – ацетил КоА-карбоксилаза.
2. Ацилпереносящий белок в синтезе жирных кислот служит своего рода якорем, к которому в ходе реакций образования алифатической цепи присоединяются ацильные промежуточные продукты. В митохондриях молекулы насыщенных жирных кислот удлиняются в форме эфиров КоА путем последовательного добавления КоА. Ацильные группы ацетил КоА и малонил КоА переносятся на тиоловые группы ацил-переносящего белка .
3. После конденсации этих двухуглеродных фрагментов идет их восстановление с образованием высших насыщенных жирных кислот.
Последующие этапы синтеза жирных кислот в цитоплазме сходны с реакциями обратными реакциям митохондриального b-окисления. Осуществление этого процесса со всеми промежуточными продуктами прочно связано с большим многоферментным комплексом – синтетазой жирных кислот.
Регуляция обмена жирных кислот.
Процессы обмена жиров в организме регулируются нейрогуморальным путем. Одновременно ЦНС и кора головного мозга осуществляют согласованность различных гормональных влияний. Кора головного мозга оказывает трофическое влияние на жировую ткань либо через симпатическую и парасимпатическую систему, либо через эндокринные железы.
Поддержание определенного соотношения между катаболизмом и анаболизмом жирных кислот в печени связано с воздействием метаболитов внутри клетки, а также влиянием гормональных факторов и потребляемой пищи.
При регуляции b-окисления первостепенное значение имеет доступность субстрата. Поступление жирных кислот в клетки печени обеспечивается:
1. захватом жирных кислот из жировой ткани, регуляция этого процесса осуществляется гормонами.
2. захват жирных кислот (обусловленных содержанием жиров в пище).
3. высвобождение жирных кислот под действием липазы из триглицеридов печени.
Второй контролирующий фактор – уровень запаса энергии в клетке (соотношение АДФ и АТФ). Если АДФ много (клеточные резервы энергии малы), то протекают реакции сопряжения, что способствует синтезу АТФ. Если содержание АТФ повышено, вышеупомянутые реакции тормозятся, накапливающиеся жирные кислоты используются для биосинтеза жиров и фосфолипидов.
Способность цикла лимонной кислоты катаболизировать ацетил КоА, образующийся при b-окислении имеет важное значение в реализации общего энергетического потенциала катаболизма жирных кислот, а также нежелательного накопления кетоновых тел (ацетоуксусная кислота, b -оксибутират и ацетон).
Инсулин усиливает биосинтез жирных кислот, превращение углеводов в жиры. Адреналин , тироксин и гормон роста активируют распад (липолиз) жира.
Снижение выработки гормонов гипофиза и половых гормонов приводит к стимуляции синтеза жиров.
Нарушения липидного обмена
1.Нарушение процессов всасывания жиров
а) недостаточность поступления панкреатической липазы
б)нарушение поступления в кишечник желчи
в)нарушение желудочно-кишечного тракта (повреждение эпителиального покрова).
2. Нарушение процессов перехода жира из крови в ткани – нарушается переход жирных кислот из хиломикронов плазмы крови в жировые депо. Это наследственное заболевание, связанное с отсутствием фермента.
3. Кетонурия и кетонемия- при голодании у лиц с диабетом содержание кетоновых тел повышено – это кетонемия. Оно состояние сопровождается кетонурией ( наличие кетоновых тел в моче). Ввиду необычно высокой концентрации кетоновых тел в притекающей крови мышцы и другие органы не справляются с их окислением.
4. Атеросклероз и липопротеиды. Доказана ведущая роль определенных классов липопротеидов в патогенезе атеросклероза. Формирование липидных пятен и бляшек сопровождается глубокими дистрофическими изменениями в пределах сосудистой стенки.
Холестерин
У млекопитающих большая часть (около 90%) холестерина синтезируется в печени. Большая часть его (75 %) используется при синтезе так называемых желчных кислот, помогающих перевариванию липидов, поступающих с пищей в кишечнике. Они делают их более доступными для гидролитических ферментов – липаз. Основной желчной кислотой является холевая кислота. Холестерин является также матаболическим предшественником других важных стероидов, многие из которых выступают в виде гормонов.: альдостерона и кортизона, эстрона, тестостерона и андростерона.
Нормальный уровень холестерина в плазме крови в пределах 150-200 мг/мл. Высокий уровень может привести к отложению холестериновых бляшек в аорте и мелких артериях, это состояние известно под названием артериосклероза (атеросклероза). В конечном счете он способствует нарушению сердечной деятельности. Поддержание нормального уровня холестерина осуществляется путем организации правильного режима питания, а также in vivo регуляцией пути ацетил-КоА. Один из способов снижения высокого уровня холестерина в крови заключается в приеме внутрь соединений, уменьшающих способность организма синтезировать холестерин. Холестерин синтезируется в печени и плазме крови, упаковывается в липопротеиновые комплексы, которые переносятся в другие клетки. Проникновение холестерина в клетку зависит от наличия мембранных рецепторов, связывающих такие комплексы, которые проникают в клетку путем эндоцитоза и затем лизосомные ферменты освобождают холестерин внутри клетки. У пациентов с высоким уровнем холестерина в крови были обнаружены дефектные рецепторы, это – генетический дефект.
Холестерин является предшественником многих стероидов, таких как стероиды кала, желчные кислоты и стероидные гормоны. При образовании стероидных гормонов из холестерина сначала синтезируется промежуточный продукт прегненолон, который служит предшественником прогестерона – гормона плаценты и желтого тела, мужских половых гормонов (тестостерона), женских половых гормонов (эстрона) и гормонов коры надпочечников (кортикостерона).
Главным исходным материалом для биосинтеза этих гормонов является аминокислота тирозин. Ее источник в клетках –
1. Протеолиз
2. Образование из фенилаланина (незаменимой АК)
Биосинтез стероидных гормонов несмотря на разнообразный спектр их действия, является единым процессом.
Центральное положение в биосинтезе всех стероидных гормонов занимает прогестерон.
Имеются 2 пути его синтеза:
Из холестерина
Из ацетата
В регуляции скоростей биосинтеза отдельных стероидных гормонов важнейшую роль играют тропные гормоны гипофиза. АКТГ стимулирует биосинтез кортикальных гормонов надпочечников.
Имеются 3 причины расстройства биосинтеза и выделения специфических гормонов:
1. Развитие патологического процесса в самой эндокринной железе.
2. Нарушение регуляторных влияний на процессы со стороны ЦНС.
3. Нарушение координации деятельности отдельных желез внутренней секреции.
Биосинтез холестерина.
Этот процесс насчитывает 35 стадий.
Можно выделить 3 основные:
1. Превращение активного ацетата в мевалоновую кислоту
2. Образование сквалена
3. Окислительная циклизация сквалена в холестерин.
Холестерин является предшественником многих стероидов:
Стероидов кала, желчных кислот, стероидных гормонов. Распад холестерина – это превращение его в желчные кислоты в печени.
Показано, что регуляция биосинтеза холестерина осуществляется путем изменения синтеза и активности b-гидрокси-b-метил глутарил КоА-редуктазы. Этот фермент локализован в мембранах эндоплазматической сети клетки. Его активность зависит от концентрации холестерина, приводит к снижению активности фермента. Регуляция активности редуктазы холестерином – пример регуляции ключевого фермента конечным продуктом по принципу отрицательной обратной связи.
Существует и второй путь биосинтеза мевалоновой кислоты.
Два автономных пути имеют значение для внутриклеточного разграничения биосинтеза холестерина необходимого для внутриклеточных нужд (синтез липопротеидов клеточных мембран) от холестерина, идущего на образование жирных кислот. В составе липопротеидов холестерин покидает печень и поступает в кровь. Содержание общего холестерина в плазме крови 130-300 мг/мл.
Молекулярные компоненты мембран.
Большинство мембран состоит примерно из 40% липида и 60% белка. Липидная часть мембран содержит преимущественно полярные липиды различных типов, практически все количество полярных липидов клетки сосредоточено в ее мембранах.
Большинство мембран содержит мало триацилглицеринов и стеринов, исключением в этом смысле являются плазматические мембраны клеток высших животных с характерным для них высоким содержанием холестерина.
Соотношение между различными липидами постоянно для каждого данного типа мембран клетки и, следовательно, определяются генетически. Большинство мембран характеризуется одинаковым соотношением липида и белка. Почти все мембраны легко проницаемы для воды и для нейтральных липофильных соединений, в меньшей степени проницаемы для полярных веществ, таких как сахара и амиды и совсем плохо проницаемы для небольших ионов, таких как натрий или хлор.
Для большинства мембран характерно высокое электрическое сопротивление. Эти общие свойства послужили основой для создания первой важной гипотезы относительно структуры биологических мембран – гипотезы элементарной мембраны. Согласно гипотезе, элементарная мембрана состоит из двойного слоя смешанных полярных липидов, в котором углеводородные цепи обращенных внутрь и образуют непрерывную углеводородную фазу, а гидрофильные головы молекул направлены наружу, каждая из поверхностей двойного слоя липидов покрыта мономолекулярным слоем белка, полипептидные цепи которого находятся в вытянутой форме. Общая толщина элементарной мембраны – 90 ангстрем, а толщина двойного слоя липидов – 60-70- ангстрем.
Структурное многообразие мембран больше, чем исходя из гипотезы элементарной мембраны.
Другие модели мембран:
1. Структурный белок мембраны находится внутри двойного слоя липидов, а углеводородные хвосты липидов проникают в свободные пространства между свернутыми полипептидными цепями белка.
2. Молекулы структурного белка проходят в определенных точках сквозь двойной слой липидов. Аминокислотные участки полипептидной цепи, находящиеся внутри углеводородной фазы, составлены преимущественно из гидрофобных АК.
3. Глобулярная – роль периодически повторяющихся структурных единиц играют небольшие глобулярные липопротеиды или липидные мицеллы, чередующиеся с молекулами глобулярного белка.
Конкретное сочетание липидов в той или иной мембране может определяться структурой мембранных белков, которая закодирована в соответствующих генах. Целостность этих исключительно тонких структур поддерживается только за счет гидрофобных и полярных взаимодействий.
Биомембраны:
В общую структуру мембраны включены поверхностные мембранные белки и интегральные мембранные белки, которые делятся на :
1-структурные и 2-динамические белки.
Мембранный транспорт:
Мембрана является полупроницаемой.
Пассивный транспорт – соединение движется через мембрану из района с высокой концентрацией в район с низкой концентрацией без затраты клеткой энергии – это диффузия.
Активный транспорт – происходит с затратой энергии. Перенос осуществляется против градиента концентрации.
Реакция живых клеток на воздействие различных типов биологически активных веществ, например, гормонов, начинается со связывания вещества с внешней поверхностью клеточной мембраны в специфическом месте поверхности, называемой рецепторами: например, рецептор ацетилхолина, инсулина.
На этой стадии происходит фосфорилирование фермента за счет АТФ и связывания внутриклеточного натрия. На второй стадии (стимулируется ионами калия), происходит гидролиз фосфорилированного фермента и ионы натрия высвобождаются на наружной стороне мембраны.
Большинство клеток содержит натриевый насос другого типа, откачивающий ионы натрия из клетки и обеспечивающий движущую силу для активного переноса аминокислот и глюкозы в клетку. Для систем активного переноса АК необходим в качестве источника энергии направленный внутрь клетки градиент ионов натрия. Большинство клеток содержит системы переноса сахаров. Глюкоза переносится в клетки при помощи переносчика, который переносит в клетку также ионы натрия.
Необходимо учитывать влияние размеров и вязких свойств мембраны, через которую осуществляется перенос. Толщина мембран обычно составляет 60-100 ангстрем. Эти размеры велики по сравнению с размерами молекулы глюкозы или АК (5-6 ангстрем) и даже молекул небольших глобулярных белков (25-35 ангстрем)
Как молекулы переносчики способны перемещать субстраты на такие большие расстояния?
Похожие работы
... – высокоаэробных.[6,2000] Показано, что ряд дегидрогеназ используют только НАД или НАДФ, другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них. В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновыми ферментами. Основными источниками никотиновой кислоты и ее ...
... формируются вдоль плазматической мембраны при захвате ЛП клетками с помощью специфических апо-В,Е-рецепторов. Этот путь транспорта ЛП направлен на обеспечение внутренних потребностей клеток в холестерине и не приводит к поступлению липопротеидных частиц в интиму артерий. Окаймлённые эндоцитозные везикулы, содержащие липопротеидные частицы, вступают в контакт и сплавляются с лизосомами, где ЛП ...
... 3) гепатодепрессии (печёночно-клеточной недостаточности, малой недостаточности печени, недостаточности синтетических процессов); 4) воспаления; 5) шунтирования печени; 6) регенерации и опухолевого роста. При подозрении на конкретную патологию учитываются основные биохимические синдромы, характерные для данного заболевания. За основу берётся стандартная программа функционального обследования, но ...
... кислоты, которые относят к незаменимым жирным кислотам (линолевая, линоленовая, арахидоновая), которые не синтезируются у человека и животных. С жирами в организм поступает комплекс биологически активных веществ: фосфолипиды, стерины. Триацилглицеролы – основная их функция – запасание липидов. Они находятся в цитозоле в виде мелкодисперсных эмульгированных маслянистых капелек. Сложные жиры : ...
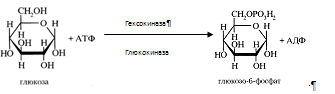
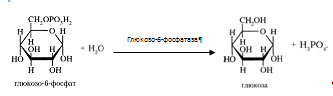
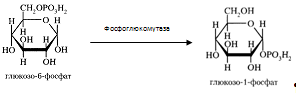

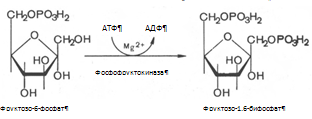
0 комментариев