Навигация
Особливості ведення вагітності та пологів у жінок із передчасним розривом плодових оболонок при недоношеній вагітності
МІНІСТЕРСТВО ОХОРОНИ ЗДОРОВ’Я УКРАЇНИ
НАЦІОНАЛЬНИЙ МЕДИЧНИЙ УНІВЕРСИТЕТ
імені О.О. БОГОМОЛЬЦЯ
ГОНЧАРУК НАТАЛІЯ ПЕТРІВНАУДК 618.3+618.5-06-08:618.446-007.251
ОСОБЛИВОСТІ ВЕДЕННЯ ВАГІТНОСТІ ТА ПОЛОГІВ
У ЖІНОК ІЗ ПЕРЕДЧАСНИМ РОЗРИВОМ ПЛОДОВИХ
ОБОЛОНОК ПРИ НЕДОНОШЕНІЙ ВАГІТНОСТІ
14.01.01 — акушерство та гінекологія
Авторефератдисертації на здобуття наукового ступеня
кандидата медичних наук
Київ - 2008
Дисертацією є рукопис
Робота виконана в Національному медичному університеті імені О.О. Богомольця МОЗ України
Науковий керівник: доктор медичних наук, профессор Лакатош Володимир Павлович, Національний медичний університет імені О.О. Богомольця МОЗ України, професор кафедри акушерства і гінекології № 1
Офіційні опоненти: доктор медичних наук, професор Дашкевич Валентина Євдокимівна, ДУ “Інститут педіатрії, акушерства і гінекології АМН України”, завідувачка акушерського відділення екстрагенітальної патології та постнатальної реабілітації
доктор медичних наук, професор Бенюк Василь Олексійович, Національний медичний університет імені О.О. Богомольця МОЗ України, завідувач кафедри акушерства і гінекології № 3 з курсом дитячої гінекології
Захист дисертації відбудеться 19.06.2008 р. о_13-30_годині на засіданні спеціалізованої вченої ради Д26.003.03 при Національному медичному університеті імені О.О. Богомольця МОЗ України за адресою: 01030, м. Київ, бульвар Т. Шевченка, 17
З дисертацією можна ознайомитись у бібліотеці Національного медичного університету імені О.О. Богомольця МОЗ України за адресою: 03057, м. Київ, вул. Зоологічна, 1.
Автореферат розісланий 18.05. 2008 р.
Вчений секретар спеціалізованої вченої ради
кандидат медичних наук, доцент Я.М. Вітовський
ЗАГАЛЬНА ХАРАКТЕРИСТИКА РОБОТИ
Актуальність теми. Нині частота передчасних пологів (ПП) у різних регіонах України становить від 3 до 12 % (Писарева С.П., 2005; Сорокін О.В., 2006; Макаро-ва О.В., 2007), що збігається із частотою ПП у всьому світі (Steer P., 1999; Gillian D., 2000). Однією з фундаментальних причин виникнення ПП є передчасний розрив плодових оболонок (ПРПО). У сучасному акушерстві прослідковується тенденція до збільшення частоти ПРПО у структурі ПП. Так, за даними літератури, цей показник у 2000—2002 рр. становив від 34,9 до 56 % (Добровольська Л.М., 2000; Дринь Т.М., 2002; Макарова О.В., 2007). Дискусійним серед вчених є питання ведення недоношеної вагітності, ускладненої ПРПО. У літературі виділяють два основні тактичні напрями ведення жінок із цією патологією вагітності. До одного з них належать прихильники очікувальної тактики ведення таких вагітних. На противагу цьому прихильники іншого напряму — активного — вважають, що вагітним після ПРПО необхідно негайно проводити індукцію пологів (Дринь Т.М., 2003) і вказують на високу частоту розвитку при очікувальній тактиці клінічно прихованого хоріоамніоніту і/ або внутрішньоутробної інфекції плода (Соколова Н.И., 1989; Дринь Т.М., 2003). Ведення вагітності, ускладненої ПРПО, на фоні ПП ставить перед лікарем цілу низку складних питань: на скільки необхідно пролонгувати вагітність, щоб уникнути таких ускладнень, як респіраторний дистрес синдром (РДС), внутрішньочерепні крововилиття, інфекції у матері й дитини, травмування пологових шляхів у матері; які призначати антибактеріальні препарати і за якими схемами; на яких термінах вагітності необхідно проводити антенатальну профілактику РДС і багато інших питань. Отже, створюється враження безвиходу такої ситуації. Тому виникає практична потреба в розробленні і впровадженні у практику раціональної системи ведення вагітності та пологів при недоношеній вагітності, ускладненою ПРПО.
Зв’язок роботи з науковими програмами, планами, темами. Дисертаційну роботу виконано згідно із планом роботи кафедри акушерства та гінекології № 1 Національного медичного університету імені О.О. Богомольця МОЗ України (номер держреєстрації 0198V003086), шифр державної програми І.Н. 20.00.00.16.98.
Мета дослідження — зниження частоти перинатальної смертності й захворюваності новонароджених, частоти гнійно—септичних захворювань у породіль в післяпологовому періоді розробленням раціональної системи ведення і родорозродження вагітних із ПРПО при недоношеній вагітності на основі вивчення функції фетаплацентарного комплексу мікробіоценозу статевих шляхів та імунного гомеостазу.
Завдання дослідження
1. Встановити частоту і структуру основних причин ПРПО при недоношеній вагітності за даними медичної документації Правобережного центру передчасних пологів м. Києва (КМПБ № 7).
2. Дослідити якісний і кількісний склад мікрофлори пологових шляхів, навколоплодових вод залежно від тривалості безводного періоду при вагітності 28—37 тижнів.
3. Комплексно і в динаміці дослідити показники клітинного та гуморального імунітету у вагітних із ПРПО з урахуванням тривалості безводного періоду.
4. Вивчити рівні антикардіоліпінів класів IgM i IgG, як маркерів антифосфоліпідного синдрому у вагітних із ПРПО при недоношеній вагітності.
5. Провести ультраструктурні дослідження провізорних органів (плаценти, плодових оболонок) у жінок при ПРПО на фоні ПП.
6. Розробити і обґрунтувати метод ведення вагітності й пологів у терміні 28—37 тижнів при ускладненні її ПРПО.
7. Проаналізувати стан дітей, народжених від матерів з недоношеною вагітністю, ускладненою ПРПО.
Об’єкт дослідження. Перебіг вагітності у жінок із ПРПО при недоношеній вагітності.
Предмет дослідження. Мікробіоценоз цервікального каналу та амніотичних вод, імунний статус, морфологічні зміни тканин плаценти, амніотичних оболонок, стан плода і новонароджених немовлят у жінок із недоношеною вагітністю й ПРПО.
Методи дослідження. Клінічні, епідеміологічні, імунологічні, морфологічні, апаратні, імуногістологічні, математично-статистичні.
Наукова новизна отриманих результатів. Вперше визначено особливості перебігу вагітності та пологів у жінок із ПРПО з урахуванням основних етіологічних чинників та їхніх патогенетичних зв’язків із розвитком акушерських ускладнень. Проведено комплексне вивчення стану фетоплацентарного комплексу вагітних із ПРПО на підставі ультразвукових доплерометричних, кардіотокографічних, імунологічних, морфологічних методів дослідження.
Доведено, що доплерометрія матково-плацентарного, плацентарно-плодового і плодового кровообігів в антенатальній діагностиці має суттєві переваги в оцінці внутрішньоутробного стану плода при недоношеній вагітності з ПРПО порівняно з кардіотокографією і визначенням біофізичного профілю плода. Встановлено частоту і спектр мікробної флори виділень із цервікального каналу та навколоплодових вод у жінок із ПРПО при недоношеній вагітності.
Вперше в імунопатогенезі ПРПО при недоношеній вагітності встановлено дисфункцію клітинної, гуморальної та цитокінової ланок системи імунітету. Спостерігалися тенденція до підвищення продукції інтерлейкіну-2 (ІЛ) і значне зниження цитокінів із супресивними властивостями: ІЛ-4 та ІЛ-10, що свідчить на користь активації Т-хелперів 1-го типу і пригнічення гуморальної відповіді, зумовленої активацією Т-хелперів 2-го типу.
Вперше представлено варіанти ультраструктурного ушкодження плаценти та амніотичних оболонок залежно від тривалості безводного періоду. Встановлено, що в амніоні ультраструктурні порушення розвиваються більшою мірою, ніж у плаценті, та набувають деструктивно дистрофічний локалізований характер.
Удосконалено комплекс лікувально-профілактичних заходів, спрямованих на зниження частоти акушерських і перинатальних ускладнень, які визначають можливість пролонгування недоношеної вагітності, ускладненої ПРПО.
Практичне значення отриманих результатів. При обстеженні групи жінок із ПРПО доведено, що мікроскопічна діагностика не задовольняє потреби практичної охорони здоров’я, а потребує обов'язкового бактеріологічного дослідження, яке повинно проводитись з визначенням колонієутворюючих одиниць (КУО/мл) умовно-патогенної мікрофлори. При мікробіологічному дослідженні навколоплідних вод доведено, що інфікування матері та дитини можливе при титрі концентації мікроорганізмів ≥102 КУО/мл. Визначено, які мікроорганізми умовно-патогенної мікрофлори і у яких титрах можуть бути факторами ризику захворювань матері й дитини, що може застосовуватись як фактори підвищеного ризику з розвитку хоріоамніоніту та інфекційних ускладнень у дитини.
Запропоновано діагностичні критерії, що визначають можливість подальшого пролонгування недоношеної вагітності, ускладненої ПРПО, на фоні тривалого безводного періоду.
На основі порівняння клінічних, імунологічних, бактеріологічних, гістологічних та антенатальних апаратних методів дослідження розроблено та обґрунтовано новий алгоритм заходів при веденні недоношеной вагітності, ускладненої передчасним злиттям навколоплідних вод.
Особистий внесок здобувача. Усі положення, винесені на захист, розроблені здобувачем особисто. У процесі роботи особисто здобувачем обрано тему, визначено мету, сформульовано завдання та напрями проведення досліджень. Здобувачем особисто проведено клініко-статистичний аналіз, забір матеріалу для бактеріологічних, імунологічних, електронно-мікроскопічних досліджень, аналіз основних показників стану плода, розродження у клініці таких вагітних. Здобувачем узагальнено та систематизовано отримані результати і проведено їх математичну обробку, сформульовано висновки, науково обґрунтовано практичні рекомендації, підготовлено до друку наукові праці, виступи.
Співавторство інших дослідників у наукових роботах, надрукованих за матеріалами дисертації, полягало у консультативній допомозі та участі у лікувально-діагностичному процесі. Разом з науковим керівником сформульовано основні положення, висновки та рекомендації для впровадження у практику.
Апробація результатів дисертації. Основні положення дисертації оприлюднено на X з’їзді Асоціації акушерів гінекологів України (Донецьк, 2007 р.), науково-практичній конференції з міжнародною участю “Фізіологія і патологія новонароджених” (Київ, 2007 р.).
Публікації. За матеріалом дисертації опубліковано 7 наукових праць, з них у провідних наукових журналах, рекомендованих ВАК України, — 5, в матеріалах і тезах конференцій — 2.
Структура і обсяг дисертації. Дисертаційна робота викладена на 178 сторінках машинопису і складається зі вступу, огляду літератури, матеріалів і методів дослідження, 8 розділів власних досліджень, обговорення результатів, висновків та списку використаних джерел, який включає 130 вітчизняних та російськомовних джерел, а також 154 зарубіжні джерела. Робота ілюстрована 29 таблицями, 22 рисунками і діаграмою.
ОСНОВНИЙ ЗМІСТ РОБОТИ
Матеріали і методи дослідження. З метою встановлення частоти ПРПО при ПП були проведені клініко-статистична обробка 200 історій ПП у терміні 28—37 тижнів та клінічне спостереження з аналізом факторів перинатального ризику 123 недоношених новонароджених з ПРПО за даними медичної документації Правобережного центру передчасних пологів м. Києва (КПМБ № 7).
Клініко-параклінічне обстеження проведено у 120 вагітних у терміні гестації 28—37 тижнів, перебіг вагітності у яких ускладнився ПРПО (основна група), із них у 42 жінок пологи відбулися протягом 24 год безводного періоду на фоні хоріоамніоніту (1-ша група) та у 78 обстежених вагітність пролонгувалась на фоні тривалого безводного періоду — понад 24 год (2-га група) без ознак хоріоамніоніту. Контрольну групу склали 80 вагітних жінок із неускладненим перебігом вагітності в терміні 28—37 тижнів.
Комплекс лікувально-профілактичних заходів у жінок в обох групах був однотипний: токолітичну терапію проводили за показаннями до 34-го тижня вагітності; антибактеріальну терапію застосовували залежно від терміну вагітності, клінічного стану вагітної або роділлі, методів розродження, які використовували (призначались напівсинтетичні пеніциліни або цефалоспорини II генерації у середніх терапевтичних дозах з моменту госпіталізації продовж 5—7 діб за відсутністю ознак інфекції у матері. В разі розвитку хоріоамніоніту в лікувальному режимі призначались цефалоспорини III—IV генерацій і метронідазол (чи орнідазол) за 30 хв до введення цефалоспоринів. У випадку оперативного розродження проводили інтенсивну антибактеріальну терапію: 2 антибіотики і метронідазол або орнідазол у лікувальному режимі не менше 7 діб, або призначались препарати за індивідуальною чутливістю мікроорганізмів, яка визначалась при бактеріологічному дослідженні. В разі розвитку пологової діяльності пологи не блокувались, а велись як передчасні.
Профілактику РДС плода здійснювали до 34 тижнів вагітності призначенням глюкокортикоїдів одноразово протягом 2 діб (дексаметазон по 6 мг, на курс 24 мг), повторні курси не проводили.
В умовах стаціонару вагітних повністю клінічно обстежували за загальноприйнятими методиками, проводили апаратні методи дослідження функціонального стану плода: КТГ, УЗД, доплерометрія матково-плацентарного кровотоку.
Бактеріологічне дослідження з визначенням чутливості до антибіотиків проводили кожні 7 діб. Матеріали забирали із цервікального каналу, а також із навколодових вод. Мікроскопічне дослідження виділень із цервікального каналу також здійснювали кожні 7 діб.
Мікробіологічне дослідження включало такі етапи: виключення захворювань, що передаються статевим шляхом, мікроскопія мазка з піхви, зафарбованого за Грамом, посів із піхви виділень проводили на факультативно-анаеробну та облігатну флору умовно-патогенних мікроорганізмів. При кількісній характеристиці мікрофлори були застосовані критерії R.P. Nugent та співавт. (1991), модифіковані А.С. Анкирською (1996). Якісна оцінка мікрофлори включала диференціацію усіх морфотипів за їхніми морфологічними ознаками. Для оцінки факультативно-анаеробної частини мікробіоценозу застосовували 5%-й кров'яний агар, середовище для генітальних мікоплазм, середовище Сабуро (для грибів), середовище МРС (для лактобацил). Забір матеріалу в перший раз проводили тоді, коли вагітні поступали у клініку, до призначення антибіотиків, під час огляду в дзеркалах.
Матеріалом імунологічних досліджень була периферійна кров, яку брали натщесерце. Визначали вміст циркулюючих імунних комплексів (ЦІК) за методом Digeon (1977), рівень імуноглобулінів (Ig) A, M, G — за методом G. Mancini (1965), поглинальну активність (ПФ — показник фагоцитозу та ФЧ — фагоцитарне число) нейтрофілів (Нф) і моноцитів (Мц) з частинками латексу (1,5 мкм) — за методом Т.І. Івчик, функціональну активність — за здатністю клітин відновлювати нітросиній тетразолій (НСТ) у спонтанному тесті (сНСТ), ФР — функціональний резерв оцінювали за різницею спонтанного та індукованого пірогеналом (1,25 мкг/мл) тестів. Фенотипування лімфоцитів з антигенними детермінантами CD3+(Т-лімфоцити), CD4+(Т-хелпери), CD8+(Т-супресори), CD16+(природні кілери), CD19+(В-лімфоцити), CD25 (ІЛ—2—рецептор на активних клітинах) проводили на приладі FACSCAN (фірма “Becton Dickinson”, США) з використанням моноклональних антитіл фірми “Bioprobe BW” (Голландія) згідно з інструкцією виробника. Вміст С-реактивного протеїну (СРП) в сироватці крові визначали з використанням імуноферментних тест-систем фірми “Diagnostic і Automation” (Канада).
Стан системи інтерферону (ІФН) оцінювали за показниками ІФН-статусу організму в культурі клітин периферійної крові, визначали рівень продукції in vitro ІФН у відповідь на індукцію фітогемаглютиніну (ФГА) та ІФН-a у відповідь на індукцію вірусом хвороби Ньюкастла (штам Канзас), а також вміст ІФН у сироватці крові. ІФН титрували в диплоїдній культурі клітин людини М-19 з використанням вірусу везикулярного стоматиту (штам Індіана) як тест-вірус. За одиницю активності ІФН приймали величину, зворотну максимальному розбавленню, яке затримує цитопатичну дію тест-вірусу на 50 % (Современные методы диагностики ..., 1994).
Біологічну активність фактора некрозу пухлин (ФНП) у культуральному середовищі клітин периферійної крові, стимульованих ліпополісахаридом (стимульований тест), і відсутності стимуляції (спонтанний тест) оцінювали за загальноприйнятою методикою (С.С. Григорян и др.,1998).
Вміст ІЛ-2, ІЛ-4, ІЛ-10 визначали за методом імуноферментного аналізу з використанням тест-систем “ProCon” (Росія) та “Amersham” (США) у супернатантах МНПК, які отримували після 24 год інкубації при 37 °С (концентрація клітин у культуральному середовищі становила 1,5 млн в 1 мл).
Рівень антикардіоліпінових антитіл (аКЛ) у сироватці крові вагітних визначали імуноферментним методом з використанням тест-системи ORCENTEC фірми “Diag-nostica GmbH” (Німеччина).
Матеріалом для електронно-мікроскопічного дослідження була материнська частина плаценти й амніотична оболонка породіль.
Матеріал після подрібнення фіксували у 2,5%-му розчині глютарового альдегіду на фосфатному буфері протягом 1 год з наступною дофіксацією ОsO4 за Мілонінгом. Матеріал зневоднювали і вміщували у суміш епону та аралдиту згідно із загальноприйнятими електронно-мікроскопічними методиками. Після попередньої ідентифікації на напівтонких зрізах, зафарбованих толуїдиновим синім, виготовляли ультратонкі зрізи, які контрастували уранілацетатом і цитратом свинцю. Матеріал вивчали в електронному мікроскопі ПЕМ-125К і фотографували при збільшенні 4—12 тис. раз.
Отримані дані обробляли з використанням статистичних методів кореляційного регресійного аналізу, непараметричних методів аналізу із застосуванням персонального комп’ютера “Pentium-550” з програмами “STATISTICA for Windows”, “Microsoft Word 2000”.
Графіки і діаграми будували за допомогою програми “Microsoft Excel 2000”.
Результати досліджень та їх обговорення. Під час аналізу послідовного розподілу випадків ПП виявлено, що у 42,4 % основною причиною був ПРПО.
При аналізі 120 історій пологів підтверджено закономірність, за якою частота ПРПО при ПП припадає на нічні години з піком від 2.00 до 6.00, тобто має місце хронологічний ритм цього ускладнення вагітності.
Середній вік жінок основної групи дорівнював 27,66 ± 5,77 років, контрольної — 25,87 ± 5,9 років, тобто суттєвої, статистично достовірної різниці між групами не було (Р > 0,05).
Майже половина жінок контрольної групи мали першу вагітність й перший раз народжували, тоді як в основній групі переважали жінки з повторними вагітностями, які перший раз народжували. Значна кількість досліджуваних жінок основної групи в анамнезі мала медичні (55,8 %) або мимовільні аборти (9,1 %) порівняно з контрольною групою (відповідно 40 і 6,25 %) чи ПП від 26 до 32 тижнів.
Під час аналізу анамнестичних даних не було виявлено істотної різниці між групами стосовно початку менструальної функції і статевого життя. У 65 % жінок основної і 43,75 % контрольної груп мали місце гінекологічні захворювання.
Серед гінекологічних захворювань в основній групі порівнянно з контрольною переважали кольпіт — 48,3 і 20 % відповідно (P < 0,05), патологія шийки матки (ШМ) — 24,1—12,5 % відповідно (P < 0,05) і порушення менструального циклу — 23,3—3,75 % відповідно (P < 0,05). Також 10,8 % жінок основної групи мали специфічні захворювання геніталій, тоді як в контрольній групі вони були відсутні.
При аналізі характеру екстрагенітальної патології відмічено наявність доволі великого відсотка (38,3 %) хронічних вогнищ захворювання з латентним перебігом у жінок із ПРПО при недоношеній вагітності: хронічний пієлонефрит, хронічний тонзиліт. Також досить часто (12,5 %) траплялася патологія щитоподібної залози. Майже кожна друга обстежена з цієї групи мала загрозу переривання вагітності на тому чи іншому терміні, кольпіт (48,3 % в анамнезі, в той час як при обстеженні виявлено у 60 %). У цих жінок відмічено доволі великий відсоток анемії — 20 % й інфекційних ускладнень під час цієї вагітності: гостра респіраторно-вірусна інфекція (ГРВІ), пієлонефрит вагітних, носійство патогенного стафілокока.
При ПРПО пологи частіше ускладнювались слабкістю пологової діяльності (32,1 %), передчасним відшаруванням нормально розташованої плаценти (11,2 %), гіпоксією плода (32,1 %), дефектом плацентарної тканини (12 %). У 84,3 % жінок пологи завершились самостійно, а у 15,7 % тактика була вирішена на користь кесаревого розтину.
Привертає увагу доволі висока частота септичних захворювань у жінок із ПРПО : хоріоамніоніт у пологах — 10,6 %, післяпологовий ендометрит — у 8,95 % жінок, субінволюція матки — у 13,05 %, нагноєння епізіотомних розтинів — у 8,0 % жінок із ПРПО і недоношеною вагітністю, тобто у кожної четвертої породіллі спостерігали різні форми інфекції. При непорушеному амніоні ці нозологічні форми виникали в 2—3 рази рідше — відповідно у 0,05; 2,3; 4,01 і 3,05 % жінок (P < 0,05).
Отже, основними чинниками ПП, ускладнених ПРПО, є хронологічні, сезонні, соціальні й медичні фактори ризику. Супутня соматична патологія у таких жінок, ймовірно, формує сприятливий фон для порушення компенсаторно-адаптаційних процесів і полегшує розгортання інфекційних захворювань у матері та дитини.
При порівнянні мікробіоцинозу цервікального каналу у жінок з нормальним перебігом недоношеної вагітності і ускладненої ПРПО виявлено значні відмінності у їхньому кількісному і якісному складі. Як у вагітних контрольної групи, так і у вагітних із ПРПО виявляли значну заселеність цервікального каналу аеробними і анаеробними бактеріями, вірусами, простійшими й дріжджовими грибами.
Для здорових вагітних характерно було домінування лактобацил у вагінальних виділеннях у 100 % випадків (107 КУО/мл), кількість умовно-патогенної мікрофлори не перевищувала 102 КУО/мл.
У групі жінок із ПРПО ми знаходили проміжний варіант мікроценозу виділень із цервікального каналу, за якого умовно-патогенна мікрофлора досягала помірної кількості (105 КУО/мл), а при розвитку хоріоамніоніту визначали клініку неспецифічного вагініту, яка характеризувалася відсутністю росту лактобацил (або їхня кількість була мінімальною — 104 КУО /мл); ріст умовно-патогенної мікрофлори був у високому титрі (107 КУО/мл). Аналіз мікробіологічного складу навколоплодових вод показав, що під час розвитку хоріоамніоніту провідну роль відіграє кількість умовно-патогенних мікроорганізмів у навколоплодових водах ³ 102 КУО/мл. Крім того, зазначено, що мікроорганізми асоціювалися між собою, що підвищувало ризик реа- лізації інфекції як у матері, так і у дитини. Дослідження бактеріального складу мікробіоценозу цервікального каналу у жінок із ПРПО при недоношеній вагітності підтвердило, що видовий склад мікробіоценозу цервікального каналу у жінок із ПРПО і хоріоамніонітом значно менший, ніж в основній групі з ПРПО. Головними передставниками такого мікробіоценозу є: Streptococcus A та B (25—37 %), Esсherichia coli (37 %), Gardnerella vag. (35 %), Fusobacterium (40 %), Peptostreptococcus (45 %), Bacteroides (34 %), Stafilococcus aureus (16 %), Proteus mirabilis (10 %). Це означає, що виявлення у пологових шляхах вагітних із ПРПО вищенаведених мікроорганізмів є прогностичним фактором ризику розвитку септичних ускладнень матері й плода. І обов’язково має враховуватися лікарем у разі призначення антибактеріальної терапії.
Оцінку стану внутрішньоутробного плода проводили з використанням КТГ, УЗД, доплерометрії. Порівняльний аналіз оцінки стану внутрішньоутробного плода показав значну перевагу доплерометрії порівняно з КТГ і біофізичним профілем плода на фоні недоношеності, ускладненої ПРПО. Доплерометрія стану плода дає змогу розробити диференційований підхід до лікування, оцінити застосовану терапію та визначити оптимальний термін пологорозроджнення.
Проведення імунологічних досліджень у жінок із ПРПО показало підвищення Т-лімфоцитів (CD3+) і природних кілерів (CD16+) порівняно з групою здорових вагітних. Збільшеною відносно показника останніх була кількість лімфоцитів з активаційним маркером CD25, В-лімфоцитів. У жінок із ПРПО спостерігали також зростання імунорегуляторного індексу CD4+/CD8+ (Р < 0,05) відносно контрольного показника за рахунок підвищення відносної кількості Т-хелперів (CD4+) і зменшення Т-супресорів (CD8+) порівняно з даними здорових вагітних. Найзначніші відхилення від контрольних показників було виявлено у жінок, в яких пологи відбулися протягом 24 год безводного періоду (1-ша група). Спостерігали істотне збільшення відносної кількості Т-лімфоцитів (CD3+), Т-хелперів (CD4+), природних кілерів (CD16+) та CD25+-клітин порівняно з показниками здорових вагітних (Р < 0,05).
При дослідженні киснезалежного метаболізму Нф і Мц у вагітних із ПРПО спостерігали підвищення спонтанного та індукованого НСТ-тестів фагоцитів на фоні зниження їхнього ФР. У вагітних 2-ї групи, у котрих вагітність пролонгувалась із тривалим безводним періодом, показники НСТ-тестів відрізнялись від норми меншою мірою, ніж у вагітних 1-ї групи. Резервні можливості Мц і Нф у жінок 2-ї групи змінювались у бік збільшення, а у 1-ї групи були значно зниженими (Р < 0,05). У вагітних із ПРПО відзначено зростання відносно контрольних параметрів показників фагоцитозу — ПФ і ФЧ, що свідчить на користь посилення функціональної активності Мц і Нф.
У вагітних із ПРПО значно підвищувався рівень ЦІК. Найбільше відхилення від норми (на 63,5 %) виявлено у жінок 1-ї групи. Дослідження вмісту імуноглобулінів основних класів (A, M, G) у вагітних із ПРПО не виявило суттєвих відхилень від норми рівнів IgG та IgА, лише рівень IgМ перевищував контрольний показник. У 1-й групі вагітних спостерігали підвищення не лише рівня IgМ, а й IgА, що вказує на більший ступінь запалення.
У вагітних із ПРПО було виявлено підвищення концентрації цитокінів, які відповідають за клітинну імунну відповідь. Істотно збільшеним відносно групи контролю у вагітних із ПРПО був вміст сироваткового ІФН (у 8,7 і 7,8 раза, відповідно у жінок 1-ї та 2-ї груп) (рис. 1), а високий рівень ІФН в сироватці крові може порушувати нормальний розвиток плацентації з обмеженням інвазії трофобласта та спричинювати на ембріон пряму токсичну дію. Дослідження рівня ФНП за індексом цитотоксичності дало змогу встановити дворазове його підвищення у вагітних із ПРПО відносно групи контролю. Найбільше зростання виявлено у вагітних 1-ї групи (на 126,3 %), у пацієнток 2-ї групи — на 87,8 % (рис. 1). Підвищення рівня ІФН і ФНП, з одного боку, може засвідчити напруженість імунітету, зростання запальних процесів, з іншого — про активацію Т-хелперів 1-го типу, що призводить до синтезу прозапальних цитокінів та порушенню ендокринно-імунних взаємозв’язків in situ у системі мати—плід.
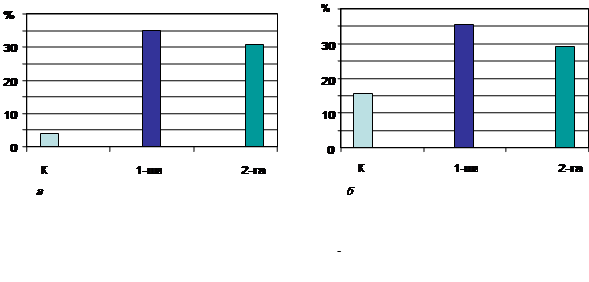
Рис. 1. Рівень ІФН (а) і ФНП (б) у сироватці крові вагітних із ПРПО.
Групи вагітних: 1-ша — пологи відбулися протягом 24 год безводного періоду; 2-га — вагітність пролонгувалась із тривалим безводним періодом; К — контрольна група (здорові вагітні). * Р < 0,05 відносно групи здорових вагітних
Прозапальні цитокіни здатні брати участь в індукції синтезу білків гострої фази, які також виконують функції медіаторів імунної системи. Аналіз даних щодо концентрації СРП у сироватці крові вагітних із ПРПО виявив дворазове його підвищення: у 53,3 % жінок був зареєстрований високий рівень (у середньому — 8,4 ± 1,1 мг/л), у решти жінок визначали нормальний (до 3 мг/л) рівень СРП (1,8 ± 0,2 мг/л). Одна половина жінок 2-ї групи мала нормальний рівень СРП (1,5 ± 0,3 мг/л), друга — підвищений (7,5 ± 1,2 мг/л). У 55,5 % вагітних 1-ї групи виявлено підвищений рівень СРП (9,0 ± 1,3 мг/л), у решти — нормальний (у середньому — 2,0 ± 0,5 мг/л).
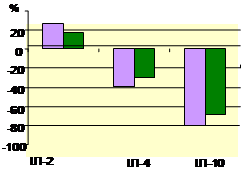
При дослідженні цитокінпродукуючої здатності мононуклеарів крові було виявлено дисбаланс про- й протизапальних цитокінів: спостерігали тенденцію до підвищення продукції ІЛ-2 (на 26,5 % у жінок 1-ї групи і на 16,9 % у жінок 2-ї групи) й значне зниження синтезу цитокінів із супресивними властивостями — ІЛ-4 та ІЛ-10 у пацієнток із ПРПО, найбільші відхилення рівнів цих інтерлейкінів виявлено у жінок 1-ї групи (рис. 2).
 | |||||
| |||||
| |||||
Рис. 2. Продукція цитокінів мононуклеарами крові у вагітних із ПРПО (% відхилення від контролю). Групи вагітних: 1-ша (а) — пологи відбулися протягом 24 год безводного періоду; 2-га (б) — вагітність пролонгувалась із тривалим безводним періодом. * Р < 0,05 відносно групи здорових вагітних
Зростання активності СD4+ Т-лімфоцитів 1-го типу може призвести до зміни спрямованості імунної відповіді з гуморальної на клітинну та провокувати зрив вагітності й ПП.
Вивчення вмісту аКЛ-антитіл у сироватці крові вагітних із ПРПО дало змогу виявити підвищення рівня аКЛ—антитіл класу IgG в 97,3 % випадків та аКЛ-IgM-антитіл у 86,7 % порівняно з групою здорових вагітних, але їхній рівень залишався в межах нормальних величин (для IgG < 10 U/ml та для IgM < 7 U/ml).
Після проведення комплексу лікувальних заходів, спрямованих на пролонгування вагітності на фоні безводного терміну, у жінок 2-ї групи було виявлено тенденцію до зменшення порівняно з початковими даними кількості Т-лімфоцитів (CD3+), CD8+-клітин, нормалізацію кількості CD4+-Т-хелперів і зниження індексу CD4+/CD8+. Значне зменшення кількості СD25+-клітин свідчило на користь зменшення активації Т-лімфоцитів (СD4+ та СD8+). Показники НСТ-тестів Мц знизились (Р < 0,05), а Нф майже не змінювались на фоні збереження ФР фагоцитів. При аналізі показників, що характеризують фагоцитарну активність Мц і Нф, не виявлено значних змін порівняно з вихідними даними. При вивченні динаміки показників гуморальної ланки імунітету було встановлено зниження рівня ЦІК у бік норми, незначне зменшення вмісту IgG та IgМ. Рівень СРП у цілому по групі не змінювався, але при аналізі показників з початково високим і нормальним рівнями було встановлено деякі відмінності: значно підвищений рівень знижувався з 7,5 ± 1,2 до 3,9 ± 0,4 мг/л (Р < 0,05), а нормальний рівень СРП (у середньому 1,5 ± 0,3 мг/л) майже не змінювався або іноді зростав в межах норми. Занадто високий рівень сироваткового ІФН знизився в 1,55 раза, рівень ФНП — на 32,5 % від початкового рівня і наблизився до норми (Р < 0,05). Проведення комплексу заходів сприяло зменшенню активації Тh1-клітин, про що засвідчує нормалізація балансу основних цитокінів: спостерігали тенденцію до зниження спонтанної продукції ІЛ-2, зростання продукції ІЛ-10 й підвищення майже до контрольних величин продукції ІЛ-4. Встановлено тенденцію до зниження рівня IgG-аКЛ-антитіл і IgМ-аКЛ-антитіл у сироватці крові порівняно з їхнім початковим рівнем (Р < 0,05), що є свідченням зменшення запального стану в організмах вагітних (рис. 3).
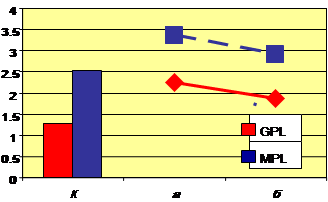
Рис. 3. Рівень аКЛ у сироватці вагітних 2-ї групи в динаміці лікування: а — до початку лікування; б — через 72 год і більше після лікування; К — контрольна група (здорові вагітні); GPL — імуноглобулін G кардіоліпінів; MPL — імуноглобулін M кардіоліпінів; * Р < 0,05 відносно групи здорових вагітних
Таким чином, під впливом застосованих заходів, спрямованих на пролонгування вагітності, спостерігали зменшення клітинноопосередкованих імунних реакцій, які забезпечуються Т-лімфоцитами, макрофагами/моноцитами й природними кілерами. Слід зазначити, що у жінок із тривалим безводним періодом на фоні проведеної антибактеріальної терапії результати імунологічних досліджень засвідчують зменшення системного запалення, оскільки спостерігали зниження рівня СРП у вагітних із найвищим його значенням.
При електронно-мікроскопічному дослідженні плацент встановлено, що в усі досліджені терміни безводного періоду (від 5—6 до 216 год) термінальні ворсинки 33—34-х тижневих плацент мали типову для цього терміну вагітності будову. Вони покриті одношаровими багатоядерними клітинами — синцитіотрофобластами, які в різних ділянках мають ультраструктурні особливості, що відображує різний функціональний стан і ступінь зрілості цих клітин. Доволі часто синцитіотрофобласти контактують з цитотрофобластами. Останні демонструють ультраструктурні ознаки функціональної активності без ознак дегенерації, що, швидше за все, пов’язано саме з незрілістю послідів, які досліджували. Для цитотрофобласта характерна наявність великої кількості надто тонких фібрил, які завдяки конформаційним перебудовам перетворюються у компоненти фібриноїда, який може частково накопичуватися як у цитоплазмі цих клітин, так і за їх межами. Досить щільно до синцитіотрофобласта, а у деяких місцях і до цитотрофобласта прилягають судини гемомікроциркуляторного русла, які формують гематоплацентарний бар’єр. У місцях контакту цитоплазми синцитіотрофобласта і ендотеліоцитів істотно стоншуються. У синцитіотрофобласта залишається невелика смужка з мікроворсинками.
Прогресування ультраструктурних змін у всіх цих структурах відбувалося поступово в динаміці пролонгування безводного періоду і носило зазвичай зворотний характер. Через 45 год безводного періоду у лакулярних порожнинах крім формених елементів подекуди спостерігали клітинний детрит частково десквамованого синцитіотрофобласта. Відзначено також незначний відсоток дистрофічно змінених цитотрофобластів. У таких клітинах характерними були цитоліз, локальний набряк мітохондрій, розширення канальців ендоплазматичної сітки і фігури мієлінової дегенерації. Незначна кількість судин гемомікроциркуляторного русла мала ушкодження, які засвідчують наявність у цей термін спостережень гіпоксичних та ішемічних змін, що розвинулись на фоні компенсаторно-адаптивних процесів. До останніх можна віднести стоншення ендотелію з метою ефективнішого переносу речовин. Водночас у просвітах деяких мікросудин спостерігали сладж-феномен, тобто скупчення еритроцитів і тромбоцитів аж до утворення тромбу. через 9 діб безводного періоду цитоплазма синцитіотрофобластів була електроннощільною, тоді як цитотрофобласти мали просвітлену цитоплазму. Останнє, швидше за все, є ультраструктурним проявом набряку, який був властивий і ендотеліальним клітинам гемомікросудин. Разом з тим ознак виразних деструктивних процесів у термінальних ворсинках не спостерігали, хоча подекуди у лакунах відмічено клітинний детрит. Відсутність імунокомпетентних клітин у термінальних ворсинках у всі терміни спостережень є свідченням того, що у плаценті при подовженому безводному періоді не відбуваються поширення інфекції і розвиток запальних та аутоімунних процесів.
В амніотичних оболонках, як і у плаценті, за тривалого безводного періоду від 5 до 216 год зберігався загальний план ультраструктурної організації: епітеліальний шар, розташований на базальній мембрані, та сполучнотканинний шар. Водночас в амніоні порушення розвивалися більшою мірою, ніж у плаценті, та набували деструктивно-дистрофічного характеру. Це насамперед стосувалося епітеліальних клітин, в яких уже через 5 год була істотно зменшена кількість мітохондрій, канальців комплекса Гольджі, ліпідних включень, що засвідчує зниження синтезу гамаглобулінів та інших білків, а також гідрофобність поверхонь позаплацентарних оболонок. В амніоні з 5 до 216 год безводного періоду зростали також ознаки запального процесу. Через 216 год після ПРПО частина епітеліальних клітин набувала макрофагальних властивостей. Внаслідок того, що макрофаги, або клітини Гофбауера, лише зрідка виявляли у стромі амніону і вони не були спроможні повністю забезпечувати фагоцитоз, епітеліоцити брали на себе їхню функцію. У сполучнотканинному шарі в усі досліджені терміни була збільшена кількість імунокомпетентних клітин (лімфоцитів, лейкоцитів, тучних клітин), хоча їхня кількість та поширеність вказують на те, що ці процеси не мають генералізований характер.
На основі зіставлення клінічних, імунологічних, бактеріологічних, гістологічних й апаратних методів дослідження залежно від терміну вагітності, тривалості безводного періоду, супутньої патології, акушерської ситуації ми пропонуємо індивідуальну тактику ведення вагітності й пологів, ускладненої ПРПО.
Очікувальна тактика (без індукції пологової діяльності) може бути обрана у вагітних з низьким ступенем прогнозованого перинатального ризику: при задовільному стані плода, за відсутності клініко-лабораторних ознак хоріоамніоніту (підвищення температури тіла ³ 38 °С, запах навколоплідних вод, серцебиття плода ³ 170 уд/хв, колонізація бактеріями амніотичної рідини на рівні ³ 100 КУО/мл). Наявність двох або більше симптомів дає підставу для встановлення діагнозу хоріоамніоніту. А також за відсутності ускладнень після відходження навколоплодових вод (випадіння петель пуповини, відшарування плаценти тощо). Активна тактика пропонується при розвитку клініки хоріоамніоніту та при виникненні показань до проведення кесарського розтину. Питання останнє при ПРПО і недоношеній вагітності вирішується індивідуально.
Отримані нами результати дослідження показали, що удосконалена очікувальна тактика при недоношеній вагітності, ускладеній ПРПО, має позитивні якості, а саме:
1. За нашими даними, “дозрівання” ШМ спостерігали у 83,3 % вагітних, що зменшує травматизм у пологах як у матері, так і у дитини (з 30 до 5 %) в 6 разів і зменшує кількість застосування утеротонічних засобів.
2. Відмічено зменшення частоти розвитку РДС плода прямо пропорційно тривалості безводного періоду (33,3; 13 і 9,5 % відповідно).
3. Не виявлено негативного впливу збільшення тривалості безводного періоду і пролонгації вагітності на захворюваність й смертність новонароджених. У цій категорії новонароджених основними негативними рисами були малий гестаційний вік, тяжка асфіксія при народженні, проведення реанімації в повному обсязі, поліорганна недостатність, потреба у застосуванні свіжозамороженої плазми та еритроцитарної маси.
При очікувальній тактиці можлива реалізація інфекції як у матері, так і у дитини. Результатом проведеного ретроспективного аналізу пологів ми виявили таке.
Ризик реалізації інфекції у матері на фоні ПП при ПРПО починався (при проведенні антибактеріальної терапії) у 10,6 % вагітних після 24 год безводного періоду. На фоні тривалого безводного проміжку часу реалізація інфекції у матері не мала достовірного зростання — від 12,26 до 16,03 % (Р1–Р2 > 0,05).
Клінічне проспективне спостереження з аналізом факторів перинатального ризику було проведено у 123 недоношених новонароджених від матерів із ПРПО. I групу склали недоношені новонароджені від матерів із ПРПО та хоріонамніонітом. До II групи увійшли недоношені новонароджені від матерів із ПРПО, які не мали ознак хоріонамніоніту. Ця група була розділена на дві підгрупи відповідно до стану новонароджених. У IIа підгрупу увійшли умовно здорові недоношені діти, які були виписані з пологового будинку додому. До IIб підгрупи було включено тих, яких у подальшому перевели для лікування на другий етап виходжування недоношених новонароджених.
Клінічне обстеження передчасно народжених дітей зазначених груп показало таке. Оцінка за шкалою Апгар у новонароджених IIа підгрупи наприкінці 1-ї хвилини становила 6,6 ± 0,1 бала (5—7), в IIб підгрупі — 5,6 ± 0,1 бала (3—8), в I-й групі — (4,2 ± 0,2 бала (1—6). Наприкінці 5-ї хвилини оцінка була 7,6 ± 0,1 бала (7—8) в IIа, (6,7 ± 0,1 бала (5—8) — в IIб підгрупах і 5,7 ± 0,3 бала (3—7) в 1-й групі. Отже, встановлено достовірну різницю в оцінці за шкалою Апгар між новонародженими IIа підгрупи порівняно з IIб підгрупою та 1-ю групою. Немовлята IIб підгрупи частіше народжувались в помірній асфіксії, а 1-ї групи — у помірній і тяжкій асфіксії.
Значні відмінності спостерігали серед захворювань, які було діагностовано у передчасно народжених дітей обстежених груп. Так, РДС І типу, або хвороба гіалінових мембран, був діагностований у 2 (11,1 ± 7,4 %) дітей ІІа підгрупи, у 46 (54,8 ± 5,4 %) немовлят IIб підгрупи та 19 (90,5 ± 6,4 %) 1-ї групи. Отже, частота РДС I типу достовірно зростала в IIб підгрупі та у 1й групі. З нашого погляду, це пояснюється не лише різницею в гестаційному віці цих немовлят, а й різницею у наявності та тяжкості асфіксії при народженні.
Тяжку асфіксію при народженні не спостерігали у дітей IIа підгрупи, вона була у 8 (9,6 ± 3,2 %) немовлят IIб підгрупи та у 14 (66,7 ± 10,3 %) дітей 1-ї групи. Таким чином, відмічено достовірну відсутність тяжкої асфіксії в IIа підгрупі, а також достовірне зростання її частоти в IIб підгрупі, особливо в 1-й групі обстежених дітей.
Ризик реалізації внутрішньоутробної інфекції з однаковою частотою був діагностований у новонароджених обстежених груп: у 12 (66,6 ± 11,1 %) IIа підгрупи, у 75 (89,3 ± 3,4 %) IIб підгрупи та у 18 (85,7 ± 7,6 %) 1-ї групи.
У IIа підгрупі дихальні розлади були відсутні у 15 (83,3 ± 8,8 %) немовлят, дихальна недостатність II ступеня відмічена у 1 (5,6 ± 5,4 %) дитини, III ступеня — у 2 (11,1 ± 7,4 %) дітей. У IIб обстеженій підгрупі дихальні розлади були відсутніми у 49 (59,0 ± 5,4 %), дихальну недостатність II ступеня спостерігали у 3 (3,6 ± 2,0 %) дітей, III ступеня — у 33 (39,8 ± 5,3 %). У 1-й обстеженій групі дихальні розлади у вигляді дихальної недостатності III ступеня розвинулись у 21 (100,0 ± 0 %) дитини.
Проведений аналіз засвідчив значні відмінності в обсязі й характері проведеного лікування у передчасно народжених дітей обстежених груп. Новонароджені ІІа підгрупи в переважній більшості не отримували дихальної підтримки або вона була короткотривалою, 16,7 ± 8,8 % з них короткий період отримували інфузійну терапію з метою парентерального харчування, а також антибактеріальну терапію, переважно одним препаратом. Більшість новонароджених IIб підгрупи (58,3 ± 5,4 %) не потребувала дихальної підтримки, але 34,5 ± 5,2 % з них були переведені в дитячу лікарню, ще перебуваючи на штучній вентиляції легень. Половина дітей цієї підгрупи була на парентеральному харчуванні довше 2 діб, майже усі отримували антибактеріальну терапію, переважно комбінацією двох препаратів. Частина дітей цієї групи потребувала застосування седативних, протисудомних препаратів, трансфузії свіжозамороженої плазми, сурфактантної і гормональної терапії. Найінтенсивнішу терапію проводили новонародженим 1-ї групи, усі вони потребували проведення штучної вентиляції легень, парентерального харчування, масивної антибактеріальної терапії, седативної, протисудомної терпії, переливання свіжозамороженої плазми, корекції анемії еритроцитарною масою, проведення замісної терапії сурфактантом і глюкокортикоїдами.
Таким чином, отримані нами результати засвідчують, що очікувальна тактика ведення вагітності, ускладненої ПРПО, має позитивні якості, а саме: сприяє зростанню гестаційного терміну вагітності, дозріванню ШМ, що зменшує травматизм у пологах як у матері, так і у плода, а також частоту розвтику РДС плода прямо пропорційно тривалості безводного періоду. Не виявлено негативного впливу його збільшення на частоту гнійно-септичних ускладнень у матері і плода.
ВИСНОВКИ
Проведено теоретичне узагальнення і запропоновано нове вирішення наукового завдання щодо зниження частоти перинатальної смертності та захворюваності новонароджених, частоти гнійно-запальних захворювань у породіль за рахунок розроблення раціональної системи ведення і розродження жінок із ПРПО при недоношеній вагітності.
1. За даними аналізу медичної документації пологового будинку № 7 м. Києва, частота ПРПО у терміні 28—37 тижнів вагітності у структурі ПП становить 43,5 % і залежить від хронологічних (добовий пік спостерігається в межах від 2.00 до 6.00), сезонних (припадає на весняний період), соціальних (вагітні вікових груп старше 36 років, що знаходяться поза шлюбом), так і медичних факторів ризику: повторновагітні, впершенароджуючі, котрі мали попередні медичні або мимовільні аборти, з пізньою першою явкою до жіночої консультації, серед гінекологічних захворювань, у яких превалюють запалення піхви і захворювання ШМ, мають місце хронічні та гострі інфекції).
2. При ПП на фоні ПРПО встановлено проміжний варіант мікроценозу виділень із цервікального каналу, при якому умовно-патогенна мікрофлора досягає помірної кількості (107 КУО/ мл). При розвитку хоріоамніоніту має місце клініка неспецифічного вагініту, який характеризується відсутністю росту лактобацил або їхня кількість є мінімальною (104 КУО/мл); ростом умовно-патогенної мікрофлори у високому титрі (107 КУО/мл). Аналіз мікробіологічного складу навколоплодових вод показав, що при розвитку хоріоамніоніту провідна роль належить знаходженню в навколоплодових водах умовно-патогенних мікроорганізмів у кількості ³ 102 КУО/мл. Встановлено, що мікроби асоціюються, що сприяє підвищенню частоти ризику реалізації інфекції як у матері, так і у дитини.
3. Стан системного імунітету у жінок із ПРПО характеризується порушенням клітинної (підвищення кількості) (CD 3+, CD 8+, CD 25+, CD 4+ і ЦІК ланки імунітету), що є свідченням розвитку аутоімунних процесів. Спостерігається тенденція до підвищення продукції ІЛ-2 і до значного зниження синтезу цитокінів із супресивними властивостями ІЛ-4 та ІЛ-10, що відповідає дисбалансу цитокінів, який поряд із підвищенням рівня ІФН і ФНП засвідчує зростання запального процесу. Найвиражніші зміни виявлено у жінок, в яких пологи відбулися до 24 год безводного періоду.
4. При ПРПО у вагітних виявлено підвищення рівня аКЛ антитіл класів IgG та IgM, що свідчить на користь напруженості імунітету і наявності імунозапальних реакцій. Проведення комплексу лікувальних заходів зменшує запальний процес, на що вказує зниження рівня аКЛ антитіл, найістотніше IgM-аКЛ-антитіл, що сприяє пролонгуванню вагітності з ПРПО на фоні тривалого безводного періоду.
5. Під впливом застосованих заходів, які спрямовані на пролонгування вагітності, спостерігається зменшення клітинноопосередкованих імунних реакцій: зниження кисеньзалежного метаболізму фагоцитуючих клітин, експресії поверхневих антигенів лімфоцитів (CD 3+, CD 8+, CD 25+, CD 4+), поряд з цим знижуються рівні Th1-цитокінів і зменшується продукція ІЛ-4, сироваткового ІФН і ФНП.
У жінок із тривалим безводним періодом на фоні проведеної терапії відмічено зниження рівня СПР у вагітних із найвищими його значеннями, що вказує на зменшення системного запалення.
6. При недоношеній вагітності, ускладненої ПРПО, на фоні тривалого безводного періоду від 5 до 216 год у плаценті й амніотичній оболонці зберігається загальний план ультраструктурної організації. Разом з тим в амніоні ультраструктурні порушення розвиваються більшою мірою, ніж у плаценті, та набувають деструктивно-дистрофічного характеру. Це насамперед стосується епітеліальних клітин. Зростають ознаки запального процесу в амніоні, які мають локальний характер. Про що засвідчує наявність імунокомпетентних клітин.
7. Розроблено тактику ведення вагітних і пологів з недоношеною вагітністю у термін 28—37 тижні, ускладненої ПРПО, яка дала можливість пролонгувати вагітність у 65 % жінок, знизила показники розвитку РДС плода у 3,6 раза, зменшила травматизм матері у 6 раз і плода у 7 раз, при мінімальній кількості інфекційних ускладнень у плода (з 2,43 до 4,8 %; Р > 0,05) і у матері (з 12,26 до 16,03 %; P > 0,05).
8. На основі розгляду чинників захворюваності та смертності передчасно народжених дітей на фоні тривалого безводного періоду встановлено, що основними негативними прогностичними факторами для новонароджених були малий гестаційний вік, тяжка асфіксія під час народження, проведення реанімації новонародженого в повному обсязі, поліорганна недостатність, потреба у застосуванні свіжозамороженої плазми та еритроцитарної маси. Дослідження не виявило негативного впливу збільшення тривалості безводного періоду і пролонгації вагітності на частоту захворюваності і смертності новонароджених.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. У комплекс обстеження вагітних із ПРПО, які поступають у стаціонар, необхідно проводити обстеження (дообстеження) для підтвердження діагнозу, що включає: бактеріологію піхових виділень, імунологічні обстеження, доплерометрію кровотоку в артерії пуповини плода, середній мозковій артерії.
2. Для своєчасної діагностики та розроблення індивідуальної тактики у жінок із ПРПО доцільно проводити поглиблене імунологічне обстеження (ФНП, ІФН, ІЛ-2, ІЛ-10 та ін.).
3. Показанням до термінового розродження шляхом кесарського розтину при недоношеній вагітності з ПРПО можуть слугувати виявлення кардіотокографічних ознак тяжкої гіпоксії плода (виражене зниження варіабельності серцевого ритму, спонтанні децелерації на фоні монотонного ритму, пізні децелерації при безстресовому тесті) й критичний стан плодово-плацентарного кровотоку (III ступінь порушень геодинаміки: нульовий діастолічний плацентарно-плодовий кровотік в артерії пуповини та аорті плода), не зважаючи на тривалість безводного періоду.
4. Токолітична терапія при недоношеній вагітності на фоні ПРПО проводиться протягом 48 год у терміні до 34 тижнів вагітності, що дає змогу здійснити профілактику СДР плода.
5. Мікроскопічна діагностика факультативно-анаеробної мікрофлори в піхві у жінок із ПРПО на фоні недоношеної вагітності малоефективна. Тому для повноцінної характеристики факультативно-анаеробної частини мікробіоценозу піхви, а також мікроаерофлори, насамперед для виділення лактобацил, необхідно робити посів на склад вмісту піхви 1 раз у 7—10 діб.
6. Факторами підвищеного ризику захворюваності для матері та плода є виявлення в мікробіоценозіпологових шляхів Streptococcus A i B, Esсherichia coli, Gardnerella vaginalis, Fusobacterium, Peptostreptococcus, Bacteroides, Streptococcus aureus, Proteus mirabilis, що вимагає підвищеної уваги лікарів жіночої консультації й стаціонарів до скринінгу ризику розвитку хоріоамніоніту у матері та запальних захворювань у дитини.
Похожие работы
... репродуктивної системи. II. У зв’язку із катастрофою Чорнобильської АЕС погіршення здоров’я найбільше турбує населення Рівненської області. У другому розділі роботи описані захворювання, які виникають на фоні радіаційного ураження. III. Розділ III показує зміни та порушення з боку репродуктивної системи по районах Рівненської області. Завдяки цьому розділу можна зрозуміти, що північні райони ...
... нки спрацьовують механізми, що допомагають їй відновлюватися легко й без проблем. Ці механізми включаються, якщо пологи відповідають природній схемі. Мета дослідження: обґрунтувати сучасні напрямки і методи відновлення здоров'я жінок у післяпологовому періоді. Об'єкт дослідження: методика реабілітації жінок у післяпологовому періоді. Предмет дослідження : засоби і методи реабілітації жінок у пі ...
... в передньо-задньому напрямку. Головка плоду має також неоднакові розміри в різних площинах. У зв’язку з зазначеними особливостями форми тазу і голівки, вона не може пройти через родові шляхи по прямій лінії, не роблячи поворотів. Одночасно з поступальними рухами по осі тазу плід, особливо його голівка, робить ряд рухів. Голівка плоду робить додаткові до поступальних рухів повороти навколо ...
0 комментариев