Содержание
1. Полимеразная цепная реакция (ПЦР)
2. Принцип метода полимеразной цепной реакции
2.1 Наличие в реакционной смеси ряда компонентов
2.2 Циклический температурный режим
2.3 Основные принципы подбора праймеров
2.4 Эффект "плато"
3. Cтадии постановки ПЦР
3.1 Подготовка пробы биологического материала
3.2 Амплификация
3.3 Оценка результатов реакции
3.3.1 Метод горизонтального электрофореза
3.3.2 Метод вертикального электрофореза
3.4 Контроль за прохождением реакции амплификации
3.4.1 Положительные контроли
3.4.2 Внутренние контроли
4. Методы, основанные на полимеразной цепной реакции
4.1 Качественный анализ
4.1.1 Способ постановки ПЦР с использованием “горячего старта"
4.1.2 Детекция молекул РНК
5. Организация технологического процесса постановки ПЦР
Заключение
1. Полимеразная цепная реакция (ПЦР)
Полимеразная цепная реакция - это метод, имитирующий естественную репликацию ДНК и позволяющий обнаружить единственную специфическую молекулу ДНК в присутствии миллионов других молекул.
Открытие метода полимеразной цепной реакции (ПЦР) стало одним из наиболее выдающихся событий в области молекулярной биологии за последнее десятилетие. Это позволило поднять медицинскую диагностику на качественно новый уровень.
Впервые состав ингредиентов, входящих в реакционную смесь для постановки полимеразной цепной реакции, и основные принципы использования праймеров (коротких искусственно синтезированных молекул ДНК) для получения копий ДНК были описаны Kleppe с соавт. в 1971 году. Однако тогда еще не была продемонстрирована основная черта ПЦР - экспоненциальное увеличение количества копий фрагмента исходной ДНК как результат реакции.
В 1983 году Kary Mullis предложил метод, ставший в дальнейшем известным как полимеразная цепная реакция. Суть метода заключается в многократном копировании (амплификации) в пробирке определенных участков ДНК в процессе повторяющихся температурных циклов. На каждом цикле амплификации синтезированные ранее фрагменты вновь копируются ДНК-полимеразой. Благодаря этому происходит многократное увеличение количества специфических фрагментов ДНК в миллиарды раз, что значительно упрощает дальнейший анализ.
В этот период были обнаружены уникальные микроорганизмы, живущие в гейзерах. Их ферментная система, в частности ДНК-полимераза, выдерживает высокие температуры горячих источников и сохраняет свою биологическую активность вплоть до 95° С, что является необходимым условием для проведения полимеразной цепной реакции.
Результатом открытия ПЦР стало почти немедленное практическое применение метода.
Перспективы практического использования ПЦР-диагностики
В настоящее время наиболее быстро развиваются пять основных направлений генодиагностики:
диагностика инфекционных заболеваний;
диагностика онкологических заболеваний;
диагностика лейкемий и лимфом;
диагностика рака груди;
диагностика других злокачественных заболеваний;
диагностика генетических заболеваний;
идентификация личности;
судебная медицина, криминалистика;
трансплантация органов и тканей;
определение отцовства;
диагностика патогенов в пище.
2. Принцип метода полимеразной цепной реакции
Полимеразная цепная реакция (ПЦР) - метод амплификации ДНК in vitro, с помощью которого в течение нескольких часов можно выделить и размножить определённую последовательность ДНК в миллиарды раз. Возможность получения огромного количества копий одного строго определённого участка генома значительно упрощает исследование имеющегося образца ДНК.
Для проведения полимеразной цепной реакции необходимо соблюдение ряда условий.
2.1 Наличие в реакционной смеси ряда компонентов
Праймеры - пара искусственно синтезированных олигонуклеотидов, имеющих, как правило, размер от 15 до 30 п. н., идентичные соответствующим участкам ДНК-мишени. Они играют ключевую роль в образовании продуктов реакции амплификации. Правильно подобранные праймеры обеспечивают специфичность и чувствительность тест-системы.
Taq-полимераза - термостабильный фермент, обеспечивающий достраивание 3’-конца второй цепи ДНК согласно принципу комплементарности.
Смесь дезоксинуклеотидтрифосфатов (дНТФ) - дезоксиаденозинтрифосфат (дАТФ), дезоксигуанозинтрифосфат (дГТФ), дезоксицитозинтрифосфат (дЦТФ) и дезокситимидинтрифосфат (дТТФ) - "строительный материал", используемый Taq-полимеразой для синтеза второй цепи ДНК;
Буфер - смесь катионов и анионов в определенной концентрации, обеспечивающих оптимальные условия для реакции, а также стабильное значение рН;
Анализируемый образец - подготовленный к внесению в реакционную смесь препарат, который может содержать искомую ДНК, служащую мишенью для последующего многократного копирования (например, ДНК микроорганизмов). При отсутствии ДНК-мишени специфический продукт амплификации не образуется.
2.2 Циклический температурный режим
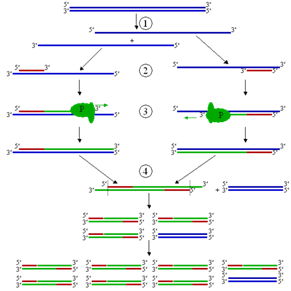
Если в анализируемом образце присутствует искомая ДНК, то в процессе реакции амплификации с ней происходит ряд событий, обеспечиваемых определенными температурными циклами. Каждый цикл амплификации состоит из трех этапов.
1. Денатурация. На первом этапе необходимо денатурировать ДНК, находящуюся в образце. Для этого реакционную смесь нагревают до 92-95° С, в результате чего двухцепочечные молекулы ДНК расплетаются с образованием двух одноцепочечных молекул. Этот процесс длится не менее 1 минуты.
2. Отжиг. На втором этапе температуру смеси понижают до 55°С праймеры присоединяются к одноцепочечной ДНК-мишени. Праймеры выбирают так, что они ограничивают искомый фрагмент и комплементарны противоположным цепям ДНК.
Отжиг происходит в соответствии с правилом комплементарности Чаргаффа.
После отжига праймеров Taq-полимераза начинает достраивание второй цепи ДНК, начиная с 3’-конца праймера.
3. Элонгация (синтез). На третьем этапе температуру в реакционной смеси доводят до оптимума работы Taq-полимеразы - 75°С, и начинается синтез комплементарной цепи ДНК, инициируемый 3’-гидроксильной группой праймера, с максимальной эффективностью.
Иногда, в случае близкого значения температуры отжига праймеров к температуре оптимума работы фермента, становится возможным использовать двухстадийный цикл ПЦР, совместив две стадии - отжиг и элонгацию - в одной.
В дальнейшем этапы денатурации, отжига и элонгации многократно повторяются (30 и более раз). На каждом цикле количество синтезированных копий фрагмента ДНК удваивается.
Фактически значение эффективности отдельных циклов амплификации составляет, по некоторым данным, 78-97%. В случае присутствия в пробе ингибиторов реакции это значение может быть намного меньше.
Все реакции проводят в пробирках, погруженных в термостат. Смена температурного режима и его поддержание осуществляется автоматически. Каждый цикл обычно длится 3 - 5 минут.
Первый цикл. ДНК-мишень фланкирована определенными последовательностями. К образцу ДНК добавляют праймеры (Р1 и Р2), ДНК-полимеразу Tag и четыре дНТФ. Здесь каждая из новосинтезированных цепей имеет гораздо большую длину, чем расстояние от 3’-гидроксильной группы "её" праймера до концевого нуклеотида последовательности, комплементарной второму праймеру. Такие цепи называют "длинными матрецами", именно на них будет идти дальнейший синтез. Эти цепи служат матрицами во втором раунде ПЦР.
Во втором цикле двухцепочечную ДНК, состоящую из исходной и новосинтезированной ("длинная матрица") цепей, вновь денатурируют, а затем отжигают с праймерами. При отжиге праймеры гобридизуются с комплементарными им участками как исходных цепей, так и "длинных матриц", синтезированных в первом цикле. В результате ферментативного синтеза на исходных цепях синтезируются "длинные матрицы", а на "длинных матрицах" - "короткие", с праймером на одном конце и с последовательностью, комплементарной второму праймер, на другом.
В третьем цикле все гетеродуплуксы, образовавшиеся ранее, одновременно подвергаются денатурации и отжигу с праймерами, а затем реплецируются. При отжиге праймеры гибридизуются с комплементарными участками исходных цепей, а также "длинных" и "коротких" матриц. При ферментативном синтезе in vitro на исходных цепях синтезируются "длинные матрицы", а на "длинных" и "коротких" матрицах - только "короткие матрицы".
В послудующих циклах число "коротких матриц" становится все больше.
Таким образом, специфические фрагменты, ограниченные на концах праймерами, впервые появляются в конце второго цикла, накапливаются в геометрической прогрессии и очень скоро начинают доминировать среди продуктов амплификации.
2.3 Основные принципы подбора праймеров
При создании ПЦР-тест-системы одной из основных задач является правильный подбор праймеров, которые должны отвечать ряду критериев:
1. Праймеры должны быть специфичны. Особое внимание уделяют 3’-концам праймеров, т.к именно с них начинает достраивать комплементарную цепь ДНК Taq-полимераза. Если их специфичность недостаточна, то, вероятно, что в пробирке с реакционной смесью будут происходить нежелательные процессы, а именно, синтез неспецифической ДНК (коротких или длинных фрагментов). Она видна на электрофорезе в виде тяжелых или легких дополнительных полос. Это мешает оценке результатов реакции, т.к легко перепутать специфический продукт амплификации с синтезированной посторонней ДНК. Часть праймеров и дНТФ расходуется на синтез неспецифической ДНК, что приводит к значительной потере чувствительности.
2. Праймеры не должны образовывать димеры и петли, т.е. не должно образовываться устойчивых двойных цепей в результате отжига праймеров самих на себя или друг с другом.
2.4 Эффект "плато"Следует заметить, что процесс накопления специфических продуктов амплификации по геометрической прогрессии идет лишь ограниченное время, а затем его эффективность критически падает. Это связано с так называемым эффектом "плато".
Термин эффект “плато” используют для описания процесса накопления продуктов ПЦР на последних циклах амплификации.
В зависимости от условий и количества циклов реакции амплификации, на момент достижения эффекта “плато” влияют утилизация субстратов (дНТФ и праймеров), стабильность реактантов (дНТФ и фермента), количество ингибиторов, включая пирофосфаты и ДНК-дуплексы, конкуренция за реактанты неспецифическими продуктами или праймер-димерами, концентрация специфического продукта и неполная денатурация при высокой концентрации продуктов амплификации.
Чем меньше начальная концентрация ДНК-мишени, тем выше риск выхода реакции на “плато". Этот момент может наступить до того, как количество специфических продуктов амплификации будет достаточно, чтобы их можно было проанализировать. Избежать этого позволяют лишь хорошо оптимизированные тест-системы.
3. Cтадии постановки ПЦР 3.1 Подготовка пробы биологического материала
Для выделения ДНК используют различные методики в зависимости от поставленных задач. Их суть заключается в экстракции (извлечении) ДНК из биопрепарата и удалении или нейтрализации посторонних примесей для получения препарата ДНК с чистотой, пригодной для постановки ПЦР.
Стандартной и ставшей уже классической считается методика получения чистого препарата ДНК, описанная Мармуром. Она включает в себя ферментативный протеолиз с последующей депротеинизацией и переосаждением ДНК спиртом. Этот метод позволяет получить чистый препарат ДНК. Однако он довольно трудоемок и предполагает работу с такими агрессивными и имеющими резкий запах веществами, как фенол и хлороформ.
Одним из популярных в настоящее время является метод выделения ДНК, предложенный Boom с соавторами. Этот метод основан на использовании для лизиса клеток сильного хаотропного агента - гуанидина тиоционата (GuSCN), и последующей сорбции ДНК на носителе (стеклянные бусы, диатомовая земля, стеклянное "молоко" и. т.д.). После отмывок в пробе остается ДНК, сорбированная на носителе, с которого она легко снимается с помощью элюирующего буфера. Метод удобен, технологичен и пригоден для подготовки образца к амплификации. Однако возможны потери ДНК вследствие необратимой сорбции на носителе, а также в процессе многочисленных отмывок. Особенно большое значение это имеет при работе с небольшими количествами ДНК в образце. Кроме того, даже следовые количества GuSCN могут ингибировать ПЦР. Поэтому при использовании этого метода очень важен правильный выбор сорбента и тщательное соблюдение технологических нюансов.
Другая группа методов пробоподготовки основана на использовании ионообменников типа Chilex, которые, в отличие от стекла, сорбируют не ДНК, а наоборот, примеси, мешающие реакции. Как правило, эта технология включает две стадии: кипячение образца и сорбция примесей на ионообменнике. Метод чрезвычайно привлекателен простотой исполнения. В большинстве случаев он пригоден для работы с клиническим материалом. К сожалению, иногда встречаются образцы с такими примесями, которые невозможно удалить с помощью ионообменников. Кроме того, некоторые микроорганизмы не поддаются разрушению простым кипячением. В этих случаях необходимо введение дополнительных стадий обработки образца.
Таким образом, к выбору метода пробоподготовки следует относиться с пониманием целей проведения предполагаемых анализов.
3.2 АмплификацияДля проведения реакции амплификации необходимо приготовить реакционную смесь и внести в нее анализируемый образец ДНК. При этом важно учитывать некоторые особенности отжига праймеров. Дело в том, что, как правило, в анализируемом биологическом образце присутствуют разнообразные молекулы ДНК, к которым используемые в реакции праймеры имеют частичную, а в некоторых случаях значительную, гомологию. Кроме того, праймеры могут отжигаться друг с другом, образуя праймер-димеры. И то, и другое приводит к значительному расходу праймеров на синтез побочных (неспецифических) продуктов реакции и, как следствие, значительно уменьшает чувствительность системы. Это затрудняет или делает невозможным чтение результатов реакции при проведении электрофореза.
3.3 Оценка результатов реакции
Для правильной оценки результатов ПЦР важно понимать, что данный метод не является количественным. Теоретически продукты амплификации единичных молекул ДНК-мишени могут быть обнаружены с помощью электрофореза уже после 30-35 циклов. Однако на практике это выполняется лишь в случаях, когда реакция проходит в условиях, близких к идеальным, что в жизни встречается не часто. Особенно большое влияние на эффективность амплификации оказывает степень чистоты препарата ДНК, т.е. наличие в реакционной смеси тех или иных ингибиторов, от которых избавиться в некоторых случаях бывает крайне сложно. Иногда, из-за их присутствия не удается амплифицировать даже десятки тысяч молекул ДНК-мишени. Таким образом, прямая связь между исходным количеством ДНК-мишени и конечным количеством продуктов амплификации часто отсутствует.
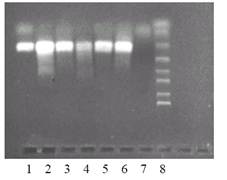
3.3.1 Метод горизонтального электрофорезаДля визуализации результатов амплификации используют различные методы. Наиболее распространенным на сегодняшний день является метод электрофореза, основанный на разделении молекул ДНК по размеру. Для этого готовят пластину агарозного геля, представляющего собой застывшую после расплавления в электрофорезном буфере агарозу в концентрации 1,5-2,5% с добавлением специального красителя ДНК, например, бромистого этидия. Застывшая агароза образует пространственную решетку. При заливке с помощью гребенок в геле формируют специальные лунки, в которые в дальнейшем вносят продукты амплификации. Пластину геля помещают в аппарат для горизонтального гель-электрофореза и подключают источник постоянного напряжения. Отрицательно заряженная ДНК начинает двигаться в геле от минуса к плюсу. При этом более короткие молекулы ДНК движутся быстрее, чем длинные. На скорость движения ДНК в геле влияет концентрация агарозы, напряженность электрического поля, температура, состав электрофорезного буфера и, в меньшей степени, ГЦ-состав ДНК. Все молекулы одного размера движутся с одинаковой скоростью. Краситель встраивается (интеркалирует) плоскостными группами в молекулы ДНК. После окончания электрофореза, продолжающегося от 10 мин до 1 часа, гель помещают на фильтр трансиллюминатора, излучающего свет в ультрафиолетовом диапазоне (254 - 310 нм). Энергия ультрафиолета, поглощаемая ДНК в области 260 нм, передается на краситель, заставляя его флуоресцировать в оранжево-красной области видимого спектра (590 нм).
Яркость полос продуктов амплификации может быть различной. Однако это нельзя связывать с начальным количеством ДНК-мишени в образце.
3.3.2 Метод вертикального электрофорезаМетод вертикального электрофореза принципиально схож с горизонтальным электрофорезом. Их отличие заключается в том, что в данном случае вместо агарозы используют полиакриламидные гели. Его проводят в специальной камере для вертикального электрофореза. Электрофорез в полиакриламидном геле имеет большую разрешающую способность по сравнению с агарозным электрофорезом и позволяет различать молекулы ДНК разных размеров с точностью до одного нуклеотида. Приготовление полиакриламидного геля несколько сложнее агарозного. Кроме того акриламид является токсичным веществом. Поскольку необходимость определить размер продукта амплификации с точностью до 1 нуклеотида возникает редко, то в обычной работе используют метод горизонтального электрофореза.
3.4 Контроль за прохождением реакции амплификации
3.4.1 Положительные контроли
В качестве "положительного контроля" используют препарат ДНК искомого микроорганизма. Неспецифические ампликоны отличаются по размеру от ампликонов, образуемых в результате амплификации с контрольным препаратом ДНК. Размер неспецифических продуктов может быть как большего, так и меньшего размера по сравнению с положительным контролем. В худшем случае эти размеры могут совпадать и читаются в электрофорезе как положительные.
Для контроля специфичности образуемого продукта амплификации можно использовать гибридизационные зонды (участки ДНК, расположенные внутри амплифицируемой последовательности), меченные ферментными метками или радиоактивными изотопами и взаимодействующими с ДНК в соответствии с теми же принципами, что и праймеры. Это значительно усложняет и удлиняет анализ, а его стоимость существенно увеличивается.
3.4.2 Внутренние контроли
Необходимо контролировать ход амплификации в каждой пробирке с реакционной смесью. Для этой цели используют дополнительный, так называемый "внутренний контроль". Он представляет собой любой препарат ДНК, несхожий с ДНК искомого микроорганизма. Если внутренний контроль внести в реакционную смесь, то он станет такой же мишенью для отжига праймеров, как и хромосомальная ДНК искомого возбудителя инфекции. Размер продукта амплификации внутреннего контроля подбирают таким образом, чтобы он был в 2 и более раз больше, чем ампликоны, образуемые от амплификации искомой ДНК микроорганизма. В результате, если внести ДНК внутреннего контроля в реакционную смесь вместе с испытуемым образцом, то независимо от наличия микроорганизма в биологическом образце, внутренний контроль станет причиной образования специфических ампликонов, но значительно более длинных (тяжелых), чем ампликон микроорганизма. Наличие тяжелых ампликонов в реакционной смеси будет свидетельством нормального прохождения реакции амплификации и отсутствия ингибиторов. Если ампликоны нужного размера не образовались, но не образовались также и ампликоны внутреннего контроля, можно сделать вывод о наличии в анализируемом образце нежелательных примесей, от которых следует избавиться, но не об отсутствии искомой ДНК.
К сожалению, несмотря на всю привлекательность такого подхода, у него есть существенный изъян. Если в реакционной смеси находится нужная ДНК, то эффективность ее амплификации резко снижается из-за конкуренции с внутренним контролем за праймеры. Это особенно принципиально важно при низких концентрациях ДНК в испытуемом образце, что может приводить к ложноотрицательным результатам.
Тем не менее, при условии решения проблемы конкуренции за праймеры, этот способ контроля эффективности амплификации безусловно будет весьма полезен.
4. Методы, основанные на полимеразной цепной реакции 4.1 Качественный анализ
Классический способ постановки ПЦР, принципы которого были изложены выше, нашел свое развитие в некоторых модификациях, направленных на преодоление ограничений ПЦР и повышение эффективности прохождения реакции.
4.1.1 Способ постановки ПЦР с использованием “горячего старта"Чтобы уменьшить риск образования неспецифических продуктов реакции амплификации, используют подход, получивший название “горячий старт" (“Hot-start”). Суть его состоит в предотвращении возможности начала реакции до момента достижения в пробирке условий, обеспечивающих специфический отжиг праймеров.
Дело в том, что в зависимости от ГЦ-состава и размера, праймеры имеют определенную температуру плавления (Tm). Если температура системы превышает Тm, праймер не в состоянии удерживаться на цепи ДНК и денатурирует. При соблюдении оптимальных условий, т.е. температуры отжига, близкой к температуре плавления, праймер образует двухцепочечную молекулу только при условии его полной комплементарности и, таким образом, обеспечивает специфичность реакции.
Существуют различные варианты реализации "горячего старта":
Внесение в реакционную смесь Taq-полимеразы во время первого цикла после прогрева пробирки до температуры денатурации.
Разделение ингредиентов реакционной смеси парафиновой прослойкой на слои (в нижней части - праймеры, в верхней - Taq-полимераза и ДНК-мишени), которые смешиваются при расплавлении парафина (~65-750С).
Использование моноклональных антител к Taq-полимеразе. Фермент, связанный моноклональными антителами, становится активным лишь после стадии первой денатурации, когда моноклональные антитела необратимо денатурируют и освобождают активные центры Taq-полимеразы.
Во всех перечисленных случаях, даже если неспецифический отжиг произошел до начала температурного циклирования, элонгации не происходит, а при нагревании комплексы праймер-ДНК денатурируют, поэтому неспецифические продукты не образуются. В дальнейшем температура в пробирке не опускается ниже температуры плавления, что обеспечивает образование специфического продукта амплификации.
4.1.2 Детекция молекул РНКВозможность использования РНК в качестве мишени для ПЦР существенно расширяет спектр применения этого метода. Например, геномы многих вирусов (гепатит С, вирус инфлюэнцы, пикорнавирусы и т.д.) представлены именно РНК. При этом в их жизненных циклах отсутствует промежуточная фаза превращения в ДНК. Для детекции РНК необходимо в первую очередь перевести ее в форму ДНК. Для этого используют обратную транскриптазу, которую выделяют из двух различных вирусов: avian myeloblastosis virus и Moloney murine leukemia virus. Использование этих ферментов связано с некоторыми трудностями. Прежде всего, они термолабильны и поэтому могут быть использованы при температуре не выше 42° С. Так как при такой температуре молекулы РНК легко образуют вторичные структуры, то эффективность реакции заметно снижается и по разным оценкам приблизительно равна 5%. Предпринимаются попытки обойти этот недостаток используя в качестве обратной транскриптазы термостабильную полимеразу, полученную из термофильного микроорганизма Thermus Thermophilus, проявляющего транскриптазную активность в присутствии Mn2+. Это единственный известный фермент, способный проявлять как полимеразную так и транскриптазную активность.
Для проведения реакции обратной транскрипции в реакционной смеси также как и в ПЦР должны присутствовать праймеры в качестве затравки и смесь 4-х дНТФ, как строительный материал.
После проведения реакции обратной транскрипции полученные молекулы кДНК могут служить мишенью для проведения ПЦР
5. Организация технологического процесса постановки ПЦР
Потенциально высокая чувствительность полимеразной цепной реакции делает совершенно необходимым особенно тщательное устройство ПЦР-лаборатории. Это связано с наиболее острой проблемой метода - контаминацией.
Контаминация - попадание из внешней среды в реакционную смесь специфических молекул ДНК, способных служить мишенями в реакции амплификации и давать ложноположительные результаты.
Существует несколько способов борьбы с этим неприятным явлением. Одним из них является использование фермента N-урацил-гликозилазы (УГ). В основе этого метода лежит способность УГ расщеплять молекулы ДНК со встроенным урацилом. Реакцию амплификации проводят с использованием смеси дНТФ, в которой дТТФ заменен на урацил, и после термоциклирования все образующиеся в пробирке ампликоны будут содержать урацил. Если до амплификации в реакционную смесь добавить УГ, то попавшие в реакционную смесь ампликоны будут разрушены, тогда как нативная ДНК останется целой и будет в дальнейшем служить мишенью для амплификации.
Таким образом, этот метод лишь в некоторой степени позволяет устранить источник контаминации и не гарантирует от ложноположительных результатов.
Другой способ борьбы с результатами контаминации, значительное уменьшение количества циклов реакции (до 25-30 циклов). Но даже при таком подходе риск получения ложноположительных результатов велик, т.к и в этом случае при отсутствии ингибиторов легко получить продукт амплификации из-за контаминации.
Таким образом, несмотря на пользу преамплификационных мероприятий, направленных на инактивацию молекул ДНК, служащих причиной возникновения ложноположительных результатов, наиболее радикальным средством является заранее продуманная организация лаборатории.
Заключение
Самое широкое распространение метод ПЦР в настоящее время получил как метод диагностики различных инфекционных заболеваний. ПЦР позволяет выявить этиологию инфекции даже если в пробе, взятой на анализ, содержится всего несколько молекул ДНК возбудителя. ПЦР широко используется в ранней диагностики ВИЧ-инфекций, вирусных гепатитов и т.д. На сегодняшний день почти нет инфекционного агента, которого нельзя было бы выявить с помощью ПЦР.
Похожие работы
... , диализу от денатурирующих добавок, изменению рН и ионной силы среды. Подлинность наработанного белка проверяют по ферментативной активности, если он должен таковой обладать. Или же по электрофорезу — сравнением с контрольным препаратом. Но надежнее — одним из иммунологических методов контроля, с которыми мы познакомимся в свое время. 2. Электрофорез Метод электрофореза таит в себе массу « ...
... использования; - лаборант во время выделения должен быть одет в специальный халат, шапочку и очки. Все манипуляции с исследуемым материалом проводят при соблюдении правил работы с вирусами III и IV группы. Постановку ПЦР осуществляют как минимум в 3 рабочих зонах: Зона 1 (ламинарный бокс, бокс с УФ-лампой): подготовка ПЦР-реагентов. Зона 2 (ламинарный бокс, бокс с УФ-лампой): подготовка проб ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей ...
0 комментариев