Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Реферат на тему:
Постановка реакции ПЦР
Челябинск 2008
ОГЛАВЛЕНИЕ
Введение
1. Устройство, задачи и функции лаборатории иммунологического типирования тканей
2. Выделение ДНК из венозной крови
3. Проведение ПЦР
4. Ход реакции
5. Анализ ПЦР-амплифицированной ДНК
Заключение
ВВЕДЕНИЕ
В начале 1970-х годов норвежскому ученому Къеллу Клеппе (Kjell Kleppe) из лаборатории нобелевского лауреата Хара Гобинды Хораны (Har Gobind Khorana) пришла в голову мысль, что можно амплифицировать ДНК с помощью пары коротких одноцепочечных молекул ДНК - синтетических праймеров. Однако в то время эта идея осталась невостребованной. Полимеразная цепная реакция была вновь открыта в 1983 году Кери Маллисом (Kary Mullis). Его целью было создание метода, который бы позволил амплифицировать ДНК в ходе многократных последовательных удвоений исходной молекулы ДНК с помощью фермента ДНК-полимеразы. Через 7 лет после опубликования этой идеи, в 1993 г., Маллис получил за неё Нобелевскую премию.
ПЦР используется во многих областях для проведения анализов и в научных экспериментах. ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных и вирусных заболеваний, используется для подбора гистосовместимого донора органов и тканей, регистрации всех потенциальных реципиентов, нуждающихся в тканевых и органных трансплантантах, проведения иммунологического контроля за приживлением пересаженных органов и тканей.
1. Устройство, задачи и функции лаборатории иммунологического типирования тканей
1. Общие положения.
1.1. Лаборатория иммунологического типирования (ИТ) организуется в составе станции переливания крови.
1.2. Лаборатория ИТ осуществляет методическое руководство иммунологическим типированием тканей в лечебных учреждениях подконтрольных административной территории.
1.3. Лаборатория ИТ осуществляет связь с лечебно-профилактическими учреждениями зоны с целью подбора гистосовместимого донора органов и тканей, регистрации всех потенциальных реципиентов, нуждающихся в тканевых и органных трансплантантах, проведения иммунологического контроля за приживлением пересаженных органов и тканей.
2. Основные задачи лаборатории иммунологического типирования: организационно-методическое руководство за проведением тканевого типирования в лечебно-профилактических учреждениях административной зоны; организация сбора, исследование сывороток на наличие анти-HLA антител; исследование антигенного состава тканей больных с различными заболеваниями, доноров тканевых и органных трансплантатов.
3. Функции лаборатории иммунологического типирования:
3.1. Лаборатория обеспечивает всеми видами иммунологического исследования больных, находящихся в лечебно-профилактических учреждениях курируемого региона.
3.2. Лаборатория исследует антигенный состав тканей потенциальных доноров тканевых и органных трансплантатов и реципиентов, составляет картотеки типированных доноров и реципиентов, осуществляет поиск совместимых пар донор-реципиент.
3.3. Проводит прямые и обратные пробы на совместимость между сывороткой и форменными элементами крови донора и реципиента.
3.4. Проводит наблюдение иммунологическими методами за развитием посттрансфузионных реакций и приживлением тканевых и органных трансплантатов.
3.5. Участвует в составлении планов по повышению квалификации сотрудников лечебно-профилактических учреждений зоны по иммунологическому типированию тканей.
3.6. Организует разъяснительную работу в лечебно-профилактических учреждениях зоны по вопросам клинического значения иммунологических исследований.
2. Выделение ДНК из венозной крови
Перед выделением ДНК необходимо приготовить рабочий раствор солевого буфера. Для этого Содержимое флакона с 10-кратным Солевым буфером, 10 мл, перенести в мерный цилиндр, довести бидистиллированной водой до метки 100 мл и 96% этиловым спиртом довести до метки 300 мл и перемешать. Готовый рабочий раствор Солевого буфера следует хранить в герметично закрытой посуде при температуре 4˚С. Солевой буфер необходим для дальнейшей промывки осадка с ДНК.
Выделение ДНК проводят в специализированном боксе для выделения. Необходимо соблюдать правила техники безопасности:
- руки должны быть защищены одноразовыми перчатками, которые утилизируются после выделения;
- дыхательные пути защищены одноразовой маской, которая также подлежит утилизации после использования;
- лаборант во время выделения должен быть одет в специальный халат, шапочку и очки.
Все манипуляции с исследуемым материалом проводят при соблюдении правил работы с вирусами III и IV группы. Постановку ПЦР осуществляют как минимум в 3 рабочих зонах:
Зона 1 (ламинарный бокс, бокс с УФ-лампой): подготовка ПЦР-реагентов.
Зона 2 (ламинарный бокс, бокс с УФ-лампой): подготовка проб и контролей, выделение ДНК, внесение проб в пробирки с ПЦР-реагентами, проведение амплификации.
Зона 3: детекция амплифицированной ДНК.
Пробы из зоны 3 запрещено переносить в зоны 1 и 2 во избежание контаминации ДНК-матрицей. Пипетки или наконечники должны иметь аэрозольный барьер. Перчатки и халаты необходимо менять при переходе из одной зоны в другую.
Оборудование, необходимое для выделения ДНК:
– ламинарный бокс или стерилизуемое УФ-излучением помещение;
– одноразовая пластиковая посуда (стерильные пробирки типа "Эппендорф" объемом 1,5; 0,5; 0,2 мл);
– автоматические пипетки объемом от 0,5 мкл до 1 мл;
– сменные одноразовые наконечники с аэрозольными фильтрами;
– центрифуга типа "Эппендорф" с охлаждением и скоростью не менее 10000 g;
– встряхиватель ("Вортекс");
Выделение ДНК из венозной крови проводят в несколько этапов:
1. В пробирку объёмом 1,5 мл внести 300 мкл исследуемой пробы, добавить 800 мкл Лизирующего реагента и перемешать содержимое пробирки переворачиванием (5-10 раз). Интенсивное встряхивание смеси не рекомендуется. Лизирующий реагент необходим для разрушения клеток крови и экстракции из них ДНК.
2. Термостатировать пробирку со смесью 5-7 мин. При температуре 65˚С. Если выделение ДНК проводится из твёрдого сухого мелкоизмельчённого материала, то следует термостатировать 30-40 мин.
3. После термостатирования центрифугировать пробирку со смесью 10 сек при 5000 об. в мин., в том случае, если смесь содержит несолюбилизированный клеточный дебрис или другой нерастворённый осадок. Прозрачный супернатант целиком перенести в чистую пробирку.
4. В пробирку с чистой смесью добавить 45 мкл суспензии сорбента NucleoSTM. Перед использованием NucleoSTMследует интенсивно перемешать до гомогенной суспензии на вортексе. NucleoSTMнеобходим для того, чтобы на его частицах осела выделенная из клеток ДНК.
5. Пробирку поместить на ротатор и перемешивать 10 мин (10-20 об/мин) для лучшего оседания выделенной ДНК на частицах кремния.
6. Центрифугировать 10 сек при 5000 об. в мин.
7. Осторожно, не задевая осадок, удалить супернатант с помощью водоструйного насоса.
8. К осадку добавить 400 мкл Лизирующего реагента, тщательно перемешать на вортексе до полного гомогенного состояния. Если супендирование затруднено (при большой нагрузке ДНК) из-за слипания сорбента, то его необходимо вначале суспендировать наконечником пипетки, а затем на вортексе.
9. Добавить в пробирку 1 мл рабочего раствора Солевого буфера и перемешать содержимое переворачиванием пробирки 5-10 раз.
10. Центрифугировать 10 сек при 5000 об. в мин.
11. Осторожно удалить супернатант, не задевая осадок, с помощью водоструйного насоса.
12. Повторить промывку дважды Для этого необходимо добавлять по 1 мл Солевого буфера, перемешивать содержимое пробирки на вортексе, центрифугировать 10 сек. при 5000 об. в мин. и удалять прозрачный супернатант.
13. Просушить осадок при температуре 65˚С в течение 3-4 мин.
14. В эту же пробирку внести 300 мкл ЭкстраГена ЕТМ, который необходим для отделения промытой ДНК от частиц кремния. ЭкстраГен ЕТМ следует отбирать от общего объёма при постоянном перемешивании.
15. Суспендировать содержимое пробирки на вортексе 5-10 сек до получения гомогенной суспензии, затем термостатировать 4-5 мин при 65˚С.
16. Ещё раз суспендировать содержимое пробирки на вортексе перед центрифугированием. Центрифугировать 1 мин при 10000 об. в мин.
17. Перенести супернатант с ДНК в чистую пробирку. ДНК хранить при температуре -20˚С.
3. Проведение ПЦРМетод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. В отличие от амплификации ДНК в живых организмах (репликации), с помощью ПЦР амплифицируются относительно короткие участки ДНК. В обычном ПЦР-процессе длина копируемых ДНК-участков составляет не более 3000 пар оснований (3 kbp). С помощью смеси различных полимераз, с использованием добавок и при определённых условиях длина ПЦР-фрагмента может достигать 20-40 тысяч пар нуклеотидов. Это всё равно значительно меньше длины хромосомной ДНК эукариотической клетки. Например, геном человека состоит примерно из 3 млрд пар оснований.
Компоненты реакцииДля проведения ПЦР в простейшем случае требуются следующие компоненты:
· ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать.
· Два праймера, комплементарные концам требуемого фрагмента.
· Термостабильная ДНК-полимераза— фермент, который катализирует реакцию полимеризации ДНК. Полимераза для использования в ПЦР должна сохранять активность при высокой температуре длительное время, поэтому используют ферменты, выделенные из термофилов— Thermus aquaticus (Taq-полимераза), Pyrococcus furiosus (Pfu-полимераза), Pyrococcus woesei (Pwo-полимераза) и другие.
· Дезоксинуклеотидтрифосфаты (dATP, dGTP, dCTP, dTTP).
· Ионы Mg2+, необходимые для работы полимеразы.
· Буферный раствор, обеспечивающий необходимые условия реакции — рН, ионную силу раствора. Содержит соли, бычий сывороточный альбумин.
Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Если используется амплификатор с подогревающейся крышкой, этого делать не требуется.
ПраймерыСпецифичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной 18—30 оснований. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка.
После гибридизации матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы.
АмплификаторПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 °C. Современные амплификаторы позволяют задавать сложные программы, в том числе с возможностью "горячего старта", Touchdown ПЦР (см. ниже) и последующего хранения амплифицированных молекул при 4 °C. Для ПЦР в реальном времени выпускают приборы, оборудованные флуоресцентным детектором. Существуют также приборы с автоматической крышкой и отделением для микропланшет, что позволяет встраивать их в автоматизированные системы.
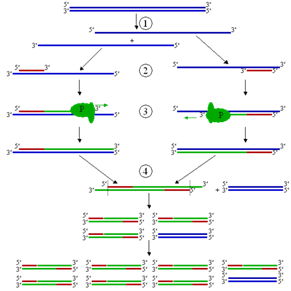
4. Ход реакцииОбычно при проведении ПЦР выполняется 20—35 циклов, каждый из которых состоит из трех стадий (рис. 1).
ДенатурацияДвухцепочечную ДНК-матрицу нагревают до 94—96°C (или до 98 °C, если используется особенно термостабильная полимераза) на 0,5—2 мин., чтобы цепи ДНК разошлись. Эта стадия называется денатурацией, так как разрушаются водородные связи между двумя цепями ДНК. Иногда перед первым циклом (до добавления полимеразы) проводят предварительный прогрев реакционной смеси в течение 2—5 мин. для полной денатурации матрицы и праймеров. Такой приём называется горячим стартом, он позволяет снизить количество неспецифичных продуктов реакции.
ОтжигКогда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от состава праймеров и обычно выбирается на 4—5°С ниже их температуры плавления. Время стадии — 0,5—2 мин. Неправильный выбор температуры отжига приводит либо к плохому связыванию праймеров с матрицей (при завышенной температуре), либо к связыванию в неверном месте и появлению неспецифических продуктов (при заниженной температуре).
ЭлонгацияДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Полимераза начинает синтез второй цепи от 3'-конца праймера, который связался с матрицей, и движется вдоль матрицы. Температура элонгации зависит от полимеразы. Часто используемые полимеразы Taq и Pfu наиболее активны при 72 °C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 7-10 мин.
Количество специфического продукта реакции (ограниченного праймерами) теоретически возрастает пропорционально 2n, где n — число циклов реакции. На самом деле эффективность каждого цикла может быть меньше 100%, поэтому в действительности P ~ (1+E)n, где P — количество продукта, Е — средняя эффективность цикла.
Число "длинных" копий ДНК тоже растет, но линейно, поэтому в продуктах реакции доминирует специфический фрагмент.
Рост требуемого продукта в геометрической прогрессии ограничен количеством реагентов, присутствием ингибиторов, образованием побочных продуктов. На последних циклах реакции рост замедляется, это называют "эффектом плато".
Рис. 1. Схематическое изображение первого цикла ПЦР. (1) Денатурация. (2) Отжиг. (3) Элонгация. (4) Закончен первый цикл.
5. Анализ ПЦР-амплифицированной ДНК
Для анализа ПЦР-амплифицированной ДНК используют разные методы, наиболее простым из которых является гель-электрофорез.
Материалы
- агароза;
- 0,5-кратный буфер для приготовления агарозного геля;
- ТБЕ-буфер для электрофореза.
Подготовка реагентов
- В колбу объемом 1 литр помещают 1,5 г агарозы, добавляют 150 мл 0,5-кратного буфера ТБЕ. Агарозу нагревают в микроволновой печи до полного расплавления.
- 20 мл концентрированного буфера ТБЕ разбавляют 480 мкл дистиллированной воды, получая буфер для электрофореза.
Оборудование
– прибор для вертикального электрофореза;
– источник питания (источник постоянного тока);
– трансиллюминатор;
– фото- или видеокамера с фильтрами для съемки в УФ;
– автоматические пипетки и наконечники.
Меры предосторожности и правила работы при постановке электрофореза
Реагент бромистый этидий является сильным мутагеном, поэтому все манипуляции проводят с использованием перчаток. Реагенты, содержащие бромистый этидий, перед утилизацией следует подвергать специальной обработке.
Обезвреживание реагентов
Отработанные гели и буфер из камеры помещают в пластиковую емкость на 5 л с плотно завинчивающейся крышкой. Добавляют 1 объем 0,5 M раствора калия перманганата и 1 объем 2,5 M соляной кислоты. Аккуратно перемешивают и оставляют при комнатной температуре на 4–6 ч. Затем добавляют 1 объем 2,5 M натрия гидроксида, аккуратно перемешивают. Сбрасывают нейтрализованные реактивы в канализацию.
Постановка
- в специальную ванночку с гребенками вносят расплавленный гель и дают остыть в течение получаса;
- после застывания агарозы гребенки аккуратно достают, стараясь не повредить образовавшиеся лунки, гель смачивают в буфере ТБЕ и помещают на специальную планшету;
- вносят 5 подготовленной пробы в луночки геля;
- гель помещают в ванночку для электрофореза и подключают к источнику тока.
Учет результатов
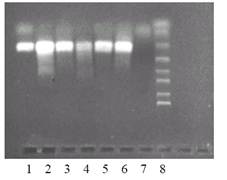
Учет результатов проводят визуально с помощью трансиллюминатора. При этом агарозный гель достают из кюветы и помещают на стекло трансиллюминатора. Продукты реакции амплификации выглядят в виде светящихся полос, наблюдаемых визуально в УФ-свете трансилляминатора. Результаты фиксируют посредством фотографирования или видеосъемки геля при использовании УФ-фильтров (рис. 2).
Рисунок 2. Фотография геля с продуктами реакции амплификации в УФ-свете трансиллиминатора
ЗАКЛЮЧЕНИЕ
ПЦР используется во многих областях для проведения анализов и в научных экспериментах.
ПЦР используют для сравнения так называемых "генетических отпечатков пальцев". Необходим образец генетического материала с места преступления — кровь, слюна, сперма, волосы и т. п. Его сравнивают с генетическим материалом подозреваемого. Достаточно совсем малого количества ДНК, теоретически — одной копии. ДНК расщепляют на фрагменты, затем амплифицируют с помощью ПЦР. Фрагменты разделяют с помощью гельэлектрофореза. Полученную картину расположения полос ДНК и называют генетическим отпечатком пальцев (genetic fingerprint).
ПЦР дает возможность существенно ускорить и облегчить диагностику наследственных и вирусных заболеваний. Нужный ген амплифицируют с помощью ПЦР с использованием соответствующих праймеров, а затем секвенируют для определения мутаций. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы до того, как проявятся симптомы заболевания.
В наше время ПЦР является одним из наиболее высокоточных методов, который используется во многих областях науки и при проведении анализов. Он является большим прорывом в области молекулярной генетики.
Похожие работы
... . Тем не менее, при условии решения проблемы конкуренции за праймеры, этот способ контроля эффективности амплификации безусловно будет весьма полезен. 4. Методы, основанные на полимеразной цепной реакции 4.1 Качественный анализ Классический способ постановки ПЦР, принципы которого были изложены выше, нашел свое развитие в некоторых модификациях, направленных на преодоление ограничений ...
... часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях. Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Следует отметить, что методом ПЦР возможно выявление возбудителей ...
... перед амплификацией. Оценку количества и эффективности очистки выделенной ДНК определяли методом полимеразной цепной реакции. Процесс оптимизации этой реакции для исследования ДНК волоса не входил в задачи данной работы. ОСНОВЫ СТРОЕНИЯ ВОЛОСА, МИКРОСКОПИРОВАНИЕ ОБЪЕКТА Прежде чем приступить к выделению ДНК из исследуемого волоса, необходимо провести его микроскопирование и установить наличие ...
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
0 комментариев