Навигация
Сахарный диабет (СД) – эндокринное заболевание, характеризующееся синдромом хронической гипергликемии, являющейся следствием недостаточной продукции или действия инсулина, что приводит к нарушению всех видов обмена веществ, прежде всего углеводного, поражению сосудов (ангиопатии), нервной системы (нейропатии), а также других органов и систем.
На рубеже веков сахарный диабет (СД) приобрел эпидемический характер, являясь одной из наиболее частых причин инвалидности и смертности. Он входит в первую триаду в структуре болезней взрослого населения: рак, склероз, диабет. Среди тяжелых хронических заболеваний у детей сахарный диабет также занимает третье место, уступая пальму первенства бронхиальной астме и детскому церебральному параличу.
Число больных диабетом во всем мире составляет 120 млн. (2,5% населения). Каждые 10-15 лет количество больных удваивается. По оценке Международного института диабета (Австралия), к 2010 году в мире будет 220 млн. больных. В Украине насчитывается около I млн. больных, из которых 10-15% страдает наиболее тяжелым инсулинозависимым диабетом (I типа). В действительности число больных в 2-3 раза больше за счет скрытых недиагностированных форм. В основном, это относится к диабету II типа, составляющего 85-90 всех случаев диабета.
Основные причины роста заболеваемости: урбанизация, малоподвижный образ жизни, дефекты питания, стрессы, "постарение" населения, а с другой стороны — своевременная диагностика, качественная терапия, профилактика хронических осложнений и снижение смертности от них.
По новой этиологической классификации (ВОЗ, 1999 г.) каждый из двух ведущих типов диабета имеет различные пути развития, свои особенности клиники и лечения.
Этиология и патогенез сахарного диабета I типа
Сахарный диабет I типа — идиопатический или аутоиммунный сочетается с антигенами НLА-системы: В8, В15, DR, DRW 3-4, которые ассоциируются с генами локуса DQ генов Fas и Fas-L. Факторами риска являются вирусы или токсические вещества, которые воздействуют на генетически детерминированные антигены системы НLА и вызывают аутоиммунную деструкцию бета-клеток островков Лангерганса. Аутоиммунная природа разрушения бета-клеток обусловлена врожденной потерей толерантности к аутоантигенам. Вирусы могут индуцировать аутоиммунную реакцию или непосредственно поражать бета-клетки, что приводит к быстрому развитию диабета. К бета-цитотропным вирусам относятся вирусы Коксаки, эпидемического паротита, ветряной оспы, кори, цитомегаловирус. Так как эти инфекции чаще поражают детей в осенне-зимние месяцы, то наблюдается сезонность повышения частоты диабета в эти периоды.
Аутоиммунное разрушение бета-клеток происходит медленно, и могут пройти месяцы и годы до нарушения углеводного обмена. Эту фазу болезни относят к доклиническому периоду. Лишь после разрушения 80-95% бета-клеток, когда возникает абсолютный дефицит инсулина, развиваются тяжелые метаболические нарушения и наступает клинический период болезни — манифестный диабет. Современные методы позволяют диагностировать предрасположенность к диабету в доклиническом периоде, до нарушения глюкозо-толерантного теста.
Патогенез сахарного диабета I типа (ИЗСД) сводится к аутоиммунному инсулиту путём активации как клеточного, так и гуморального звеньев иммунитета. Инсулит проявляется прежде всего мононуклеарной инфильтрацией островков ещё в доклиническом периоде. К моменту выявления ИЗСД островки инфильтрированы активированными лимфоцитами СД 8 (Т-супрессорами и цитотоксическими Т-лимоцитами) и лимфоцитами СД 4 (Т-хелперами). На бета-клетках появляются антигены НLА класса I и класса II (HLA-DR).
В аутоиммунной реакции клеточного звена иммунитета участвуют лимфоциты и макрофаги (моноциты). Эти клетки образуют цитокины, которые либо опосредуют клеточные реакции против бета-клеток, либо непосредственно их повреждают. Цитотоксическим действием обладают следующие цитокины: интерферон, фактор некроза опухолей В и интерлейкин-1.
При любом патогенетическом варианте развивается деструкция В-клеток. Предложены три модели деструкции В-клеток:
* Копенгагенская модель (Nerup и соавт., 1989);
* Лондонская модель (Bottazo и соавт.,1986);
* Стенфордская модель (Mc Devitt с соавт.,1987).
В последное время важное значение в деструкции В-клеток придают оксиду азота (NO). NO образуется в организме из L-аргинина под влиянием фермента NO-синтетазы. В организме имеются три изоформы NO-синтетазы: эндотелиальная, нейрональная, индуцированная (и-NO-синтетаза).
Под влиянием индуцированной (и-NO-синтетазы) образуется NO, обладающий цитотоксическим и цитостатическим эффектами.
Установлено, что под влиянием интерлейкина-1 происходит экспрессия и-NO-синтетазы в В-клетках, и в них образуется большое количество цитотоксического NO, вызывающего их деструкцию и угнетающего секрецию инсулина.
Ген и-NO-синтетазы локализуется на II хромосоме рядом с геном, кодирующим синтез инсулина. В связи с этим существует предположение, что в развитии ИЗСД имеют значение одновременные изменения структуры этих генов II хромосомы.
Помимо указанных механизмов деструкции В-клеток, большую роль играют аутоиммунные процессы. У больных обнаруживаются различные антитела к антигенам — компонентам островков: цитоплазматические, к поверхностному антигену В-клеток, комплиментзависимые цитотоксические к инсулину, проинсулину, к глутаматдекарбоксилазе — специфическому антигену В-клеток. Этот фермент катализирует превращение глутамата в ГАМК. Синтез ГД кодируется геном, расположенным на 10 хромосоме.
Антитела к компонентам В-клеток, в первую очередь и ГД, появляются за 8-10 лет до развития ИЗСД.
В патогенезе ИЗСД имеет значении также генетически обусловленное снижение способности В-клеток к регенерации. Обнаружен ген регенерации В-клеток. В норме регенерация В-клеток осуществляется в течение 15-30 суток.
Этиология и патогенез сахарного диабета II типа
Инсулинонезависимый сахарный диабет (ИНСД) II типа также является наследственным заболеванием и имеет полигенную природу. Определенные сочетания генов обусловливают предрасположенность к болезни, а её развитие и клиническое проявлении определяется такими факторами риска, как ожирение, неправильный режим питания, гиподинамия, стрессы, пожилой возраст.
Доказательством генетической обусловленности ИНСД является высокая частота заболевания у ближайших родственников больных (до 40%). В пользу наследственной природы болезни говорят и высокая распространенность ИНСД в некоторых этнических группах населения: например, среди индейцев Пима (Аризона, США) она превышает 50%.
Так как в основе патологии лежат два главных фактора — инсулинорезистентность и относительный дефицит инсулина, то и причину следует искать, по меньшей мере, в двух типах генетических дефектов. Дефекты первого типа вызывают инсулинорезистентность либо ожирение, приводящее к инсулинорезистентности. Дефекты второго типа служат причиной пониженной секреторной активности бета-клеток, либо их нечувствительности к гипергликемии.
Выделяют также моногенные формы — это юношеский ИНСД (МОДУ) с аутосомнодоминантным наследованием. Они характеризуются умеренной дисфункцией бета-клеток, началом в молодом возрасте (до 25 лет), отсутствием ожирения, кетонемии и инсулинорезистентности. На долю юношеского ИНСД приходится 15-20% всех случаев ИНСД.
Различают несколько вариантов юношеского ИНСД – МОДУ I, МОДУ 2, МОДУ 3 в зависимости от мутации различных генов. К примеру, юношеский ИНСД вариант (МОДУ 2) обусловлен мутациями гена гексокиназы. Этот ген контролирует глюконеогенез в печени и секрецию инсулина в бета-клетках. При мутации (дефекте) этого гена у больных нарушена секреторная реакция бета-клеток на глюкозу и наблюдается умеренная гипергликемия натощак и выраженная — после еды.
Из других форм описаны латентный аутоиммунный сахарный диабет взрослых (LADA), аутоиммунный диабет детей с образованием антител к белку АВВОS, к В-лактоглобулину и В-кезоину.
Патогенез ИНСД связан, в первую очередь, с инсулинорезистентностью, которая обусловлена генетическими факторами и указанными выше факторами внешней среды. Причины инсулинорезистентности скелетных мышц:
а) снижение тирозинкиназной активности инсулиновых рецепторов;
б) снижение активности гликогенсинтетазы и пируват дегидрогеназы;
в) подавление транспорта и утилизации глюкозы. Инсулинорезистентность приводит к усилению секреции инсулина бета-клетками.
По нашим данным при инсулинорезистентности выявлено снижение количества и афинности инсулиновых рецепторов в тканях, что сопровождается уменьшением транслокации ГЛЮТ-4.
Гиперинсулинемия уменьшает число рецепторов на клетках-мишенях и способствует ожирению. Бета-клетки постепенно теряют способность реагировать на повышение уровня глюкозы. В результате возникает относительный дефицит инсулина, что выражается в нарушении толерантности к углеводам.
Из-за дефицита инсулина снижается утилизация глюкозы в тканях, и усиливаются гликогенолиз и глюконеогенез в печени, что ведёт к повышению продукции глюкозы и усугубляет гипергликемию.
Кальцитониноподобный пептид по строению близок к амилину и секретируется окончаниями периферических двигательных нервов. Этот пептид активирует АТФ-зависимые калиевые каналы в мембранах бета-клеток и тем самым подавляет секрецию инсулина. Кроме того, данный пептид подавляет поглощение глюкозы скелетными мышцами.
Лептин — белок из 167 аминокислот, секретируемый адипоцитами, является важным регулятором энергетического обмена. В норме лептин подавляет секрецию нейропептида в гипоталамусе. Нейропептид участвует в формировании чувства голода и стимулирует секрецию инсулина. У лиц с ожирением, уровень лептина в сыворотке крови значительно повышен. Избыток лептина подавляет секрецию инсулина и вызывает инсулинорезистентность скелетных мыщц к жировой ткани.
В последнее время инсулинорезистентность рассматривается как общий синдром, включающий целый ряд метаболических нарушений, — нарушение толерантности к углеводам (ИНСД), ожирение, артериальную гипертонию, дислипопротеидемию и атеросклероз.
Центральную роль в патогенезе всех этих нарушений приписывают гиперинсулинемии, которая является компенсаторным следствием инсулинорезистентности.
Из клинических аспектов сахарного диабета целесообразно остановиться на классификации заболевания, которая эволюционирует в зависимости от пополнения новыми данными по расшифровке этиологии и патогенеза болезни.
Клиническая классификация сахарного диабета
До последнего времени мы использовали классификацию СД, рекомендованную Комитетом экспертов ВОЗ в 1985 году. В ней выделялось 5 типов явного сахарного диабета: ИЗСД, ИНСД, связанный с недостаточностью питания (нутритивный), симптоматический (вторичный), гистационный (диабет беременных), нарушенная толерантность к глюкозе и классы статистического риска.
Новые данные последних лет о генетических, иммунологических и метаболических особенностях развития диабета позволили установить конкретные причины и механизмы развития болезни отдельных групп ИЗСД и ИНСД. По инициативе Американской Диабетической Ассоциации Комитет экспертов ВОЗ провел дискуссии, и на рассмотрение ежегодной (34-й) конференции Европейской Диабетической ассоциации в 1998 году в Барселоне были представлены и обсуждены предложенные материалы по диагностике и классификации диабета.
Этиологическая классификация нарушений гликемии (ВОЗ, 1999г.)
1. Сахарный диабет типа I (деструкция В-клеток, обычно приводящая к абсолютной инсулиновой недостаточности):
* аутоиммунный;
* идиопатический.
2. Сахарный диабет типа II (от преимущественной резистентности к инсулину с относительной инсулиновой недостаточностью до преимущественного секреторного дефекта с или без инсулиновой резистентности).
3. Другие специфические типы диабета:
* генетические дефекты В-клеточной функции;
* генетические дефекты в действии инсулина;
* болезни экзогенной части поджелудочной железы;
* эндокринопатии;
* диабет, индуцированный лекарствами или химикалиями;
* инфекции;
* необычные формы иммунопосредованного диабета;
* другие генетические синдромы, иногда сочетающиеся с диабетом.
Похожие работы
... вам следует показывать ему дневник самоконтроля и обсуждать возникающие проблемы ЗАКЛЮЧЕНИЕ Суммируя всё вышеизложенное можно сделать следующий вывод: самоконтроль - основа успешного лечения и профилактика осложнений сахарного диабета. Система самоконтроля включает знание особенностей клинических проявлений и лечения заболевания, контроль за показателями сахара крови и мочи, диетой, ...
... закончить операцией кесарево сечение. 3.2 Показания к плановому кесореву сечению До настоящего времени абсолютных показаний к плановому кесареву сечению при сахарном диабете не существует. Тем не менее, можно выделить следующие (кроме общепринятых в акушерстве): - Выраженные или прогрессирующие осложнения диабета и беременности. - Тазовое предлежание плода. - Наличие крупного плода. - ...
... в сочетании с повышением периферической резистентности к действию инсулина, которая приводит к снижению захвата глюкозы периферическими тканями) или повышение выработки глюкозы печенью. В 98% случаев причину развития сахарного диабета II типа определить не удается — в этом случае говорят об «идиопатическом» диабете. Какое из поражений (снижение секреции инсулина или резистентность к инсулину) ...
... до состояния эйфории, экзальтации с переоценкой своих способностей, многоречивостью, пренебрежительным отношением к себе и лечению) / Селье Г ., 1979; Прихожанин В.М., 1981 и др./. В литературе выделяется несколько синдромов астенического ряда, наблюдаемых у лиц, страдающих сахарным диабетом. Вид синдрома связан с периодом сахарного диабета, отражающим прогредиентный характер заболевания. На ...
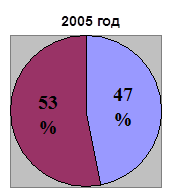
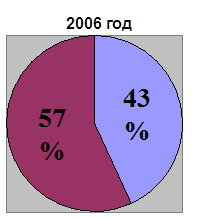
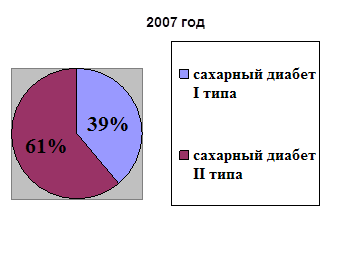
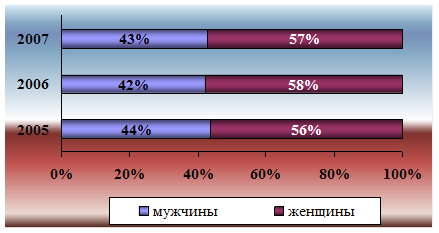
0 комментариев