Навигация
Характеристика метаболізму та життєвий цикл хламідій
4. Характеристика метаболізму та життєвий цикл хламідій
4.1 Характеристика метаболізму хламідій
Як вже згадувалось, хламідії, як енергетичні паразити живих епітеліальних клітин, використовують для свого метаболізму їх АТФ. В даний час аналіз генома показав, що хламідії здатні синтезувати АТФ, хоч і в незначних кількостях, шляхом гліколізу і розщеплювання глікогену [4].
Як було виявлено Weiss і співавт. (1964), у хламідій спостерігається анаеробний метаболізм глюкози, що проходить по шляху пептозофосфату і одного з гліколітичних шляхів. Тобто, при додаванні кофакторів яких вони потребують, хламідії можуть метаболізавати глюкозу, а також піровиноградну і глутамінову кислоти [7].
Ця активність здійснюється на низькому рівні і за цих умов приводить до втрати АТФ і НАД. Система транспорту електронів відсутній, хоча обидві частинки містять цитохром С-редуктазу. Макромолекулярний синтез клітин хазяїна гальмується хламідіями, і високоенергетичні субстанції кліток хазяїна переходять на синтез протеїнів і ліпідів хламідій. Таким чином, забезпечення мікроорганізму метаболітами здійснюється в основному за рахунок життєдіяльності клітин хазяїна. Деякі з цих метаболітів (ізолейцин) можуть бути інгібіторами зростання хламідій і, ймовірно, можуть мати відношення до латентної течії при хламідіозі [Hatch, 1975] [2].
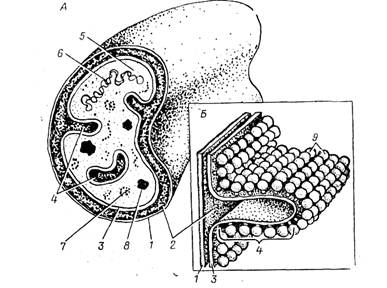
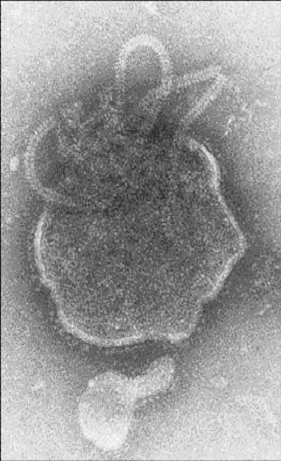
Як яскравий приклад метаболічної активності хламідій і впливу на метаболізм клітин хазяїна є дослідження Харківського ПІІ дерматології і венерології на споживання глюкози клітинами [17]. Досліди проводили на зараженій культурі клітин L-929. Утилізація глюкози інфікованою культурою достовірно вище протягом всього процесу культивування. Оскільки в інфікованій культурі інтенсивне зростання кліток не відбувається, можна припустити, що збільшення споживання глюкози кліткою пов'язано з цитоплазматичним включенням, що розвивається, тобто хламідійною інфекцією [18]. Через 5 г після зараження, коли фагосома з елементарних тілець (ET) переміщається в пластинчастий комплекс і ЕТ перетворюється на ретикулярні тільця (РT) через проміжні тільця (PT), споживання глюкози клітками культури більш ніж в 7 разів вище, норми. Можливо, в цей період активізуються біосинтетичні процеси клітини-хазяїна, продукти яких будуть використані збудником на побудову включення.
Згідно з літературними даними [19], починаючи з 10-12 г після впровадження збудника і до 36 г РT, зазнає 10-11 поділень, при цьому утворюється пул кліток, що є цитоплазматичним включенням. Звичайно цей процес закінчується до 24 г. Можливо, достовірне зниження споживання глюкози інфікованою клітиною, яке більш ніж в 4 рази вище в порівнянні з нормою, в цей період пов'язано з уповільненням її метаболічній активності при швидкому зростанні морфологічних структур збудника.
Можна припустити, що перетворення метаболічно активних РT в неактивні ЕТ, як правило, що завершується до 48 г, супроводжується розкріпаченням власних метаболічних процесів, клітини, і, як наслідок, спостерігається тенденція до збільшення споживання глюкози [18].
До 72 г цикл розвитку хламідій завершується. При мікроскопуванні препаратів спостерігали зрілі бочкоподібні включення збудника, що займають практично весь об'єм клітини. Значна частина моношару зруйнована, вміст глюкози в середовищі збільшений. І не дивлячись на це, споживання глюкози інфікованою клітиною в цей період в 3 рази вищий, норми.
Таким чином встановлено, що споживання глюкози інфікованою кліткою впродовж всього циклу розвитку збудника достовірно вищий, ніж у нормі. Спостерігаються певні кореляційні залежності між стадіями розвитку збудника і споживанням глюкози інфікованою кліткою.
Також проводилися дослідження синтезу білка в клітинах хазяїна по активності трансаміназ. Активність аланіномінотрансферази (AлT), аспартатаминотранферази (AсT) визначали по методу С. Райтмана, С. Френкеля (1957).
Так, до 24 г активність обох трансфераз у сфері культивування нормальних клітин достовірно збільшилася (AсT - в 4 рази, АлТ-в 8 разів) і залишилася на досягнутому рівні весь період, що залишився. Можна припустити, що інтенсифікація діяльності ферментів до 24 г культивування пов'язана з посиленим утворенням амінокислот в ході реакцій трансамінування, які використовуються як субстрат при синтезі білкових молекул в культурі, що активно ділиться (експоненціальна фаза зростання). До 72 г розвиток клітин в культурі виходить на плато. Крім того, спостерігається деяка тенденція до зниження активності ферментів [17].
Через 24 г після інфікування не було відмічено достовірних відмінностей між активністю ферментів в середовищі культивування нормальних клітин і в середовищі культивування інфікованих клітин, тоді як у всіх інших часових інтервалах активність ферментів в середовищі культивування інфікованих клітин була достовірно вища. Відносно низька активність ферментів в середовищі інкубації інфікованої культури клітин через 24 г може свідчити, про те, що амінокислоти інтенсивно включаються в синтез білка, і немає сенсу здійснювати ширше їх використання для інших цілей [18]. Разом з тим в період від 24 до 48 г культивування активність AлT і AсT збільшувалася майже в 2 рази, причому в цей період вона вища, ніж в нормі, відповідно в 2,9 і 3,5 рази. Це може бути пов'язане з інтенсифікацією процесу глюконеогенезу в інфікованій культурі. Дійсно, згідно з літературними даними [19]. саме у цей період завершується ділення РT, починається їх перетворення в ЕТ, а при мікроскопуванні в інфікованих клітках виявили гранули глікогену. Іншою причиною такого швидкого зростання активності ферментів в середовищі може бути збільшення проникності мембран інфікованої клітки.
До 72 г активність AлT зростає ще в 2,1 рази, в цей період вона вища, ніж в нормі, в 6,7 рази, AсT, відповідно, - в 5,6 рази. У цей період закінчується цикл розвитку хламідій, клітини руйнуються і росте вміст ферменту і середовища [17].
Таким чином, виявлені достовірні відмінності у ферментативній активності клітин нормальної і інфікованої культур. Показано, що активність ферментів в середовищі культивування інфікованих кліток збільшується в процесі дослідження, що корелює з циклом розвитку збудника [17].
Деякі факти, виявлені в ході дослідження, не знайшли свого пояснення у зв'язку з тим, що хламідії в процесі пристосування до внутріклітинного паразитизму виробили унікальні структури і біосинтетичні механізми, що не мають аналогів у інших бактерій. Не пояснений той факт, що у хламідій не виявлений висококонсервативний ген Ftsz, абсолютно необхідний для клітинного ділення всіх прокаріот, оскільки він відповідальний за утворення клітинної перегородки під час ділення клітки. У хламідії відсутній пептидоглікан - компонент клітинної стінки існує як у грампозитивних, так і у грамнегативних бактерій, але при цьому в геномі містяться гени, що кодують білки, які необхідні для його повного синтезу. Передбачається, що пептидоглікан, що синтезуються, або пептидогліконовий компонент мають інші функції, відмінні від інших бактерій [4].
Похожие работы
... а присутня тільки особлива система мембран, яка містить дві первинні дегідрогенази дихального ланцюга. Під дією кисню ці мембрани зливаються, утворюють складки і перетворюються в істинні мітохондрії, які містять цитохроми. РОЗДІЛ 2. МЕТОДИ ДОСЛІДЖЕННЯ МІТОХОНДРІЙ Значних успіхів було досягнуто у вивченні мітохондрій, при цьому значну роль зіграла електронна мікроскопія, яка дала можливість ...
... зі змістом білків 8 - 58 %, вуглеводів – 6 - 37 н жирів – 4 - 85 %. У залежності від умов вирощування в значній мірі змінюється також зміст вільних амінокислот, пігментів, вітамінів, мікроелементів. Водорості, особливо мікроскопічні, характеризуються найбільш високим КПД засвоєння світлової енергії в порівнянні з іншими фотосинтезуючими організмами. Багато видів здатні до ефективної утилізації сві ...
... синтезовані хімічним шляхом з'єднання, що не зустрічаються в природі, також атакуються мікробами. Всі викладені вище відомості, що становлять лише фрагменти того, що відомо сучасній мікробіології, та екології бактерії дають підставу зробити висновок про величезну й виняткову роль мікроорганізмів у круговороті речовин у природі. Види зелених водоростей та їх екологічне значення Зелені водорості ...
... Кролівництво та хутрове звірівництво кролі лисиця норка нутрія песець Рикетсійній кератокон'юктивіт Загальна інформація Рикетсійний кератокон’юнктивіт (keratokonynctivitis richetsion) – гостре інфекційне захворювання тварин з ураженням очей з розвитком катарального кон’юнктивіту і кератиту. Патогенез Не вивчено. Симптоми Інкубаційний період триває 10-12 діб. Перебіг хвороби гострий ...

0 комментариев