Навигация
Антиноцицептивные системы и рецепторы
2. Антиноцицептивные системы и рецепторы
Различают 4 антиноцицептивные системы: нейронную опиатную (энкефалиновую), гормональную опиатную (эндорфиновую), нейронную неопиатную (адренергическую, дофаминергическую, серотонинэргическую и пр.), гормональную неопиатную (пептиды и другие регуляторы). Однако такое деление весьма условно, так как все они весьма тесно взаимосвязаны между собой как функционально, так и морфологически.
Наиболее изучены на сегодняшний день опиоидэргические механизмы регуляции боли. Опиатные рецепторы имеются на всех уровнях антиноцицептивной системы, но наибольшие их скопления обнаруживаются в релейных станциях переключения ноцицептивной импульсации и особенно в заднем (дорсальном) роге спинного мозга, в нисходящих ингибирующих путях от головного к спинному мозгу, гигантоклеточном ядре и таламусе. Наибольшее практическое значение имеют три основных типа опиатных рецепторов: m- (мю), k- (каппа) и d- (сигма) рецепторы. Плотность их распределения в разных отделах мозга неодинаковая. В коре головного мозга преобладают k-рецепторы, а «d-» больше, чем «m-». В стволе же мозга и спинном мозге содержание «d-» и «m-» примерно одинаковое и больше, чем «k-».
Активация m-рецепторов приводит к спинальной и супраспинальной аналгезии, причем подавляются все ноцицептивные реакции, вызываемые термическим, механическим, электрическим или химическим болевым раздражением. Воздействующие на них препараты кроме аналгезии вызывают эйфорию, седативный эффект, гипотермию, психическую и физическую лекарственную зависимость, угнетение дыхательного центра и желудочно-кишечного тракта.
d-рецепторы обеспечивают аналгезию, в том числе и спинальную, что объясняется высокой плотностью этих рецепторов во внешних слоях задних рогов спинного мозга, угнетение дыхания. Их активация вызывает изменение поведенческих реакций.
k- рецепторы в эксперименте наиболее эффективны на моделях так называемой висцеральной боли. Однако по клинической эффективности их агонисты уступают агонистам m-рецепторов. Обеспечивают седативный, психомиметический (в том числе галлюцинации), а также симпатоактивирующий эффект, учащение дыхания, манию, миоз.
На современном этапе доказано существование не только отдельных типов рецепторов, но и их подтипов (изорецепторов), аналогично тому, как подразделяются рецепторы классических нейромедиаторных систем.
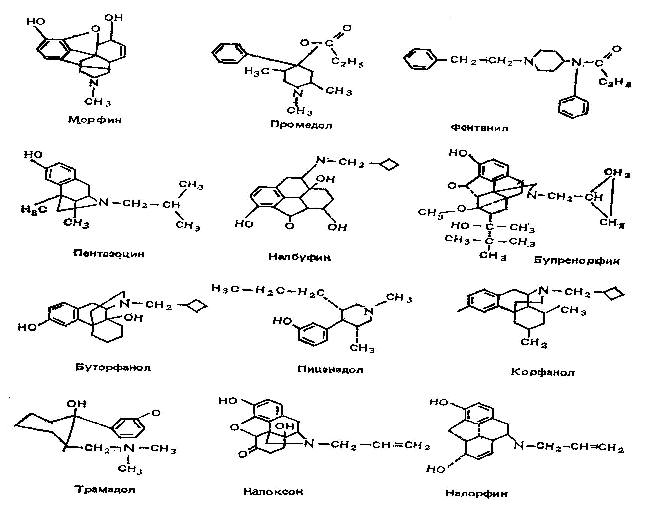
В зависимости от характера взаимодействия с опиатными рецепторами опиаты (вещества, извлекаемые из опия) и опиоиды (вещества естественного или искусственного происхождения, имеющие сходство с морфином по фармакологическим свойствам) могут быть агонистами, частичными агонистами, антагонистами и агонистами-антагонистами.
Препараты, которые при воздействии на рецепторы вызывают развитие максимально полного эффекта, называют агонистами. Частичные агонисты слабее активируют рецепторы и вызывают реакцию, не достигающую максимальной, поэтому они слабее полных агонистов. Антагонисты связываются с рецепторами, но не активируют их. Одни и те же препараты могут возбуждать одни рецепторы и блокировать другие (смешанный тип действия - агонисты-антагонисты).
Используемые в анестезиологии опиаты и опиоиды обладают различным сродством к опиатным рецепторам, что необходимо учитывать в практической деятельности. Например, одновременное применение агонистов с агонистами-антагонистами может привести к ослаблению аналгетического эффекта.
Эндогенные опиоидные вещества, обусловливающие активацию этих рецепторов, называются лигандами. Наибольшее значение из них имеют два типа: эндорфины и энкефалины. Они являются пептидами и в организме подвергаются действию пептидаз. Энкефалины обладают высоким сродством к d-рецепторам и сравнительно небольшим - к k-рецепторам. Для эндорфинов (b-эндорфин) характерен равный аффинитет к m- и d-рецепторам, но они слабо взаимодействуют с k-рецепторами.
Энкефалины (мет-энкефалин и лей-энкефалин) присутствуют в органах желудочно-кишечного тракта, в симпатической нервной системе и в надпочечниках (в их мозговом слое). Заметное их количество находят в зонах ЦНС, участвующих в антиноцицепции: в периакведуктальном сером веществе (центральное серое вещество), в ростровентрикулярной части продолговатого мозга, в пластинах Рекседа I, II, V и Х. Они образуются в гипофизе и гипоталамусе и оттуда поступают в нейрогипофиз. Предполагается, что они выполняют функцию нейротрансмиттеров и нейромодуляторов, контролируя высвобождение различных нейромедиаторов.
Эндорфины локализуются в секреторных гранулах гипофиза и высвобождаются вместе с АКТГ. Они представлены β-эндорфином, который образуется в результате гидролиза β-липотропина, не обладающего опиатоподобной активностью. β-эндорфин обнаруживается в гипоталамусе, периакведуктальном сером веществе и в области голубоватого места, где ему отводится роль нейромедиатора и нейромодулятора. Он выделяется и в кровь, а также в спинномозговую жидкость, что позволяет ему контактировать с опиатными рецепторами, расположенными на всех уровнях ноцицептивной системы, включая периферические рецепторы.
Эндогенная опиоидная система, через которую реализуется действие опиоидных аналгетиков, не имеет непосредственного отношения к регуляции реакций организма на боль. Эта регуляция происходит посредством других центральных, но неопиатных механизмов. Среди них важнейшее место принадлежит адренергическим структурам, осуществляющим регуляцию гемодинамических сдвигов при боли, не поддающихся коррекции опиатами. Значительная часть адренергических структур сосредоточена в латеральном отделе ствола и промежуточном мозге, особенно ими богата ретикулярная формация. Часть их аксонов идет к коре, другая – к нижележащим образованиям мозга. Если активировать центральные адренергические структуры, то формируется аналгезия с подавлением эмоционально-поведенческих и гемодинамических проявлений боли. Причем адренергические механизмы супрасегментарного уровня регулируют гемодинамические реакции с участием α2-рецепторов, а сегментарно-поведенческие проявления реализуются через α1-адренорецепторы. В настоящее время имеются веские доказательства сопряженного участия опиоидергических и адренергических механизмов в регуляции болевой чувствительности. Угнетение ноцицептивных реакций под влиянием опиатов и опиоидов обусловлено усилением процессов нисходящего торможения структур спинного мозга, которое реализуется через норадренергические системы. Установлено совместное распределение на всем протяжении спинного мозга симпатических преганглионарных нейронов и энкефалинергических волокон и обнаружено, что α-адренорецепторы и опиатные рецепторы локализуются в одних и тех же поверхностных слоях задних рогов спинного мозга. Адрено- и опиатные рецепторы могут взаимодействовать и модулировать ноцицептивную передачу в спинном мозге. Взаимодействие адренергических и опиоидергических механизмов может осуществляться через разные рецепторы, но с последующим запуском общего аналгетического механизма на уровне головного и спинного мозга. Фармакологическое воздействие на α2-адренорецеторы их агонистами (клонидин/клофелин, гуанфацин, левадопа) в значительной степени устраняет прессорные реакции кровообращения при боли, вызывает гипоалгезию и значительно повышает аналгетическое действие наркотических анальгетиков, что находит применение в клинической практике.
Болеутоляющее действие адренопозитивных средств не изменяется в условиях блокады опиатных рецепторов, но снижается при использовании антагонистов α-адренорецепторов. Эти данные свидетельствуют о том, что адренергические механизмы не просто корректируют гемодинамический ответ на боль, но и обладают самостоятельным болеутоляющим действием. Полагают, что эффект их обусловлен угнетением нейронов спинного мозга и тех структур головного мозга, которые специфичны для формирования нейрофизиологических ответов при ноцицептивных воздействиях.
Дофаминовая система также принимает участие в регуляции боли. Уменьшение аналгезии при стрессе дает блокада дофаминовых рецепторов галоперидолом, а активация дофаминергической системы усиливает анестезию морфином. Известно несколько дофаминергических пучков, берущих начало в различных отделах головного мозга. Первый – мезостриальный – начинается в клетках компактной зоны и латеральной части черного ядра и проецируется в вентральную часть центрального серого вещества, хвостатого ядра, переднюю цингулярную, прифронтовую кору. Аксоны мезолимбического пути берут начало в нейронах интерпедикулярных ядер, и их терминали оканчиваются в обонятельных бугорках, ложе ядер терминальных полосок и перегородке.
Центральные механизмы опиатной аналгезии связаны и с другими неопиатными системами ЦНС: серотонинергической и ГАМК-ергической. Установлено, что при стимуляции ядер шва ствола и среднего мозга имеет место выделение серотонина в терминалях волокон нисходящего пути, идущего через дорсолатеральный канатик к нейронам заднего рога спинного мозга. Участие серотонинергической нейромедиаторной системы в регуляции болевой чувствительности является специфическим, поскольку блокада серотониновых рецепторов препятствует развитию аналгезии, вызываемой их активацией.
Известно, что морфин снижает в 1,5 раза содержание ГАМК в ретикулярной формации и ядрах шва и примерно на такую же величину повышает содержание ГАМК в центральном сером веществе. Эти данные хорошо согласуются с существующим представлением о том, что центральное серое вещество оказывает тормозное ГАМК-ергическое влияние на нейроны ретикулярной формации и ядер шва ствола головного мозга, через которые осуществляется нисходящий контроль формирования болевого потока на сегментарном уровне. Показано, что ингибиторы ГАМК усиливают болеутоляющее действие морфина, а сама ГАМК в больших дозах ускоряет развитие и увеличение длительности морфиновой аналгезии. При длительной боли препараты, активирующие систему ГАМК (баклофен, депакин) оказывают отчетливое и стресспротективное действие в условиях развивающегося при хронической боли истощения этих защитных механизмов. ГАМК-позитивные вещества способны также усиливать действие аналгетических препаратов другого нейрохимического профиля, например клофелина, морфина. В полной мере, однако, механизмы ГАМК-ергической антиноцицепции не ясны.
В активации антиноцицептивных механизмов принимают участие и другие нейропептиды, широко представленные в ЦНС, например, бомбезин. Он в больших количествах содержится в задних рогах спинного мозга, центральном сером веществе, гипоталамусе, таламических ядрах, структурах переднего мозга. Хотя определенная связь его с уменьшением ноцицепции установлена, однако детально механизмы действия не раскрыты.
Литература
1. «Неотложная медицинская помощь», под ред. Дж. Э. Тинтиналли, Рл. Кроума, Э. Руиза, Перевод с английского д-ра мед. наук В.И.Кандрора, д. м. н. М.В.Неверовой, д-ра мед. наук А.В.Сучкова, к. м. н. А.В.Низового, Ю.Л.Амченкова; под ред. Д.м.н. В.Т. Ивашкина, Д.М.Н. П.Г. Брюсова; Москва «Медицина» 2001
2. Интенсивная терапия. Реанимация. Первая помощь: Учебное пособие / Под ред. В.Д. Малышева. — М.: Медицина.— 2000.— 464 с.: ил.— Учеб. лит. Для слушателей системы последипломного образования.— ISBN 5-225-04560-Х
Похожие работы
... в клинической практике. Одним из таких препаратов является просидол. Изучаемый новый наркотический анальгетик просидол (производное оксипиперидина), разработан в Институте химических наук им. А.Б. Бектурова МН АН РК, под руководством члена-корреспондента АН РК д.х.н. профессора Пралиева К.Д. До начала проведения клинических исследований были получены данные от создателей препарата о его ...
... , обволакивающие, адсорбирующие и др.). В этих же направлениях влияют местноанестезирующие вещества, выключающие отдельные звенья чувствительных нервов. Подавить боль можно, применяя вещества, угнетающие центральную нервную систему. Все эти средства используют при соответствующих показаниях. Но при болевых синдромах, являющихся следствием воспалительных процессов в организме, исключительно ...
... порядке для применения с целью лечения, предупреждения или диагностики заболевания у человека или животного. Лекарственные средства можно классифицировать по следующим принципам: – терапевтическое применение (противоопухолевые, антиангинальные, противомикробные средства); ...
... , лептоспироз и др.) и вторичными (вертеброгенные, после детских экзантемных инфекций, инфекционного мононуклеоза, при узелковом периартериите, ревматизме и др.). По патогенезу и патоморфологии заболевания периферической нервной системы подразделяются на невриты (радикулиты), невропатии (радикулопатии) и невралгии. Невриты (радикулиты) – воспаление периферических нервов и корешков. По характеру ...


0 комментариев