Навигация
Штам бактерій Васillus licheniformis – продуцент комплексу термостабільним амілолітичні і протеолітичних ферментів
1.4.2 Штам бактерій Васillus licheniformis – продуцент комплексу термостабільним амілолітичні і протеолітичних ферментів
Суть винаходу: винахід відноситься до біотехнології і може бути використане в спиртовому, крохмале-патоковому, пивоварному, хлібопекарському, кондитерському, плодово-ягідному, текстильному виробництвах, де потрібні ферменти, стійкі до підвищених температур. Штам бактерій Bacillus licheniformis ВКМ У-2184 Д виділений селекційним шляхом при вивченні природної мінливості штаму МКПМ В-6508 із застосуванням методів ефективного мутагенезу. Продукує комплекс, що містить не менше п'яти термостабільних амілолітичних і протеолітичних ферментів. Активний діапазон значень рН 5,0-11,0 і температури 30-105 º С з максимальною активністю альфа-амілази при 90-95 º С, пуллуланази - при 75 º С, протеази - при 60 º С. Перспективний для одночасної обробки крохмалю або крохмалевмісних сировини з метою його глибокого гідролізу і як продуцент лужних протеаз для глибокого розщеплення білків до амінокислот. Штам має підвищену здатність синтезу комплексу термостабільним амілолітичні і протеолітичних ферментів, що володіє також бета-глюканазной і ламінаріназной активностями.
Номер патенту: 2177995
Клас (и) патенту: C12N1/20, C12N9/28, C12N9/44, C12N9/56, C12N1/20, C12R1: 10
Номер заявки: 98102082/13
Дата подачі заявки: 05.02.1998
Дата публікації: 10.01.2002
Заявник (и): Товариство з обмеженою відповідальністю Науково-виробнича компанія "Фермтек"
Автор (и): Цурікова Н.В.; Нефедова Л.І.; Окунєв О.Н.; Синицин А.П.; Черноглазов В.М.
Патентовласник (и): Товариство з обмеженою відповідальністю Науково-виробнича компанія "Фермтек"
Опис винаходу: винахід відноситься до галузі біотехнології, а саме до отримання комплексу амілолітичних і протеолітичних ферментів, і може бути використане в мікробіологічнійпромисловості. Амілолітичні ферменти широко використовуються для розрідження або перетворення крохмалю і крохмалевмісної рослинної сировини в такі продукти, як мальтодекстрин, цукрові сиропи, декстрозу, мальтозу, глюкозу та ін При промисловому використанні амілолітичних ферментів необхідні термостабільні ферменти, що обумовлені їх здатністю вести гідроліз сировини при високих температурах - 80-100 º С, що дуже важливо з точки зору ведення процесу клейстерізації крохмалю. При цьому поєднуються два процеси: клейстерізація крохмалю і його ферментативний гідроліз. Значно знижується вартість ферментативного процесу за рахунок скорочення дозування ферменту і тривалості гідролізу крохмалю, більш якісно ведеться підготовка сировини до розварювання - забезпечується висока ступінь гідролізу крохмалю і, як наслідок цього, збільшується вихід цільового продукту. Для переважної більшості продуцентів амілолітичних ферментів характерний переважний біосинтез одного з ферментів. Здатність до утворення комплексу ендогенних амілолітичних ферментів, особливо термостабільності, виявляється дуже рідко. У цьому зв'язку можна назвати ряд термостабільним анаеробів з роду Clostridium. Відомий штам Clostridium thermohidrosulfuricum, що синтезує комплекс, що містить термостабільні пуллуланазу і глюкоамілазу. У літературі описано декілька анаеробних термофілів з роду Clostridium, що здійснюють біосинтез амілази і пуллуланази або альфа-амілази і глюкоамілази, активних при високій температурі. Однак складність культивування анаеробних бактерій в заводських умовах робить цей спосіб отримання препарату амілолітичних ферментів практично непридатним. З літературних даних відомо, що найбільш термостабільними гідролітичними ферментами, такими як альфа-амілази, пуллуланази, а в ряді випадків і протеази є ферменти, які продукують термофільних бактерій Bacillus licheniformis. Відомий аеробний Термофіл Bacillus licheniformis, який при культивуванні на середовищі з кукурудзяної борошном оптимального для отримання продукту складу синтезує комплекс позаклітинних амілолітичні ферментів - альфа-амілазу і пуллуланазу в кількості 2 од / мл і 0,68 од / л відповідно (5). Недоліком цього штаму є низька активність продукуються ферментів, вузький спектр дії комплексу і тривалість процесу культивування (144 години). Недоліками штаму є порівняно низький рівень активності, а також висока вартість культивування через застосування висококонцентрованою живильного середовища та тривалості процесу.
Культурально-морфологічні ознаки: Клітини являють собою грампозитивні, поодинокі рухливі палички розміром 0,6-0,8 і 0,2-0,3 мк, спороутворюючі. У перші години зростання (логарифмічна фаза) утворюються ланцюжки з 2-3 клітин більш витягнутої форми, до 48-56 години зростання (стаціонарна фаза) ланцюжка розпадаються, клітини товщають, з'являються спори, що мають центральне положення і овальну форму.
2. МЕХАНІЗМ ДІЇ ТА ВЛАСТИВОСТІ АМІЛОЛІТИЧНИХ ФЕРМЕНТІВ
2.1 Властивості та структура ферментів
Принципова структура ферменту наступна: кожен фермент складається з апофермента і коферменту, які, кожен окремо, не активний, але виявляють свою дію в комплексі - холоферменті. Всі ферменти мають білкову природу. Вони являють собою або прості білки, цілком побудовані з поліпептидних ланцюгів і розпадаються при гідролізі тільки на амінокислоти (наприклад, гідролітичні ферменти трипсин і пепсин, уреаза), або - в більшості випадків - складні білки, що містять разом з білкової частиною (апоферментом) небілкової компонент (кофермент або простетичної групу). Багато ферменти з великою молекулярною масою проявляють каталітичну активність тільки у присутності специфічних низькомолекулярних речовин, які називаються коферментом (або кофактором). Роль коферментів грають більшість вітамінів і багато мінеральних речовин. Вітаміни РР (нікотинова кислота, або ніацин) і рибофлавін, наприклад, входять до складу коферментів, необхідних для функціонування дегідрогеназ. Цинк - кофермент карбоангідрази, ферменту, який каталізує вивільнення з крові діоксиду вуглецю, який видаляється з організму разом з повітрям, що видихається. Залізо і мідь служать компонентами дихального ферменту цитохромоксидази. Речовини, яка піддається перетворенню в присутності ферменту, називають субстратом. Субстрат приєднується до ферменту, який прискорює розрив одних хімічних зв'язків в його молекулі та створення інших; що утворюється в результаті продукт від'єднується від ферменту. Продукт теж можна вважати субстратом, оскільки всі ферментативні реакції в тій чи іншій мірі оборотні.
За типом реакцій, що каталізуються ферменти підрозділяються на 6 класів згідно ієрархічної класифікації ферментів (КФ, EC - Enzyme Comission code). Кожен клас містить підкласи, так що фермент описується сукупністю чотирьох чисел, розділених крапками. Перше число грубо описує механізм реакції, що каталізується ферментом:
КФ 1: оксидоредуктаиз, каталізують окислення або відновлення.
КФ 2: трансферази, каталізують перенос хімічних груп з однієї молекули субстрату на іншу.
КФ 3: Гідролази, каталізують гідроліз хімічних зв'язків. Приклад: естерази, пепсин, трипсин, амілаза, ліпопротеінліпаза
КФ 4: Ліази, каталізують розрив хімічних зв'язків без гідролізу з утворенням подвійного зв'язку в одному з продуктів.
КФ 5: Ізомерази, каталізують структурні або геометричні зміни в молекулі субстрату.
КФ 6: Лігази, каталізують утворення хімічних зв'язків між субстратами за рахунок гідролізу АТФ.
Будучи каталізаторами, ферменти прискорюють як пряму, так і зворотну реакції, тому, наприклад, ліази здатні каталізувати і зворотну реакцію – приєднання по подвійним зв'язкам.
Ферменти являють собою біокаталізатори білкової природи. Каталізуючи переважна більшість біохімічних реакцій в організмі, ферменти регулюють обмін речовин і енергії, граючи тим самим важливу роль у всіх процесах життєдіяльності. Всі функціональні прояви живих організмів (дихання, м'язова скорочення, передача нервового імпульсу, розмноження і т.д.) забезпечуються дією ферментних систем. Сукупністю ферментних реакцій, що каталізуються, є синтез, розпад та інші перетворення білків, жирів, вуглеводів, нуклеїнових кислот, гормонів та інших сполук.
Активність ферментів визначається їх тривимірної структурою [3]. Як і всі білки, ферменти синтезуються у вигляді лінійного ланцюжка амінокислот, яка згортається певним чином. Кожна послідовність амінокислот згортається особливим чином, і виходить молекула (білкова глобула) має унікальні властивості. Кілька білкових ланцюгів можуть об'єднуватися в білковий комплекс. Третинна структура білків руйнується при нагріванні або дії деяких хімічних речовин.
Щоб каталізувати реакцію, фермент повинен зв'язатися з одним або декількома субстратами. Білковий ланцюг ферменту згортається таким чином, що на поверхні глобули утворюється щілина, або западина, де зв'язуються субстрати. Ця область називається сайтом зв'язування субстрату. Зазвичай він збігається з активним центром ферменту або знаходиться поблизу нього. Деякі ферменти містять також сайти зв'язування кофакторів або іонів металів.
Фермент, з'єднуючись з субстратом:
• очищає субстрат від водяної «шуби»
• має у своєму розпорядженні реагують молекули субстратів в просторі за потрібне для протікання реакції чином
• готує до реакції (наприклад, поляризує) молекули субстратів.
Зазвичай приєднання ферменту до субстрату відбувається за рахунок іонних або водневих зв'язків, рідше – за рахунок ковалентних. Наприкінці реакції її продукт (або продукти) відділяються від ферменту.
У результаті фермент знижує енергію активації реакції. Це відбувається тому, що в присутності ферменту реакція йде іншим шляхом (фактично відбувається інша реакція), наприклад:
У відсутності ферменту:
А + В = АВ
У присутності ферменту:
А + Ф = АФ
АФ + В = АВФ
АВФ = АВ + Ф
де А, В - субстрати, АВ - продукт реакції, Ф - фермент.
Ферменти не можуть самостійно забезпечувати енергією ендергонічні реакції (для протікання яких потрібна енергія). Тому ферменти, що здійснюють такі реакції, сполучати їх з екзергонічними реакціями, що йдуть з виділенням більшої кількості енергії [2,7].
Похожие работы
... час як обсяги імпорту горілки впали (зокрема, імпорт російської горілки в Україну у 2006 році, порівняно з 2005, скоротився за оцінками експертів, майже на 20%, а частка російської горілки на українському ринку не переважає 1%). За оцінками експертів, до 80% імпортної продукції на алкогольному ринку Росії – українського походження, а частка її на російському ринку в цілому у першому півріччі 2006 ...
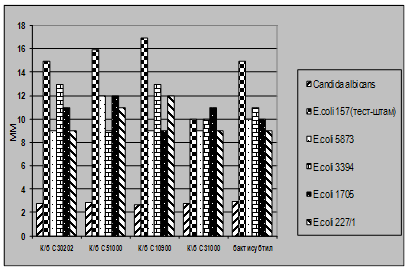
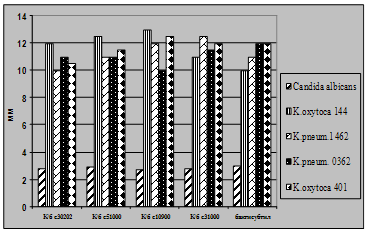
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
... Костєв Ф.І., Борисов О.В., Щегрінов М.М. Одеський державний медичний університет. Стент для довготривалого дренування верхніх сечових шляхів (54). Анотація Борисов С.О. Вибір лікувальної тактики при обструктивних нефропатіях у урологічних хворих. — Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.01.06 — урологія. — Державна Установа “Інститут ...
0 комментариев