Навигация
Сделать вывод о свежести использованного молока
1. Сделать вывод о свежести использованного молока
2. Чем вызвана кислотность молока, какая кислота образуется при скисании молока? Напишите уравнения реакции образования этой кислоты и её нейтрализацию гидроксидом натрия.
Опыт № 3. Определение кислотности хлеба [19]
Цель опыта: определить кислотность разных видов хлебобулочной продукции, проследив за изменением рН при титровании.
Форма работы: индивидуальная (в группах).
Оборудование и реактивы: хлебобулочная продукция (хлеб Дарницкий, хлеб пшеничный из сортовой муки, батон, хлеб пшеничный, приготовленном на жидких дрожжах, хлеб пшеничный обойный, хлеб ржаной из сеяной муки), 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, мешалка, фенолфталеин, датчик рН, соединительный провод для датчика, цифровая лаборатория «Архимед».
Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта:
Подготовка к анализу. Образцы разрезают пополам по ширине и от одной половины отрезают кусок (ломоть) массой около 70 г, у которого срезают корки и подкорочный слой общей толщиной 1 см. Для изделий массой менее 200 г берут целые булки, с которых срезают корки слоем приблизительно 1 см. Из кусков приготовленных изделий удаляют все включения (повидло, варенье,, изюм и т.п.), затем их быстро измельчают и перемешивают.
25 г измельченного мякиша отвешивают с погрешностью до 0,05 г. Навеску помещают в сухую бутылку (типа молочной) вместимостью 500 см3, с хорошо пригнанной пробкой. Мерную колбу вместимостью 250 см3 наполняют до метки дистиллированной водой, подогретой до температуры 60 °С. Около 1/4 взятой дистиллированной воды переливают в бутылку с хлебом, который после этого быстро растирают деревянной лопаточкой до получения однородной массы, без заметных комочков нерастертого хлеба.
К полученной смеси прибавляют из мерной колбы всю оставшуюся дистиллированную воду. Бутылку закрывают пробкой и энергично встряхивают в течение 3 мин. После встряхивания дают смеси отстояться в течение 1 мин и отстоявшийся жидкий слой осторожно сливают в сухой стакан через чистое сито или марлю.
Из стакана отбирают пипеткой по 50 см3 раствора в три конические колбы вместимостью по 100-150 см3 каждая. Затем опускают датчик рН и начинают по каплям из бюретки прибавлять 0,1 М раствор едкого натра, при включённой мешалке, до рН 8,2 (по показаниям прибора), фиксируя при этом цвет индикатора (появление розоватой окраски). Полученные данные занести в таблицу 2. Опыт повторяют 3 раза.
Таблица 2 - Кислотность хлеба
| Образец хлеба | Объём хлебной вытяжки, мл | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность хлеба, град |
| Хлеб пшеничный из сортовой муки | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб пшеничный, приготовленном на жидких дрожжах | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб пшеничный обойный | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб ржаной из обойной муки | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб ржаной из обдирной муки | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Хлеб ржаной из сеяной муки | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
Результаты измерений: вычислить кислотность образцов хлеба по формуле [29]:
Кислотность хлеба = 25·50·4·V/(250·10),
где V – объем 0,1 моль/дм3 раствора гидроксида натрия, см3; 1/10 – приведение 0,1 моль/дм3 раствора гидроксида натрия или гидроксида калия к 1 моль/дм3; 4 – коэффициент, приводящий к 100 г навески; 25 – масса навески испытуемого продукта, г; 250 – объем воды, взятый для извлечения кислот, см3; 50 – объем испытуемого раствора, взятый для титрования, см3.
Проведённое нами испытание с образцом хлеба «Сеянный», показало следующий результат: (таблица 3)
Таблица 3 - Кислотность хлеба «Сеяный»
| Образец хлеба | Объём хлебной вытяжки, мл | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность хлеба, град |
| Хлеб ржаной из сеяной муки | ||||
| Образец 1 | 50 | 4,95 | 5 | 6,25 |
| Образец 2 | 50 | 5,0 | ||
| Образец 3 | 50 | 5,05 | ||
По нашему мнению использование цифровой лаборатории «Архимед» для исследования кислотности хлеба помогает в определении, поскольку слабо-розового окрашивания фенолфталеина не появляется, даже при приливании большого избытка гидроксида натрия.
Опыт №4. Определение кислотности муки [19]
Цель опыта: определить кислотность разных сортов и видов муки, проследив за изменением рН при титровании.
Форма работы: индивидуальная (в группах).
Оборудование и реактивы: разные сорта и/или виды (пшеничная, ржаная, кукурузная) муки, 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, мешалка, фенолфталеин, датчик рН, соединительный провод для датчика, цифровая лаборатория «Архимед».
Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта: В колбу для титрования помещают 5 г муки, затем прибавляют 40 мл воды, 5-6 капель фенолфталеина. Затем опускают датчик рН, начинают регистрацию данных и приливание (по каплям) 0,1 М раствор едкого натра при включённой мешалки до рН 8,2. Опыт повторяют 3 раза. Полученные данные занести в таблицу 4.
Таблица 4 - Кислотность муки
| Образец муки | Масса муки в образце, г | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность муки, град |
| Мука пшеничная | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Мука ржаная | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
| Мука кукурузная | ||||
| Образец 1 | ||||
| Образец 2 | ||||
| Образец 3 | ||||
Результаты измерений: вычислить кислотность образцов муки по формуле:
Кислотность муки = V (NaOH) · 20 / 10
Опыт №4. Определение свежести творога [19]
Цель опыта: определить кислотность разных видов творога, проследив за изменением рН при титровании.
Форма работы: индивидуальная (в группах).
Оборудование и реактивы: разные виды творога, 0,1 М раствор гидроксида натрия, бюретка, воронка, колбы для титрованиия, мешалка, фенолфталеин, датчик рН, соединительный провод для датчика, цифровая лаборатория «Архимед».
Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 1000
Ход опыта: В колбу для титрования помещают 10 г творога (очистить от изюма и др. включений) и небольшими порциями приливают 20 мл воды, нагретой до 30-40 0С. Творог тщательно перемешивают стеклянной палочкой. Прибавляют 5 капель спиртового раствора фенолфталеина. Помещают в раствор датчик рН, начинают регистрацию данных, одновременно прибавляя 0,1 н. раствор гидроксида натрия до рН 8,2 (появления розовой окраски). Опыт повторяют 3 раза. Полученные данные занести в таблицу 5.
Таблица 5 - Кислотность творога
| Образец творога | Масса творога в образце, г | Объём, прилитого раствора NaOH, мл | Среднее значение объёма, прилитого раствора NaOH, мл | Кислотность творога, град |
| Образец творога 1 | ||||
| 1 | ||||
| 2 | ||||
| 3 | ||||
| Образец творога 2 | ||||
| 1 | ||||
| 2 | ||||
| 3 | ||||
| Образец творога 3 | ||||
| 1 | ||||
| 2 | ||||
| 3 | ||||
Результаты измерений: вычислить кислотность образцов творога по формуле:
Кислотность творога = V (NaOH) · 20
Анализ качества фармацевтических препаратов
Опыт №1. Анализ кислоты борной [21]
Кислота борная - Н3ВО3, в промышленности получают из борсодержащих минералов действием концентрированной серной кислотой:
Mg2B2O5·H2O + 2H2SO4 → 2MgSO4 + 2 Н3ВО3
Чистая кислота борная представляет собой жирные на ощупь, бесцветные, прозрачные чешуйчатые кристаллы или мелкий белый кристаллический порошок без запаха. В холодной воде растворяется плохо, в горячей хорошо. Растворима в спирте (1:25) и медленно (1:7) в глицерине.
Применение:
- в виде 2-3% растворов для полоскания горла;
- в мазях и присыпках;
- 1-2% водные растворы в глазной практике.
Кислота борная принадлежит к очень слабым кислотам: константа диссоциации её 5,75·10-10. Соли, образующиеся при титровании кислоты борной щёлочью, очень сильно гидролизуются, и раствор становится щёлочным значительно ранее достижения эквивалентной точки.
Известные методы определения кислоты борной основаны большей частью на том, что она реагирует с многоатомными спиртами, образуя более сильные комплексные кислоты, которые можно точно титровать, используя индикатор фенолфталеин. Для этой цели было предложено добавлять нейтральный глицерин. Кроме глицерина, можно применять и другие многоатомные спирты, например, манит.
Предлагаемый опыт используется на занятии «Неорганические вещества как лекарства» элективного курса «Химия и медицина».
Цель работы: провести идентификацию и количественный анализ кислоты борной, используя возможности цифровой лаборатории «Архимед».
Форма работы: фронтальная (демонстрационный опыт )
Оборудование и реактивы: 2 М раствор хлороводородной кислоты, кислота борная, глицерин, фенолфталеин, 0,1 М раствор гидроксида натрия; колба для титрования, магнитная мешалка, датчик рН.
Настройка параметров измерения:
1) частота измерений – каждую секунду;
2) число замеров – 500
Ход опыта: Количественное определение борной кислоты
Массу навески борной кислоты в 0,05 г перенесите в колбу для титрования, растворите при небольшом нагревании в 20 мл воды, охладите, добавьте 5 мл глицерина, 5 капель фенолфталеина. Опустите в стакан датчик рН и начинайте регистрацию данных при одновременном добавлении 0,1 М раствора гидроксида натрия до рН 8,2. Опыт повторите 3 раза.
Примечание:
- навеску можно растворять или в горячей воде, или при слабом нагревании;
- перед добавлением фенолфталеина и глицерина раствор обязательно охладить (под струёй холодной воды);
- титровать медленно по каплям и обязательно на белом фоне.
Определение содержания кислоты борной в процентах [21]
Содержание кислоты борной в процентах (Х) вычислите по формуле:
X= V·K·T·100 / a = V·K· 0,00618 ·100 / 0,05,
где V – объём 0,1 М раствора гидроксида натрия, мл; К – поправочный коэффициент; Т – 0,00618 г/мл; а – масса навески борной кислоты, взятая для определения, г. По требованиям ГФ Х содержание Н3ВО3 должно быть не менее 99,5%.
Задания:
Похожие работы
... литературе, студентам, изучающим русскую литературу в вузах. 2) Лингафонный кабинет предназначен для активного обучения иностранным языкам под наблюдением преподавателя с применением современных технических средств. Мультимедийные лингафонные кабинеты, которыми оснащаются современные школы, представляют собой последнее слово в технике и технологиях. Тип оборудования – встраиваемое или настольное ...
... школы. Мебель кабинета физики. Особенности оснащения и оборудования кабинета физики сельской школы. Рабочее место ученика и учителя в кабинете физики сельской школы. Кабинет физики в условиях разноуровневого обучения. Системы освещения и затемнения кабинета. Экскурсия в кабинет физики городской школы. 4. Работа заведующего кабинетом физики (5ч.) Права и обязанности заведующего кабинетом физики. ...
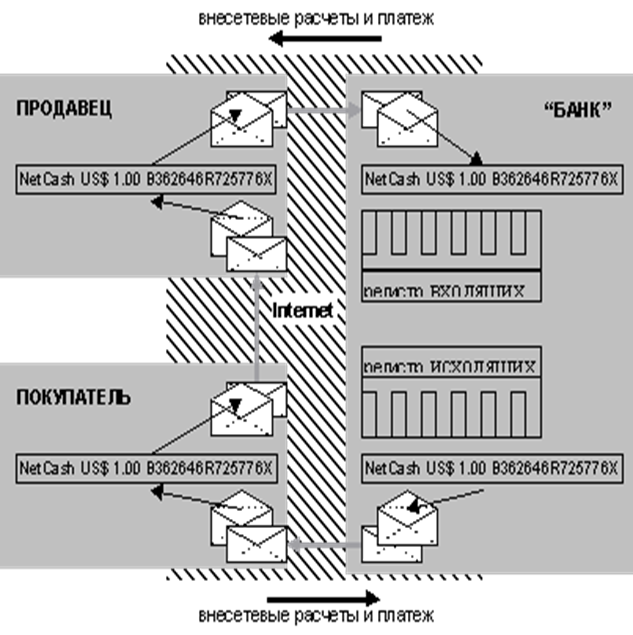
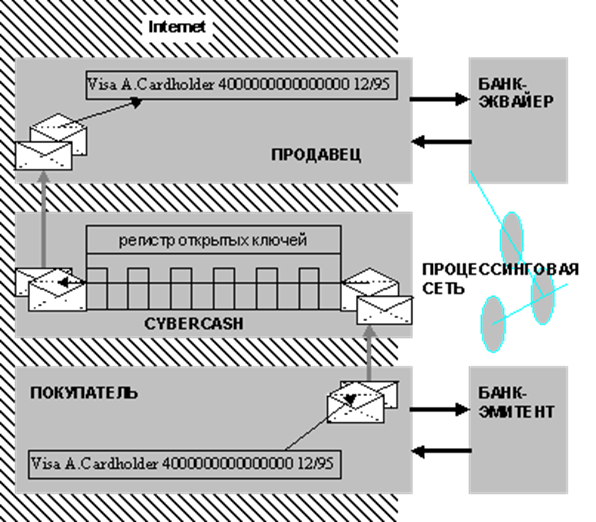
... " и т.п.), продвинутые платежные средства (такие, как цифровая наличность или цифровые чеки) фактически, с технологической точки зрения и есть реализация сложных криптографических протоколов. До недавнего времени (точнее, до середины 70-х гг.) вопроса об использовании фирмами и гражданами криптографии обычно не возникало. Однако, распространение быстродействующей вычислительной техники, с одной ...
... приборы (рычажные весы, электроскоп и др.); -работы, выполняемые на приборах, выпускаемых промышленностью. Классификация взята из [1]. В своей книге [2] С.Ф. Покровский показал, что домашние опыты и наблюдения по физике, проводимые самими учащимися: 1)дают возможность нашей школе расширить область связи теории с практикой; 2)развивают у учащихся интерес к физике и технике; 3)будят ...




0 комментариев