Навигация
Особенности векторных конструкций
1.1 Особенности векторных конструкций
В зависимости от поставленной задачи используются два типа векторов: замещающий и вставочный. Первый тип векторов позволяет заменить участок гена мишени, в то время как второй интегрирует в изучаемую последовательность. Строение обоих типов векторов одинаково, кроме ориентации фланкирующих последовательностей (рис. 2). Наиболее часто используются замещающие вектора.
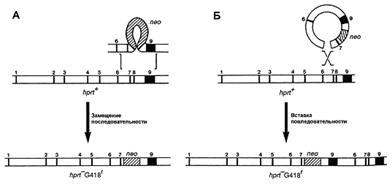
Рис. 2. Два типа векторов – замещающий (А) и вставочный (Б) – и их механизмы интеграции в геном [5].
Вектор для трансформации несет клонированную последовательность изучаемого гена, с внесенными в нее необходимыми изменениями. Это может быть: внесение стоп-кодона, приводящее к синтезу короткого неактивного пептида; делеция одного или нескольких экзонов; делеция промоторной области; вставка, приводящая к нарушению нормального функционирования гена и любые другие изменения, приводящие к отсутствию функционального продукта изучаемого гена или значительно снижающие его активность. Также в эту последовательность вносится положительный селективный маркер (МПС), которым является ген neo. Продукт этого гена дает несущим его клеткам устойчивость к антибиотикам неомицину и канамицину. Модифицированная последовательность должна быть фланкирована неизмененными участками, по которым будет проходить рекомбинация. Эффективность рекомбинации зависит от длины фланкирующих последовательностей [22], что в свою очередь зависит от возможностей вектора (рис. 3). При длине гомологичного плеча около 5 тыс. п.н. процент рекомбинации составляет 0,001.
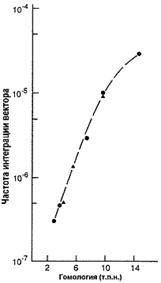
Рис. 3. Зависимость частоты интеграции вектора от длины гомологичных плеч [22].
В качестве вектора можно использовать бактериальные искусственные хромосомы (BAC), со вставками фрагментов генома мыши. В этом случае размер одного плеча может составлять до 150 тыс. п.н., а размер делеции до 25 тыс. п.н. Наилучший процент рекомбинации (8,3%) получен авторами с использованием длины плеча 110 тыс. п.н. [26].
Существует вероятность, что рекомбинация пройдет не по исследуемым нами участкам генома, а в любой другой сходной области. При этом ген neo (МПС) сохранится, и в отобранном пуле ЭСК будут присутствовать рекомбинантные клетки, не несущие необходимых изменений. Эта проблема решается внесением в векторную конструкцию маркера отрицательной селекции (МОС). Им может служить ген тимидин-киназы простого вируса герпеса (HSV-tk) или ген дифтерийного токсина А (DT-A), продукты которых убивают эукариотические клетки. Положение МОС с наружной стороны гомологичного плеча вектора позволяет элиминировать его после прохождения гомологичной рекомбинации (рис. 4). В случае же негомологичной рекомбинации, МОС оказывается интегрированным в геном трансформированной клетки, что приводит к ее элиминации. Наличие двух маркеров селекции (положительного и отрицательного) позволяет быстро и эффективно проводить отбор нужных трансформантов [23,19].
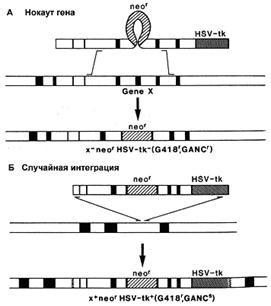
Рис. 4. Действие системы позитивной – негативной селекции: А) интеграция вектора в нужный участок генома, приводящая к нокауту гена, Б) случайная интеграция (синтез тимидин-киназы и гибель клеток) [19].
1.2 Внесение вектора в эмбриональные стволовые клетки
Для трансформации используют эмбриональные стволовые клетки мышей. Помимо того, что культура ЭС клеток способна расти in vitro, при пересадке во взрослую мышь или эмбрион клетки имеют свойство приживаться. ЭС клетки, в отличие от специализированных соматических клеток, сохраняют генетические потенции без тканевой специализации. Эти клетки имеют "минимальный" фенотип: минимум рецепторов и программ для взаимодействия с микроокружением, поскольку лишь 5% из 500 генов транссигнализации экспрессировано в пролиферирующих ЭСК. Второй важнейшей характеристикой ЭСК в культуре является практически неограниченный потенциал пролиферации, обусловленный особенностями фенотипа незрелых клеток. Третьей особенностью ЭСК является рост суспензионными клонами без какой-либо примеси продвинутых клеток, прикрепленных к подложке. Каждый клон в такой культуре является производным одной прародительской ЭСК [1].
Эмбриональные стволовые клетки мыши впервые получены в 1981 году [8], что дало возможность для развития работ по инактивации генов. Внесение линеализированного вектора в ЭС клетки возможно несколькими методами: микроинъекция, трансфекция (электропорация), трансдукция (вирусная инфекция). Перечисленные методы имеют свои преимущества и недостатки.
Микроинъекция позволяет с частотой до 100 процентов вносить экзогенную ДНК в клетку, а частота гомологичной рекомбинации составляет около 0,67%. Этот метод, несомненно, является наиболее эффективным. Однако для осуществления микроинъекции требуется дорогое оборудование и высокая квалификация экспериментатора. Помимо этого, сам метод очень трудоемок и занимает много времени. Векторные конструкции микроинъекцией можно вносить и в зиготу, но отобрать нужные трансформанты в этом случае невозможно.
Наиболее экономичными и достаточно эффективными методами внесения экзогенной ДНК в клетку являются электропорация и ретровирусная инфекция. К их достоинствам, в первую очередь, следует отнести возможность одноразово обработать сотни тысяч клеток, которые благодаря системе позитивной-негативной селекции достаточно быстро проходят отбор. Это существенно упрощает и делает экономически выгодным, по сравнению с микроинъекцией, процедуру получения трансформированных клеток. Оба метода имеют свои недостатки: больший процент негомологичной рекомбинации при внесении векторных систем электропорацией по сравнению с другими методами, ограниченые размеры ретровирусных векторов и т.д. [21]. Наиболее часто внесение векторов в клетку проводят с помощью электропорации. В то же время ретровирусная инфекция позволяет вносить экзогенную ДНК не только в ЭС клетки, но и в эмбрионы. Итак, линия трансформированных клеток получена и поддерживается. Следующий этап – внесение клеток в эмбрион мыши (как правило, на стадии бластулы). Химерный зародыш подсаживают в матку ложно беременной самки. Полученную таким образом химеру скрещивают с нормальным, но имеющим отличия (например, цвет) животным. Если полученные в первом поколении мыши имеют фенотип линии, из которой получены ЭС клетки, то их можно использовать для насыщающего скрещивания. Результатом будет получение линии животных, гомозиготных по созданной мутации.
Похожие работы
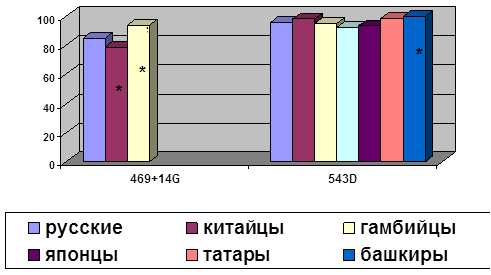
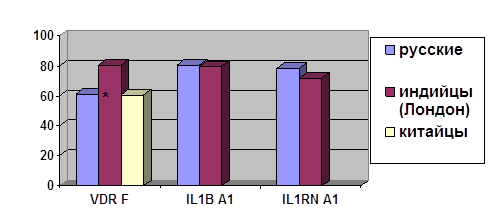
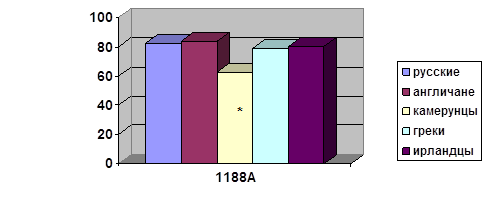
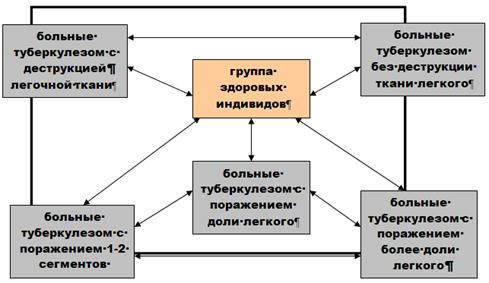
... о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания. Выводы Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем ...
... в целях получения прибыли, к монополизации рынка продовольствия и не гарантирует безопасное и полезное для общества применение данной технологии. Краткая история возникновения генетически модифицированных организмов Истоки развития генной инженерии растений лежат в 1977 году, когда и произошло открытие, позволившее использовать почвенный микроорганизм Agrobacterium tumefaciens в качестве ...
... зеркальная копия этой молекулы, а потом копия копии, и возникает молекула, тождественная исходной. ДНК – это единственная саморазмножающаяся молекула в нашем организме. Какие же задачи будет решать биология в 21 веке ? В основном биологи считают, что первая задача это старение. Здесь две точки зрения. Одна – общепринятая, что старение – это поломка сложной системы, которая рано или поздно ...
... энкефалиназ при ГТР. То есть, истощение эндогенной опиоидной системы, выражающееся в недостатке эндогенных ингибиторов ЭДФ, по-видимому, является одним из механизмов стресс-индуцированных нарушений, существенных в патогенезе некоторых видов тревожных расстройств. Полученные в нашем исследовании данные позволяют предполагать, что ГТР является одной из таких нозологий. То есть стимуляция опиоидной ...

0 комментариев