Навигация
4. Линии нок-аутных мышей
4.1 ФНО/ЛТ панель
Окраска шерсти: черные.
Происхождение: линии выведены в лаборатории молекулярной иммунологии ИМБ им. В. А. Энгельгардта РАН методом генетического нокаута и переведены на генетическую основу C57BL/6 путем возвратного скрещивания. Панель содержит линии мышей с модифицированным геном фактора некроза опухолей (ФНО) и лимфотоксина (ЛТ), подготовленные к тканеспецифической делеции гена, а также линии мышей с делецией гена ФНО или ЛТ специфично в макрофагах/нейтрофилах, либо в Т- или В-лимфоцитах, либо в клетках зародышевой линии.
Характеристика линии:
у мышей с полной делецией гена ФНО нарушена защита от ряда патогенов;
у мышей с полной делецией гена ЛТ-бета нарушена структура вторичных лимфоидных органов и антиген-специфическая продукция некоторых классов иммуноглобулинов.
Основные области использования: данные мыши представляют собой уникальную панель для изучения роли тканеспецифической продукции цитокинов семейства ФНО при врожденном и приобретенной иммунодефиците.
Ключевые публикации:
Tumanov et al. Distinct role of surface lymphotoxin expressed by B cells in the organization of secondary lymphoid tissues. Immunity. 2002 Sep;17(3):239-50.
Grivennikov et al. Distinct and nonredundant in vivo functions of TNF produced by t cells and macrophages/neutrophils: protective and deleterious effects. Immunity. 2005 Jan;22(1):93-104.
4.2 BALB/cMBD2
Окраска шерсти: белые.
Происхождение линии: линия получена в Эдинбургском Университете (Великобритания) в лаборатории Эдриана Бёрда (Adrian Bird) путем генетического нокаута гена MBD2 в мышах линии BALB/c..
Характеристика линии:
Особи женского пола имеют ослабленный материнский инстикт. У мышей наблюдается акселерация в развитии в раннем возрасте без акселерации в наборе массы тела. При переведении мутантного MBD2 локуса на генетический фон Min(APC) мышиной модели рака кишечника у животных возникает резистентность к злокачественной трансформации эпителиальных клеток.
Основные области использования:
изучение развития опухолей кишечника;
модель материнского поведения.
Линия BALB/cMBD2 используется в исследованиях, которые проводятся совместными усилиями Эдинбургского Университета и центра "Биоинженерия" РАН.
4.3 B6SJL-Tg(SOD1-G93A)dl1Gur/J
Окраска шерсти: разная: белая, коричневая, чёрная.
Происхождение: линия создана в лаборатории Mark E. Gurney при Северозападном университете США (Northwestern University, USA).
Метод модификации: трансгеноз. Трансгенные мыши G93A, экспрессируют мутантный человеческий ген Cu/Zn-супероксиддисмутазу SOD1 (Gly93/Ala; глицин замещён на аланин в позиции 93).
Характеристика линии: Трансгенные мыши G93A, экспрессирующие мутантный SOD1, характеризуются прогрессирующей дегенерацией мотонейронов, как при боковом амиотрофическом склерозе человека. Мыши становятся парализованными на одну или более конечностей в возрасте 6-7 месяцев. На фоне прогрессирования паралича скелетных мышц животные умирают через 4-6 недель после появления первых клинических признаков заболевания.
Основные области использования:
Боковой амиотрофический склероз
Нейропротекция
Подробности о данной линии животных: Gurney ME, Pu H, Chiu AY, Daly Canto MC, Polchow CY, Alexander DD, Caliendo J, Hentati A, Kwon YW, Deng HX, et al. 1994. Motor neuron degeneration in mice that express a human Cu,Zn superoxide dismutase mutation. Science 264:1772-5.
4.4 C57BL/MUC2
Окраска шерсти: C57BL/MUC2
Происхождение: линия получена в Колледже им. Альберта Эйнштейна (Нью-Йорк, США) в группе Анны Велчич (Anna Velcich) путем генетического нокаута гена Mucin2 в мышах линии C57BL/6. В Питомник "Пущино" линия поступила в 2006 году.
Характеристика: В мышах этой линии нарушена морфология кишечных криптов. В течение 10 месяцев после рождения у мышей развиваются аденомы тонкого кишечника, которые прогрессируют затем в злокачественные аденокарциномы.
Подробности: Velcich et al., Colorectal cancer in mice genetically deficient in the mucin Muc2. Science. 2002 Mar 1;295(5560):1726-9.
Основные области использования: изучение развития опухолей кишечника
4.5 C57BL/6Kaiso
Окраска шерсти: черная.
Происхождение линии: линия получена в Эдинбургском Университете (Великобритания) в группе Егора Прохорчука путем генетического нокаута гена Kaiso в мышах линии C57BL/6.
Характеристика линии:
При переведении мутантного Kaiso локуса на генетический фон Min(APC) мышиной модели рака кишечника у животных возникает резистентность к злокачественной трансформации эпителиальных клеток.
Основные области использования:
изучение развития опухолей кишечника
5. Примеры использования нокаутированных мышей для изучения функций генов и наследственных заболеваний человека
Существует много примеров использования классического нокаута генов для изучения биологических функций индивидуальных генов или семейств генов. Рассмотрим лишь некоторые из них.
Изучение функций генов.
1) Ген Nuk, член семейства рецепторов тиронинкиназы, который был изучен с помощью делеций и модификаций. У мышей с отсутствием продукта этого гена нарушался контроль прорастания нейронов к клетке-мишени. Однако белок Nuk – трансмембранный белок. Чтобы дифференцировать роль внутриклеточных и внеклеточных доменов в миграции аксонов были модифицированы участки гена, кодирующие оба типа доменов. В результате этой работы было показано, что в прорастании аксонов к мишеням основную роль играет внутриклеточный домен белка Nuk [11].
2) Для изучения процессов созревания лимфоцитов была внесена точечная мутация (стоп-кодон) в ген α-цепи рецептора иммуноглобулина. Мутантные мыши имели незначительные дефекты в раннем развитии В-лимфоцитов, но сильные отклонения в созревании и функциях зрелых лимфоцитов [24].
3) Метод классического нокаута гена был использован и для получения партеногенетических мышей. Гены Igf2 и H19 – одни из основных импринтируемых генов млекопитающих, действующих в цис-положении и играющих ключевую роль в развитии организма. При этом для нормального развития необходимо наличие как отцовского, так и материнского набора хромосом. При развитии партеногенетических зародышей, получивших обе хромосомы от матери, ген Igf2 оказывается неактивен, что приводит к терминации развития. Делеция гена H19 в одной хромосоме позволила активировать ген Igf2 и получить условно партеногенетическое животное [17,18].
Модели генетических нарушений и заболеваний человека, созданные с использованием технологии нокаута генов.
1) Мутации гена TnI были обнаружены у пациентов с гипертрофической кардиомиопатией. Чтобы изучить влияние мутации в данном гене на развитие заболевания были созданы мыши с нокаутом по гену TnI. Гомозиготные нокаутированные животные умирали через 18 дней после рождения вследствие развившейся кардиомиопатии. Таким образом была доказана непосредственная связь мутации гена TnI с данным заболеванием [13].
2) Для изучения генетических основ развития алкоголизма было инактивировано 18 генов (альдегиддегидрогеназа, рецепторы дофамина, ГАМК-рецепторы, нейропептид Y и др.), предположительно участвующих в этом процессе. Все мутанты были охарактеризованы по поведенческим и фармакологическим тестам, что позволило оценить вклад изучаемых генов в развитие заболевания [4].
3) Большая работа с использованием методики нокаута генов проводилась с целью изучения функции опиоидной системы мозга. В обзорах [15,10] проанализированы результаты работ по инактивации μ, δ и κ - опиоидных рецепторов, а также опиоидных пептидов (β-эндорфин, препроэнкефалин и препродинорфин).
4) Инактивация гена FMR-1 мыши позволила создать модель синдрома ломкой Х хромосомы и изучить отклонения в поведении животных и молекулярные механизмы заболевания [2,6,9].
5) С помощью нокаута была показана роль рецептора инсулина и внутриклеточных белков-мессенджеров в развитии диабета второго типа [30], роль цитокинов и хемокинов в развитии астмы и др. респираторных заболеваний [27]. Также показано участие генетических факторов в развитии некоторых инфекционных заболеваний [7], участие NO синтазы в развитии атеросклероза [14], влияние продукта гена, кодирующего VI-a рецептор вазопрессина, на формирование социального поведения и поведения беспокойства у мышей [3].
Выводы
Прежде ученые могли просто выявлять те или иные изменения в генетическом материале животных и пытаться с помощью отбора выделить "чистые линии" обладающих теми или иными особенностями мышей. Этот пассивный путь не давал и толики той свободы, которую исследователи обрели, научившись напрямую воздействовать на нужный ген.
Самое продуктивное использование этой технологии – "выключать" те или иные гены и смотреть, какое влияние оказало это выключение на организм животного. Таким образом можно точно установить функцию каждого гена, а значит, понять механизмы нормального развития организма и формирования определяемых наследственностью заболеваний – рака, диабета, болезней сердца и т.д.
Это "выключение" получило название "генетического нокаута" (gene knockout). В наследственном материале мышей, по современным представлениям, функционирует около двадцати тысяч генов, каждый из которых, упрощенно говоря, отвечает за какой-либо признак в организме животного. К моменту присуждения Капекки, Смитису и Эвансу нобелевской премии ученым удалось исследовать последствия выключения половины из них, то есть десяти тысяч. Как говорится в сообщении Нобелевского комитета, в ближайшем будущем генетики надеются провести последовательный нокаут каждого из мышиных генов.
Нокаут, таким образом, дает возможность "препарировать" каждое генетическое заболевание и каждый аспект нормального развития живого существа, что делает его универсальным методом, приложимым практически в любой сфере исследований.
Список литературы
1. Репин В.С. Эмбриональная стволовая клетка: от фундаментальной биологии к медицине // Успехи физиологических наук. - 2001. - Т. 32, №1. - С. 3-18
2. Тронько М.Д., Пушкарьов В.М. Механiзм дiї таксолу та перспективи його використання для лiку-вання злоякiсних пухлин щитоподiбної залози // Ендокринологiя. – 2003. – 8, № 2. – С. 228–243.
3. Пушкарьов В.М., Ковзун О. I., Тронько М.Д. та iн. Участь фосфоiнозитидiв, протеїнкiназ С та А упередачi регуляторного сигналу К+ в адренокортикальних клiтинах людини // Укр. бiохiм. журн. –2005. – 77, № 1. – С. 65–71.
4. Копнин Б.П. Мишени действия онкогенов и опухолевых супрессоров: ключ к пониманию базовых механизмов канцрогенеза // Биохимия. – 2000. – 65, № 1. – С. 5–33.
5. Тронько М.Д., Левчук Н. I., Попадюк I.Д. та iн. Дiя протипухлинного препарату таксолу на клiтинианапластичного раку щитовидної залози // Доп. НАН України. – 2006. – № 8. – С. 204–206.
6. Фiляк Є., Фiляк О., Афанасьєв С., Стойка Р. Дефiцит гену бiлка секурину (PTTG) знижує рiвеньактивацiї Т лiмфоцитiв, iндукованої лектином // Експерим. та клiн. фiзiологiя та бiохiмiя. – 2006. –№ 4. – С. 18–24.
7. Фiляк Є., Держко I., Фiляк О., Стойка Р. Втрата гену бiлка секурину (PTTG) веде до пригнiчення активацiї Т-лiмфоцитiв // Мед. хiмiя. – 2007. – № 1. – С. 11–19.
8. Анисимов В.Н. Фактор времени в многостадийном канцерогенезе // Вопр.онкол.- 1990.- T. 36.- C. 771-784.
9. Анисимов В.Н. Канцерогенез и онтогенез: основные направления и результаты исследований // Вопр. онкологии. - 1997. - Т. 43, N 1. - С. 88- 94.
10. Анисимов В.Н. Роль индуцируемой 5-бромодезокcиуридином нестабильности генома в механизмах ускоренного старения и канцерогенеза // Успехи геронтологии. - 1997. -- Т. 1. - С. 50-56.
11. Бауэр Э.С. Теоретическая биология. - М.; Л.: Изд.-во Всесоюзного института экспериментальной медицины, 1935. - 206 с.
12. Газиев А.И., Подлуцкий А.Я. Бредбери Р. Увеличение с возрастом частоты спонтанных и индуцированных g-радиацией hprt-мутаций в лимфоцитах селезенки мышей // Докл. РАН. - 1994. - Т. 339. - С. 276-278.
13.
14. Bardoni B., Mandel J.L., Fisch G.S. FMR1 gene and fragile X syndrome // Am. J. Med. Genet. - 2000. - Vol. 97, №2. - P. 153-163.
15. Bielsky I.F., Hu S.B., Szegda K.L., Westphal H., Young L.J. Profound impairment in social recognition and reduction in anxiety-like behavior in vasopressin V1a receptor knockout mice // Neuropsychopharmacology. - 2004. - Vol. 29, №3. - P. 483-493.
16. Capecchi M.R. Altering the genome by homologous recombination // Science. - 1989. - Vol. 244. - P. 1288-1292.
17. Chen L., Toth M. Fragile X mice develop sensory hyperreactivity to auditory stimuli // Neuroscience. - 2001. - Vol. 103, №4. - P. 1043-1050.
18. Evans M.J., Kaufman M.H. Establishment in culture of pluripotential cells from mouse embryos // Nature. - 1981. - Vol. 292, №5819. - P. 154-156.
19. Frankland P.W., Wang Y., Rosner B., Shimizu T., Balleine B.W., Dykens E.M., Ornitz E.M., Silva A.J. Sensorimotor gating abnormalities in young males with fragile X syndrome and Fmr1-knockout mice // Mol. Psychiatry. - 2004. - Vol. 9. - P. 417-425.
20. Henkemeyer M., Orioli D., Henderson J.T., Saxton T.M., Roder J., Pawson T., Klein R. Nuk controls pathfinding of commissural axons in the mammalian central nervous system // Cell. - 1996. - Vol. 86. - P. 35-46.
21. Kawashima S., Yokoyama M. Dysfunction of endothelial nitric oxide synthase and atherosclerosis // Arterioscler. Thromb. Vasc. Biol. - 2004. - Vol. 24, №6. - P. 998-1005
22. Kieffer B.L., Gaveriaux-Ruff C. Exploring the opioid system by gene knockout // Prog. Neurobiol. - 2002. - Vol. 66, №5. - P. 285-306.
23. Kilby N.J., Snaith M.R., Murray J.A.H. Site-specific recombinases: tools for genome engineering // Trends Genet. - 1993. - Vol. 9. - P.413-421.
24. Kono T., Obata Y., Wu Q., Niwa K., Ono Y., Yamamoto Y., Park E.S., Seo J.S., Ogawa H. Birth of parthenogenetic mice that can develop to adulthood // Nature. - 2004. - Vol. 428, №6985. - P. 860-864.
25. Loebel D.A., Tam P.P. Genomic imprinting: mice without a father // Nature. - 2004. - Vol. 428, №6985. - P. 809-811.
26. Mansour S.L., Thomas K.R., Capecchi M.R. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes // Nature. - 1988. - Vol. 336, №6197. - P. 348-352.
27. Reeves R.H. Exploring development and disease through germ-line genetic engineering in the mouse // Anat. Rec. - 1998. - Vol. 253, №1. - P. 19-23.
28. Thomas K.R., Capecchi M.R. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells // Cell. - 1987. - Vol. 51, №3. - P. 503-512.
29. Vasquez Y.R., Spina D. What have transgenic and knockout animals taught us about respiratory disease? // Respir. Res. - 2000. - Vol. 1, №2. - P. 82-86.
30. Volarevic S., Pende M., Pullen N. Manipulating mammalian genome by gene targeting // Croat. Med. J. - 1999. - Vol. 40, №3. - P. 368-374.
Похожие работы
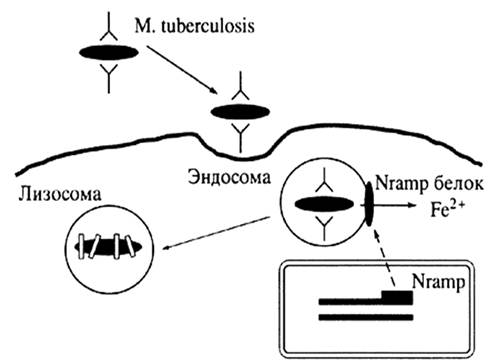
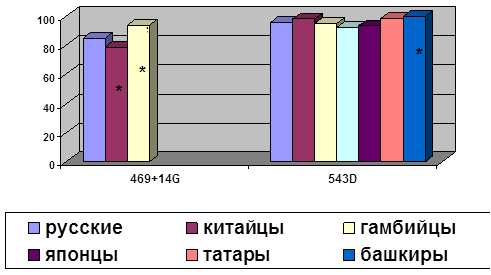
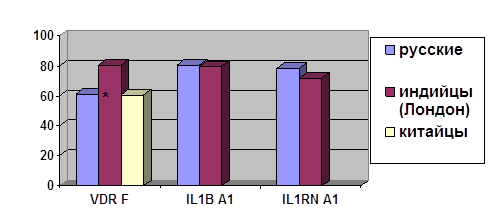
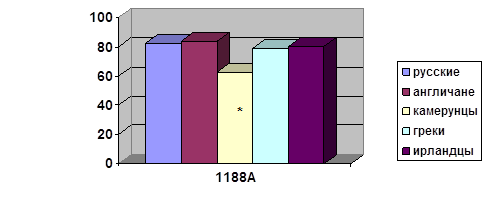
... о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания. Выводы Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем ...
... в целях получения прибыли, к монополизации рынка продовольствия и не гарантирует безопасное и полезное для общества применение данной технологии. Краткая история возникновения генетически модифицированных организмов Истоки развития генной инженерии растений лежат в 1977 году, когда и произошло открытие, позволившее использовать почвенный микроорганизм Agrobacterium tumefaciens в качестве ...
... зеркальная копия этой молекулы, а потом копия копии, и возникает молекула, тождественная исходной. ДНК – это единственная саморазмножающаяся молекула в нашем организме. Какие же задачи будет решать биология в 21 веке ? В основном биологи считают, что первая задача это старение. Здесь две точки зрения. Одна – общепринятая, что старение – это поломка сложной системы, которая рано или поздно ...
... энкефалиназ при ГТР. То есть, истощение эндогенной опиоидной системы, выражающееся в недостатке эндогенных ингибиторов ЭДФ, по-видимому, является одним из механизмов стресс-индуцированных нарушений, существенных в патогенезе некоторых видов тревожных расстройств. Полученные в нашем исследовании данные позволяют предполагать, что ГТР является одной из таких нозологий. То есть стимуляция опиоидной ...

0 комментариев