Навигация
Фиксация и окрашивание белков в геле
4. Фиксация и окрашивание белков в геле
Как только прекращается действие электрического поля, разделившиеся белковые зоны склонны «расплываться» в силу тепловой диффузии. Поэтому сразу после окончания разделения белки необходимо фиксировать в тех местах геля, куда они успели дойти. Проще всего это сделать осаждением из раствора прямо в геле. Пористость полиакриламидного геля позволяет легко изменять жидкую среду, окружающую белки, путем простого вымачивания извлеченной из формы пластинки геля в соответствующем водном растворе. Для фиксации осаждением пригодны крепкие растворы уксусной кислоты (СНзСООН) или ТХУ — трихлоруксусной кислоты. Последнюю используют в виде 10% -ного или 50% -ного раствора.
Часто фиксацию белков совмещают с их окрашиванием. Для этого краситель растворяют в ТХУ или в смеси уксусной кислоты с метанолом.
Исторически для окрашивания белков в геле были прежде всего использованы давно апробированные красители для шерсти. Это — сложные молекулы с несколькими ароматическими кольцами и заряженными группами. Механизм их взаимодействия с белками еще далеко не ясен. По-видимому, первоначальное связывание идет за счет кулоновского взаимодействия отрицательно заряженных сульфогрупп с положительно заряженными боковыми группами основных аминокислот белка. Буфер в момент окрашивания заменяется на сильно кислую среду. В ней преимущественный заряд любого белка становится положительным. В то же время краситель, несущий «сильную» SОз-группу сохраняет отрицательный заряд даже при малых значениях рН. Далее связь белка с красителем закрепляется водородными и гидрофобными связями. Для кислых белков широко используют красители класса «Кумасси яркоголубой» (Coomassie brilliant blue). Его выпускают в двух модификациях СВВ R-250 и СВВ G-250. Обилие ароматических колец в красителях этого типа делает их плохо растворимыми не только в воде и разбавленной уксусной кислоте, но даже и в 10% -ной ТХУ. В этих случаях для улучшения растворимости добавляют до 40% метанола. Если используют 50%-ную ТХУ, то в этом нет необходимости. Содержание красителя в растворе 0,1-0,25% по весу. Продолжительность окрашивания варьирует в зависимости от толщины геля в пределах от 3 до 12 часов. Для ускорения проникновения раствора в гель окрашивание можно вести при температуре 37°.
Первоначально после окончания процедуры окрашенным кажется весь гель. Но молекулы красителя не связываются акриламидом. После окончания окраски сам гель можно отмыть до полной прозрачности, вымачивая его в течение ночи в достаточно большом объеме 7%-ной уксусной кислоты. Чувствительность метода позволяет вполне надежно обнаружить полоску, содержащую 10 мкг белка.
До сих пор речь шла о кислых белках. Основные белки окрашиваются теми же красителями еще проще, так как они уже несут положительный заряд. Достаточно позаботиться о растворимости красителя и осаждении белка.
На порядок величины лучшую чувствительность дает окрашивание белков ионами серебра. После осаждения белков уксусной кислотой и этанолом, тщательной промывки этанолом и водой гель переносят на 30 минут в 5 объемов 0,1% раствора AgNO3.
Затем после промывки водой в такой же объем карбоната натрия + 0,02% формальдегида (НСНО). Инкубируют при комнатной температуре, покачивая кювету. Окрашенные полосы белка появляются через несколько минут. Следует дождаться наилучшего контраста и остановить реакцию промывкой в 1%-ной уксусной кислоте. Механизм окрашивания неясен. Но, по-видимому, он в чем-то сходен с восстановлением серебра в фотографическом процессе. Во всяком случае при проявлении окраски белков следует точно так же избегать передержки в проявителе.
Окраску белков флюоресцентными красителями, такими как «данзилхлорид» и «флюоресцамин» или «ортофталевый ангидрид», используют в тех случаях, когда желательно следить за ходом электрофоретического процесса разделения белков. Этими красителями окрашивают суммарный белковый препарат до электрофореза. Сохраняя прочную связь с белками, они мало сказываются на их электрофоретической подвижности. За движением белковых полос в геле наблюдают, освещая его ультрафиолетовым светом.
Очень высокую чувствительность при фиксации положения белковых полос после электрофреза можно получить для радиоактивно меченых белков.
Пока же заметим, что этот метод хорош для исследования белков, синтезированных in vitro с использованием радиоактивно меченых аминокислот или для белков, выделенных из бактерий ауксотрофных по какой-либо аминокислоте (не способной к ее синтезу), когда соответствующую радиоактивно меченую аминокислоту включают в питательную среду.
Литература
1 Курашвили Л.В., Бобылева Л.Н. Определение триглицеридов во фракции липопротеидов высокой плотности /Лабораторное дело. - N 7. - 1991. - С.7576.
2 Курашвили Л.В., Владимирова А.А. Содержание триглицеридов в ЛПВП у больных ишемической болезнью сердца //Кардиология. - 7-8. - 1992. - С.35-38.
3 Курашвили Л.В., Волков А.С. Прогностическая значимость определения холестерина в фракции липопротеидов высокой плотности у доноров крови // Гематология и трансфузиология. - N 5. - 1993. - С.39-41.
Похожие работы
... то их нередко удается разделить полностью — они выходят в виде довольно широких, но не перекрывающихся друг с другом пиков. Если же смесь состоит из нескольких компонентов, то на хорошее их разделение методом гель-фильтрации рассчитывать не приходится. Ведь все эти компоненты, хотя и с различной скоростью, движутся по колонке одновременно. (Другое дело истинная хроматография. Там на первый план ...
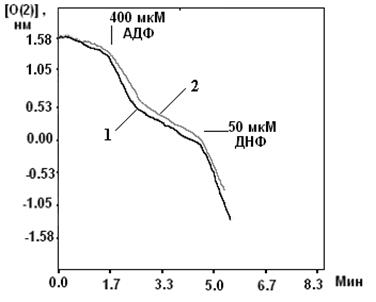
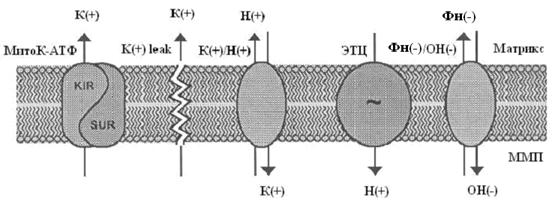
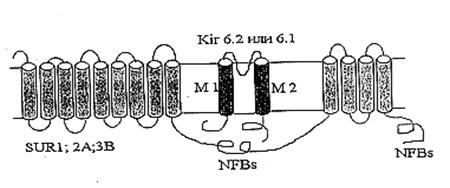
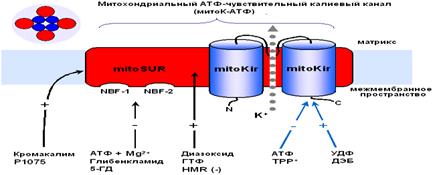
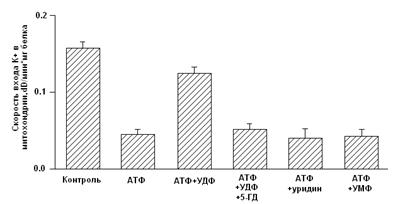
... м, в течение 10-15 мин. Группа низкоустойчивых (НУ) животных выдерживала эту высоту только в течение 1-1.5 мин. Глава 5. Результаты и обсуждения 5.1 Параметры функционирования митоКАТФ канала у крыс с различной резистентностью, а также у животных, адаптированных к гипоксии В этом разделе работы исследовались такие показатели, как дыхание МХ, скорость АТФ-зависимого К+ транспорта, ...
... а его введение животным, подвергнутым острому воздействию глутамата, приводит к активации протеиназ, отвечающих за аутофагию (лизосомальных катепсинов), и к восстановлению физиологического уровня активности кальпаиновой системы в мозге крыс, а также к улучшению других биохимических и поведенческих показателей у экспериментальных животных. Воздействие эстрадиола оказалось положительным при разных ...
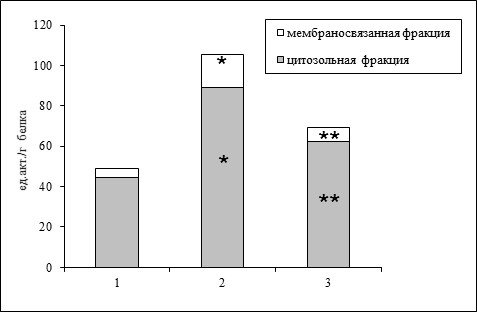
... особенностей взаимного варьирования содержания белковых фракций в анализируемых образцах нами был проведен многомерный количественного содержания белков эритроцитарных мембран человека. Была построена матрица фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов. Данная матрица представлена в таблице 2. Из нее видно, что полученные коэффициенты ...

0 комментариев