Навигация
Транскрипция генетической информации
4. Транскрипция генетической информации
Этот этап биосинтеза белков состоит в «переписывании» информации, закодированной в ДНК, на олигонуклеотидную последовательность информационной РНК и осуществляется РНК-полимеразой. Строение этого фермента лучше всего изучено у бактерий Escherichia. Это сложный белок с молекулярной массой 450 кДа. Его сердцевина включает две идентичные а-субъединицы и две различные р-субъединицы. В состав «полного» фермента входит также а-субъединица, ответственная за процесс узнавания промотора и инициацию транскрипции. Наконец, существует еще один белковый компонент, обозначаемый р-фактор, который ответственен за правильную терми-нацию транскрипции. Таким образом, РНКП Escherichia coli и ряда других грамотрицательных бактерий выглядит следующим образом:
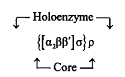
У грамположительных бактерий РНКП устроена еще сложнее. Например, в случае Bacillus subtilis она может содержать несколько а-факторов, а у ряда архебактерий РНКП состоит из 9–10 компонентов, приближаясь по сложности строения к РНКП эукариот.
В клетках эукариот обнаружено по крайней мере три типа РНКП. Полимераза I находится в ядрышке и транскрибирует гены большинства рибосомных РНК; полимераза II – в нуклеоплазме и транскрибирует большую часть других генов; полимераза III – гены транспортных РНК и одной из рРНК. Кроме того, в митохондриях и хлоропластах эукариот присутствуют собственные РНКП.
Между тем собственно полимеразная реакция может осуществляться гораздо более простыми ферментами. Так, РНКП «нечетных» ТЗ и Т7 фагов Escherichia coli состоит из единственного полипептида с молекулярной массой ПО кДа, а митохондриальная РНКП представляет собой полипептид с молекулярной массой 64 кДа.
По-видимому, сложное устройство бактериальной и, особенно, эукариотических РНКП, с одной стороны, обусловлено необходимостью «узнавать» большое число промоторов, а с другой – позволяет осуществлять многообразную регуляцию транскрипции в процессе функционирования этого фермента.
5. Регуляция процесса транскрипции
Исходя из возможности управления синтезом белковых посредников на этапе транскрипции, их можно разделить на три основные группы:
1) конститутивные белки, синтез которых не зависит от наличия субстратов и продуктов;
2) индуцибельные белки – их синтез ускоряется в присутствии субстратов;
3) репрессибельные белки, синтез которых подавляется избытком конечного продукта данного метаболического пути.
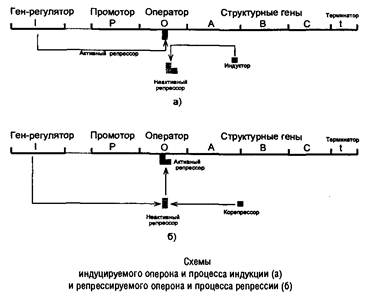
Регуляция на этапе инициации транскрипции. В 1960-е годы Ф. Жакоб и Ж. Моно установили, что в явлениях индукции и репрессии принимают участие белковые факторы – репрессоры, продукты специальных генетических элементов – генов-регуляторов, способные в определенных условиях тормозить процесс транскрипции на этапе инициации, поэтому оба этих типа регуляции относят к негативным.
В индуцируемом опероне ген-регулятор кодирует активный реп-рессор, который блокирует транскрипцию, взаимодействуя с операторным участком ДНК и препятствуя продвижению РНКП. Индуктор, представляющий собой исходный субстрат данного метаболического пути или близкое к нему соединение, способен взаимодействовать с репрессором и инактивировать его, освобождая таким образом операторный участок ДНК. В результате РНКП начинает транскрипцию данного оперона. Эти события отражены в схеме.
В репрессируемом опероне ген-регулятор кодирует неактивный репрессор, который может переходить в активное состояние и блокировать транскрипцию, соединяясь с оператором, только после взаимодействия с избытком конечного продукта данного метаболического пути. Процесс отражен в схеме.
Большую роль в регуляции транскрипции играет так называемая катаболитная репрессия, которая проявляется в диауксии в процессе роста бактерий. Феномен диауксии обнаруживается, когда в среде присутствуют два субстрата, причем ферменты, осуществляющие катаболизм одного из них, индуцибельны, а ферменты, осуществляющие катаболизм другого, конститутивны. В этом случае сначала потребляется только глюкоза, тогда как индукция лактозных ферментов не происходит до тех пор, пока не будет потреблена основная часть глюкозы. Это отражается во временном замедлении роста культуры на тот период, который необходим для индукции и синтеза р-галактозидазы. Таким образом, несмотря на присутствие в среде индуктора, альтернативный субстрат препятствует индукции.
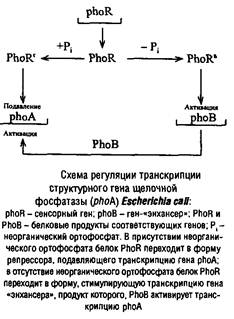
Механизм явления катаболитной репрессии состоит в следующем. Для индукции некоторых «слабых» оперонов, в том числе Дзс-оперона, недостаточно инактивации отрицательного регулятора – репрессора. Необходимо и участие положительного регулятора, представляющего собой комплекс специального активирующего белка с циклической AMP. Этот белок, активирующий транскрипцию, получил название БАК-белка или «белка, активирующего катаболитные гены». БАК-белок представляет собой димер с молекулярной массой 45 кДа. Под действием сАМР он подвергается конформационным изменениям и приобретает повышенную способность связываться с промотором. Полагают, что присоединение комплекса сАМР-БАК к ДНК ослабляет спаривание Г-Ц-оснований, способствует частичному разделению спиралей ДНК и облегчает формирование инициирующего транскрипцию комплекса РНКП с ДНК. Уровень сАМР в клетке обратно пропорционален уровню АТР, и в присутствии легко метаболизируемых субстратов, способствующих повышению уровня АТР, сАМР «не хватает» для образования комплекса с БАК.
Тонкие механизмы регуляции уровня сАМР связаны с функционированием фосфотрансферазной системы транспорта Сахаров и будут рассмотрены в главе, посвященной регуляции процессов мембранного транспорта.
Необходимо отметить, что у ряда бактерий роль глюкозы в катаболитной репрессии могут выполнять другие источники энергии, которые в этом случае тормозят катаболизм глюкозы.
В индуцибельных оперонах возможны и другие типы положительной регуляции, независимой от сАМР. Например, в арабинозном опероне Escherichia coti арабиноза не просто инактивирует репрессор, но превращает его в положительный регулятор. Аналогичное явление обнаружено в случае оперонов галактозы и рамнозы.
В дивергентных регулонах транскрипция протекает в разных направлениях и может быть некоординированной, т.е. осуществляться с разной скоростью. При этом возможно считывание с разных цепей ДНК. Примером служит аргининовый оперон: в его части, включающей 4 гена из 9, транскрипция трех генов осуществляется в одном направлении, а транскрипция другого гена – в противоположном:
![]()
Еще одним примером положительной регуляции процесса транскрипции является регуляция с участием генов – «энхансеров». Ранее считали, что этот тип регуляции характерен только для эукариот. Но в последнее время формально сходные механизмы обнаружены и у прокариот.
Особенность генов – «энхансеров» в том, что они проявляют свою стимулирующую активность независимо от ориентации и расположения относительно активируемого гена: могут находиться перед геном, за ним и даже внутри него.
Продуктами генов – «энхансеров» являются белки с молекулярной массой 25–30 кДа, способные связываться с промоторной областью. Как правило, такая система двухкомпонентна и включает «сигнальный» белок, способный «чувствовать» изменение условий окружающей среды и стимулировать синтез другого белка – «активатора», который и запускает транскрипцию искомого белкового посредника.
Перечисленные механизмы регуляции транскрипции на стадии инициации достаточно быстро реагируют на изменение внешних условий, однако управляют работой одного или небольшого числа оперонов в каждый момент времени.
Наряду с ними существуют механизмы системной регуляции, связанные с изменением функционирования одновременно большого числа оперонов.
В клетках эукариот это достигается путем конформационных перестроек хроматина, процессинга и РНК, а также за счет управления трансляцией путем формирования так называемых информосом.
В клетках прокариот системная регуляция осуществляется путем модификации специфичности работы РНКП посредством изменения ее компонентного состава. Эти механизмы вступают в действие, когда нужно активировать одновременно большое число новых промоторов или сменить матрицу. Последний случай изучен наиболее подробно на примере фагов Escherichia coii и Bacillus subtilis.
В геноме бактериофагов присутствуют три типа генов: ранние, средние и поздние, классифицируемые на основании порядка их транскрипции в ходе развития фага. Ранние гены всегда транскрибируются РНКП клетки-хозяина, а в случае транскрипции средних и поздних генов возможно несколько вариантов:
1) среди продуктов ранних генов присутствует собственная фаговая РНКП, а также белки-ингибиторы РНКП хозяина. Таким образом, происходит смена РНКП;
2) среди продуктов ранних генов присутствуют новые а-факторы, взаимодействующие с «сердцевиной» РНКП хозяина и обеспечивающие транскрипцию средних генов. Среди продуктов средних генов, в свою очередь, присутствуют белки с функциями а-факторов, которые обеспечивают транскрипцию поздних генов, Таким образом, происходит смена о-факторов;
3) среди продуктов «ранних» генов присутствуют белки, модифицирующие «сердцевину» РНКП хозяина, тогда как а-фактор хозяина сохраняется.
Регуляция транскрипции путем образования специфических а-факторов широко распространена и в бактериальных системах.
Особый а-фактор контролирует транскрипцию ряда генов азотного метаболизма. Наконец, существуют промоторы, активирующиеся только при 50°, в их транскрипции участвует фактор аЕ.
Примером системной регуляции является и регуляция процесса спорообразования у бацилл. В этот процесс вовлекаются сотни локусов, организованные в специальные структуры и разбросанные по всей молекуле ДНК. Одним из способов переключения роста на спорообразование служит изменение РНКП и, в первую очередь, ее о-фактора. Такая РНКП преимущественно транскрибирует «ранние» гены спорообразования, важную роль в котором играет также регуляция на уровне трансляции.
Другой пример системной регуляции у прокариот: при воздействии на микроорганизмы нагревания до супраоптимальной температуры наступает тепловой шок, вызывающий координированную индукцию «белков теплового шока». Транскрипция их локусов и образование главного фактора а осуществляется под контролем минорного фактора с32.
Этот механизм обеспечивает координацию процессов транскрипции и трансляции и подробнее будет обсуждаться при рассмотрении способов управления скоростью роста клеток.
Похожие работы
... от иРНК, а с другой – обеспечивает образование небольшого количества более длинных полипептидов, могущих выполнять важную функциональную роль. Регуляция биосинтеза белков путем посттрансляционной модификации Посттрансляционная модификация белков менее распространена, чем процессинг РНК. Тем не менее известны случаи, когда при развитии некоторых вирусов трансляция полицистронной матрицы ...
... , вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны. Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. ...
... организма, в том числе состав и структура синтезируемых белков. Первичная структура ДНК представляет собой определенную последовательность мононуклеотидов, каждые три из которых носят названия триплет и кодируют вполне определенную аминокислоту. Синтез белка можно условно разделить на три этапа. 1 этап – синтез информационной РНК - транскрипция. Синтез информационной РНК происходит в ядре ...
... и их переносе на рибосомы, более 60 макромолекул, входящих в состав 70S или 80S рибосом, и около 10S макромолекул, принимающих непосредственное участие в системе трансляции. Белковый синтез, или процесс трансляции, может быть условно разделен на 2 этапа: активирование аминокислот и собственно процесс трансляции. Второй этап матричного синтеза белка, собственно трансляцию, протекающей в рибосоме, ...
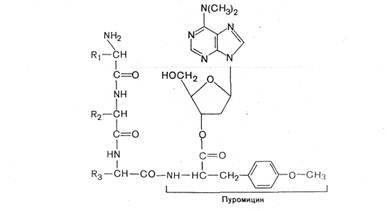
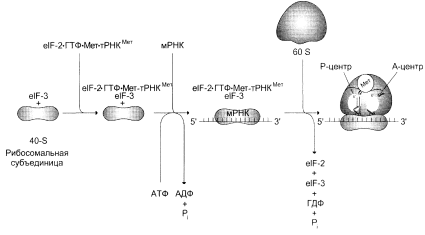
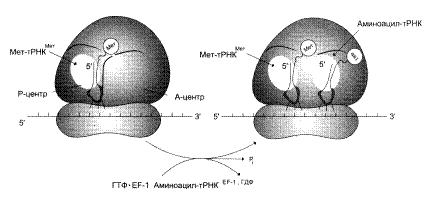
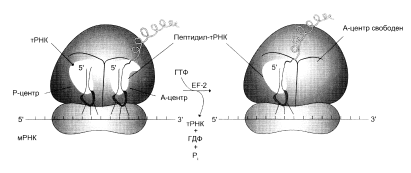
0 комментариев