Навигация
2. Практическая часть
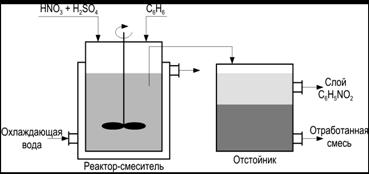
Материальный баланс процесса
| ПРИХОД | РАСХОД | |||
| Кг/ч | Кмоль/ч | Кг/ч | Кмоль/ч | |
| С6Н6 HNО3 Н2SO4 Н2О(пр) С6Н5NО2 С6Н4(NО2)2 Н2О(1) Н2О(2) Примесь бензола | 1547.94 1397.79 3900.5 1357.85 - - - - 12.48 | 19.85 22.19 39.78 75.42 - - - - - | 840.84+46.44потери 708.12 3900.5 1357.85 736.63 416.67 152.46 44.64 12.48 | 10.78+0.6потери 11.24 39.78 75.42 5.99 2.48 8.47 2.48 |
| Σ = 8216.56 | Σ = 8216.63 | |||
Mr(C6H6)=12*6+6=78 кг/кмоль
Mr(HNО3)=1+14+16*3=63 кг/кмоль
Mr(Н2SO4)=32.06+2+16*4=98.06 кг/кмоль
Mr(С6Н5NО2)=12*6+5+14+16*2=123 кг/кмоль
Mr(С6Н4(NО2)2)=12*6+4+14*2+16*4=168 кг/кмоль
Mr(Н2О)=18 кг/кмоль
1. Производительность установки по нитробензолу:
mвсего(С6Н5NО2) = 25т/сут = 25 * 1000/24 = 1041.67 кг/ч
wвсего(С6Н5NО2) = 1041.67/123 = 8.47 кмоль/ч
2. Количество прореагировавшего бензола, исходя из уравнения реакции:
wпрор(C6H6) = w(С6Н5NО2) = 8.47 кмоль/ч
mпрор(C6H6) = 8.47 * 78 = 660.66 кг/ч
3. Учитывая конверсию, всего чистого бензола было:
660.66 – 44 %
х – 100 %
х= mчист(C6H6) = 660.66 * 100/44 = 1501.5 кг/ч
4. Учитывая потери 3% масс, всего чистого бензола вступило в реакцию:
1501.5 – 97 %
х – 100 %
х = mчист всего(C6H6) = 1501.5 * 100/97 = 1547.94 кг
wчист всего(C6H6) = 1547.94/78 = 19.85 кмоль/ч
mпотерь(C6H6) = 1547.94 – 1501.5 = 46.44 кг
wпотерь(C6H6) = 46.44/78 = 0.6 кмоь/ч
5. Учитывая концентрацию бензола 99.2 % масс, технического бензола, вступившего в реакцию:
1547.94 – 99.2 %
х – 100%
х = mтех(C6H6) = 1547.94 * 100/99.2 = 1560,42 кг
mпримеси(C6H6) = 1560.42 – 1547.94 = 12.48 кг/ч
6. Массовое соотношение бензол – нитрирующая смесь 1: 4,3
на 1 кг бензола берется 43 кг нитрирующей смеси, масса нитрирующей смеси:
mсмесь = mчист всего(C6H6) * 4.3 = 1547.94 * 4.3 = 6656.14 кг
7. Состав нитрирующей смеси:
Ø азотная кислота:
6656/14 – 100 %
х – 21 %
х = m(HNО3) = 6656.14 * 21/100 = 1397.79 кг
w(HNО3) = 1397.79/63 = 22.19 кмоль/ч
Ø серная кислота
m(Н2SO4) = 6656.14 * 58.6/100 = 3900.5 кг/ч
w(Н2SO4) = 3900.5/98.06 = 39.78 кмоль/ч
Ø вода
m(Н2О) = 6656.14 * 20.4/100 = 1357.85 кг/ч
w(Н2О) = 1357.85/18 = 75.42 кмоль/ч
8. Количество воды из первой реакции:
w(Н2О)(1) = w(С6Н5NО2) =8.47 кмоль/ч
m(Н2О)(1) = 8.47 * 18 = 152,46 кг/ч
9. Не прореагировавшего бензола:
mнепр = mчист(C6H6) – mпрор(C6H6) = 840.84 кг/ч
wнепр(C6H6) = 840.84/78 10.78 кмоль/ч
10. Производительность по динитробензолу:
10т/сут = 10 * 1000/24 = 416.67 кг/ч
w(С6Н4(NО2)2) = 416.67/168 = 2.48 кмоль/ч
11. Количество нитробензола пошедшего на реакцию:
mвсего(С6Н5NО2) = w(С6Н4(NО2)2) = 2.48 кмоль/ч
mпрор(С6Н5NО2) = 2.48 * 123 = 305.04 кг
12. Количество оставшегося нитробензола:
mвсего(С6Н5NО2) – mпрор(С6Н5NО2) = 1041.67 – 305.04 = 736.63 кг
wост(С6Н5NО2) 736.63/123 = 5.99 кмоль/ч
13. Количество HNО3 прошедшего на обе реакции:
wо(HNО3) = w1(HNО3) + w2(HNО3)
w1(HNО3) = wвс(С6Н5NО2) = 8.47 кмоль/ч
w2(HNО3) = w(С6Н4(NО2)2) = 2.48 кмоь/ч
wо(HNО3) = 10.95 кмоль/ч
не прореагировавший
wост(HNО3) = wост(HNО3) - wо(HNО3) = 22.19 – 10.95 = 11.24 кмоль/ч
mост(HNО3) = 11.24 * 65 = 708.12 кг/ч
14. Масса и количество воды, полученной во второй реакции:
w(Н2О)(2) = w(С6Н4(NО2)2) = 2.48 кмоль/ч
m(Н2О)(2) = 2.48 *18 = 44.64 кг/ч
Технологические и технико-экономические показатели процесса
1. Пропускная способность установки: 8216,56 кг/ч
2. Конверсия или степень превращения бензола =
=M(C6H6) подано – M(C6H6) непрореагировало / M(C6H6) подано = 1547.94-(840.84+46.44) * 1547ю94 = 0.49 %
3. Теоретические расходные коэффициенты:
по С6Н6:
sтС6Н6 = Mr(C6H6) / Mr(C6Н5NO2) = 78 / 123 = 0,63 кг/кг;
по НNО3:
sтНNО3:= Mr(НNО3) / Mr(C6Н5NO2) = 63/ 123 = 0,51 кг/кг.
4. Фактические расходные коэффициенты:
по С6Н6:
sфС6Н6 = m(C6H6)техн / m(C6Н5NO2) = 1547.94+12.48 / 736.63 = 2.12 кг/кг;
sф НNО3 = m(НNО3)техн / m(C6Н5NO2) =1397.79+3900.5+1357.85 / 736.63 = 9.03 кг/кг.
Выход на поданное сырье C6Н5NO2 :
1) Фактический выход:
QФ = m(C6Н5NO2) = 736.63 кг;
2) Теоретический выход:
Mr(С6Н6) ¾ Mr(C6Н5NO2), 78 ¾ 123,
m(С6Н6) ¾ QТ; 1547.94 ¾ QТ ;
QТ = (1547.94 * 123) / 78 = 2440.98 кг;
Выход C6Н5NO2 по бензолу:
bС6Н6 = QФ / QТ * 100%= 736.63 / 2440.98 * 100% = 30.18%
5. Выход на превращенное сырье:
Mr(С6Н6) ¾ Mr(C6Н5NO2), 78 ¾ 123,
m(С6Н6) ¾ QТ; 660.66 ¾ QТ ;
Qт' = 660.66 * 123/78 = 1041.81 кг
β' C6Н6 = QФ / QТ * 100 % = 736.63/1041.81 *100% = 70.71 %
3. Реклама
Оптовая фирма химического сырья предлагает организацию оптовых поставок нитробензола в качестве сырья для производства анилина и селективного растворителя при очистке нефтяных смазочных масел.
Крупным химическим предприятиям
специальные скидки!!!
Заказывая нитробензол у нас вы экономите на стоимости сырья и снижаете себестоимость своей продукции!!!
Обращаться по адресу: г. Казань
ул. Магистральная 76. ООО «Нитробензолхим»
тел. 256-67-89.
Список литературы:
1. Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. Изд. 2-е, пер. М., «Химия», 1975, 736 с.
2. Юкельсон И.И. Технология основного органического синтеза. М.: «Химия», 2008, 846 с.
3. Общая химическая технология /Под ред. А.Г. Амелина. М.: «Химия», 2007, 400 с.
4. Расчеты химико-технологических процессов /Под ред. И.П. Мухленова. Л.:Химия, 2009, 300 с.
5. С.И. Вольфкович Общая химическая технология. М.: Государственное научно-техническое издательство химической литературы. 2009, 633с.
Похожие работы
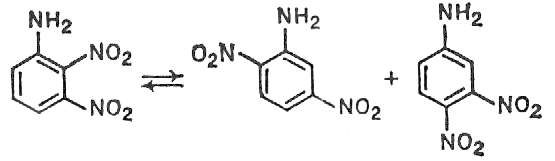
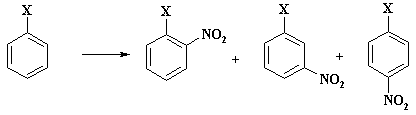
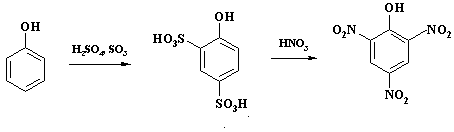
ь 1:4 Потери бензола % масс Количество денитробензола, % масс, от количества нитробензола 4 2 Теоретическая часть Производство нитробензола Нитробензол (темп, пл, +5,7°, темп. кип. 210,9°) представляет собой нерастворимую в воде желтоватую жидкость с запахом горького миндаля; ядовит, как все нитросоединения. Впервые нитрование бензола было осуществлено Митчерлихом. В ...
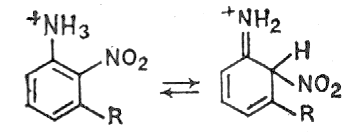
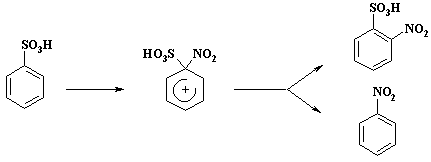
... азотной кислоты оказывается в таком случае ниже 100 %. Количество вводимой серной кислоты определяется фактором нитрующей активности Ф.Н.А. В таблице 2 приведены показатели промышленных процессов нитрования некоторых ароматических углеводородов. 1.4. Механизм нитрования ароматических углеводородов Процесс нитрования углеводородов смесью азотной и серной кислот протекает в ...
... в реакторе регулируется за счет испарения циклогексана. Гидрирование проводится при 200 °С и давлении 4 МПа (парциальное давление водорода ~0,3 МПа). Рис. 3. Технологическая схема процесса производства циклогексана: 1 — основной реактор гидрирования; 2 — вспомогательный реактор гидрирования; 3 — 5, 8 — теплообменники; 6 — сепаратор высокого давления; 7 — колонна стабилизации; 9 — сепаратор; ...
... - Примеры продукционных систем с рециклированием материалов Оценка воздействия на окружающую среду за полный жизненный цикл. Этап оценки воздействий направлен на определение значимости потенциальных воздействий на окружающую среду по результатам инвентаризационного анализа стадий жизненного цикла. В широком смысле этот процесс включает в себя увязывание между собой инвентаризационных данных с ...





0 комментариев