Навигация
Термодинамические системы подчиняются первому, второму и третьему началу термодинамики
4. Термодинамические системы подчиняются первому, второму и третьему началу термодинамики.
Традиционно начала термодинамики считают основными аксиомами. Их принято приводить к формулировке математического аппарата макроскопической термодинамики.
Вообще, аксиоматическое построение физической теории осуществляется следующим образом:
a) На основании обобщения большого числа опытных данных формируются основные исходные положения теории (аксиомы, постулаты, начала). При этом определяется не только условный язык, но и основной круг явлений описываемый при помощи данных изложений, их общие ограничения;
b) Создается математический аппарат теории;
c) Созданный аппарат применяется для исследования конкретных физических проблем, а получение результата проверяется экспериментально, что позволяет при необходимости корректировать систему исходных положений или ограничивать область их применения.
Для дальнейшего построения математического аппарата термодинамики нам необходимо рассмотреть способы описания термодинамических систем.
2. Задание состояния термодинамической системы во многом определяется тем, каким образом эта система выделяется из окружающей среды. Эта процедура неоднозначна и во многом зависит от требуемых задач исследований. В основном выделяют следующие виды систем:
1) Адиабатическая изолированная система ![]() , которую выделяют с помощью адиабатических стенок, не допускающих переноса частиц и энергии. Возможен только механический контакт систем. При этом фиксируется объем
, которую выделяют с помощью адиабатических стенок, не допускающих переноса частиц и энергии. Возможен только механический контакт систем. При этом фиксируется объем ![]() системы, количество частиц
системы, количество частиц ![]() , внешние поля –
, внешние поля – ![]() , энергия –
, энергия – ![]() (энергию всех частиц, находящихся в системе).
(энергию всех частиц, находящихся в системе).
Легко видеть, что все фиксируемые параметры системы не являются сферическими для термодинамики.
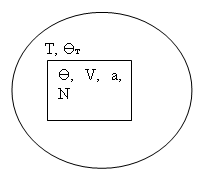
2) Система в термостате ![]() : система выделена с помощью теплопроводящих стенок, недопускающих потока частиц, но допускающих обмен энергией и механический контакт. В этом случае рассматривается не одна, а, как минимум, две термодинамические системы. Первая система является исследуемой, а вторая играет роль термометра. Последнюю принято называть термостатом Т. Единственным интересующим нас свойством термостата является знание его температуры
: система выделена с помощью теплопроводящих стенок, недопускающих потока частиц, но допускающих обмен энергией и механический контакт. В этом случае рассматривается не одна, а, как минимум, две термодинамические системы. Первая система является исследуемой, а вторая играет роль термометра. Последнюю принято называть термостатом Т. Единственным интересующим нас свойством термостата является знание его температуры ![]() , которая согласно условию термодинамического равновесия совпадает с температурой исследуемой системы:
, которая согласно условию термодинамического равновесия совпадает с температурой исследуемой системы: ![]() . (1.1)
. (1.1)

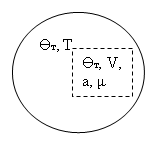
3) Система с воображаемыми стенками ![]() , мысленно выделяемая в некоторой “большой” равновесной термодинамической системе. В этом случае фиксируется объем
, мысленно выделяемая в некоторой “большой” равновесной термодинамической системе. В этом случае фиксируется объем ![]() , температура
, температура ![]() , внешние поля
, внешние поля ![]() . Число частиц зафиксировать не удается. Однако вместо него вводится новый параметр
. Число частиц зафиксировать не удается. Однако вместо него вводится новый параметр ![]() , смысл которого рассмотрен далее.
, смысл которого рассмотрен далее.

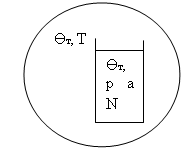
4) Система под поршнем ![]() . В этом случае система отделена от термостата теплопроводящими стенками, одна из которых подвижна. Вследствие этого давление в термостате передается системе. Таким образом, термостат по отношению к исследуемой системе играет роль не только термометра
. В этом случае система отделена от термостата теплопроводящими стенками, одна из которых подвижна. Вследствие этого давление в термостате передается системе. Таким образом, термостат по отношению к исследуемой системе играет роль не только термометра ![]() , но и манометра
, но и манометра ![]() . В этом случае фиксируются температура
. В этом случае фиксируются температура ![]() , давление
, давление ![]() , внешние поля а и число частиц
, внешние поля а и число частиц ![]() .
.
Возможны и иные способы выделения системы, но, как правило, ограничиваются указанными.
 Все перечисленные варианты совершенно эквивалентны, поскольку выбор способа описания системы не влияет на ее макроскопические характеристики системы. Заметим, что сказанное относится к равновесным системам.
Все перечисленные варианты совершенно эквивалентны, поскольку выбор способа описания системы не влияет на ее макроскопические характеристики системы. Заметим, что сказанное относится к равновесным системам.
Нечувствительность равновесного состояния термодинамической системы к выбору граничных условий может быть использована при введении ряда важных характеристик системы.
Так, энергия в адиабатически изолированной системе является заданным параметром, характеризующим сумму кинетической энергией частиц и энергии взаимодействия частиц друг с другом и внешними полями.
В случае системы в термостате энергия ![]() уже не является независимым термодинамическим параметром, а является функцией температуры
уже не является независимым термодинамическим параметром, а является функцией температуры ![]() , объема
, объема ![]() , числа частиц
, числа частиц ![]() и внешних полей
и внешних полей ![]() . В данном случае энергия уже не имеет столь простой интерпретации. Однако в силу инвариантности термодинамического описания эти величины должны совпадать:
. В данном случае энергия уже не имеет столь простой интерпретации. Однако в силу инвариантности термодинамического описания эти величины должны совпадать:
![]() . (1.2)
. (1.2)
Введенная таким образом характеристика получила название внутренней энергии системы.
Из нулевого начала термодинамики следует, что задание всех параметров равновесной термодинамической системы полностью определяет ее макроскопическое состояние. Если по каким – либо причинам две системы с одинаковыми значениями выбранного набора параметров ведут себя различным образом, выбранный набор является неполным.
Очевидно, воздействие на термодинамическую систему осуществляется через стенки, фиксирующие определенные состояния системы. Из всех воздействий на систему нам будут интересны только бесконечно малые возмущения равновесной системы, которые приводят к бесконечно малым изменениям равновесных значений термодинамических параметров.
При этом реакции термодинамической системы на внешние воздействия разбивают на две группы: реакция системы по отношению к изменению ее механических параметров, с которой связывают понятие работы, и реакция системы на тепловые воздействия.
Работа термодинамической системы представляет собой работу в механическом понимании против внешних сил, поддерживающих определенные значения термодинамических параметров системы.
Положим для определенности, что система находится в термостате. Тогда она описывается параметрами ![]() . Обозначим группу параметров, которые могут меняться извне
. Обозначим группу параметров, которые могут меняться извне ![]() через
через ![]() (
(![]() ):
):
![]() (1.3)
(1.3)
Тогда дифференциал для работы при бесконечно малом изменении ![]() :
:
![]() (1.3’)
(1.3’)
записывается на основании механической аналогии в виде:
![]() (1.4)
(1.4)
В этом смысле величины ![]() можно назвать термодинамическими “координатами”, а величины
можно назвать термодинамическими “координатами”, а величины ![]() – сопряженными к ним термодинамическими “силами”.
– сопряженными к ним термодинамическими “силами”.
Традиционно считают величину ![]() , если работу совершает термодинамическая система и
, если работу совершает термодинамическая система и ![]() , если работа совершается над системой.
, если работа совершается над системой.
Рассмотрим в качестве примера работу, связанную с изменением объема системы:
![]()
или с изменением электрических
![]()
или магнитных полей
![]() .
.
В общем виде работу под действием изменяющегося внешнего поля можно записать в виде:
![]() .
.
Таким образом, реакция системы на изменение ее параметров ![]() сводится к заданию величин
сводится к заданию величин ![]() как параметров термодинамического состояния
как параметров термодинамического состояния
![]() ,
, ![]() . (1.5)
. (1.5)
Выражение (1.5) называется уравнением состояния термодинамической системы(термическими уравнениями состояния). Так, для однородной системы имеется одно уравнение состояния:
![]() .
.
Очевидно, конечная работа перехода из состояния 1 в состояние 2 определяется из суммирования величин ![]() :
:
![]() . (1.6)
. (1.6)
Тепловые воздействия на систему осуществляется посредством сообщения ей некоторого количества тепла ![]() . Считается, что
. Считается, что ![]() , если система получает тепло и
, если система получает тепло и ![]() , когда система отдает тепло.
, когда система отдает тепло.
Обычно нагреваемые и охлажденные системы связывают с изменением ее температуры ![]() и понятием теплоемкости С:
и понятием теплоемкости С:
![]() . (1.7)
. (1.7)
Однако задание величины ![]() не имеет особого смысла, так как эта величина зависит не только от параметров состояния
не имеет особого смысла, так как эта величина зависит не только от параметров состояния ![]() , но и от типа процесса. Известно , например, что теплоемкость при изотермическом процессе принимает значение
, но и от типа процесса. Известно , например, что теплоемкость при изотермическом процессе принимает значение ![]() , а при адиабатном процессе она равна нулю.
, а при адиабатном процессе она равна нулю.
Таким образом, для характеристики реакции термодинамической системы по отношению к нагреванию необходимо наложить какие-либо дополнительные условия на теплоемкость. Наиболее очевидным является фиксация всех параметров системы кроме температуры ![]() (в нашем случае это
(в нашем случае это ![]() и
и ![]() ):
):
![]() , (1.8)
, (1.8)
где ![]() - удельная теплоемкость термодинамической системы. Уравнение (1.8) получило название калорического уравнения состояния.
- удельная теплоемкость термодинамической системы. Уравнение (1.8) получило название калорического уравнения состояния.
Состояние термодинамической системы считается полностью заданным, если заданы параметры системы, уравнение состояния (1.5) и калорическое уравнение состояния (1.8)
3. Несмотря на то, что энергетические взаимодействия весьма распространены в природе, сфера применения термодинамики не является неограниченной. Часть ограничений связана с рассмотренными ранее особенностями термодинамических систем. Кроме того, ряд ограничений связан с тем, что при исследовании термодинамических систем, в основном, рассматриваются квазистационарные (квазистатические) процессы. Их определяют как бесконечно медленные процессы, состоящие из бесконечной последовательности равновесных состояний, предельно мало отличающихся друг от друга. Таким образом, в действительности изучается не реальный процесс, а его предельный случай.
Основным преимуществом такого процесса является его обратимость.
В качестве примера рассмотрим сжатие газа в сосуде при помощи поршня. Если движение поршня осуществлять медленно, то газ успевает равномерно распределиться по всему объему сосуда. Таким образом, каждое из состояний а, б и в на рис.1.5 является равновесным. Обратное движение поршня также осуществляется через последовательность равновесных состояний (в, б и а). Это свидетельствует об обратимости квазистационарного процесса.
Пусть теперь процесс будет нестационарным (Поршень движется столь быстро, что газ в сосуде не успевает равномерно распределиться). В этом случае вблизи поршня возникают “газовые уплотнения”, области повышенной плотности по сравнению с основным объемом газа. Если движение поршня прекращается, то плотность в сосуде через некоторое время выравнивается.
В случае обратного процесса (последовательность состояний е - д- - г) вначале вблизи поршня должен образоваться “газовый сгусток”, а затем начаться обратное движение поршня. И если еще можно допустить наличие некоторой мощной флуктуации, делающей газ неоднородным с повышенной плотностью в окрестности поршня, т.е. предположить, что система заранее “узнает” о движении поршня в принципе невозможно. Кроме того, хорошо известно, что при быстром расширении газа в окрестности поршня будет наблюдаться область не повышенной, а пониженной плотности.
Таким образом, нестационарный процесс не является обратимым.
Возникает вопрос, каким критерием следует руководствоваться, чтобы считать термодинамический процесс квазистатическим? Как правило, в качестве такого критерия выбирают время перехода системы в равновесное состояние (время релаксации системы ![]() ). В том случае, если характерное изменение макроскопических параметров переходит за время
). В том случае, если характерное изменение макроскопических параметров переходит за время ![]() ,которое
,которое
![]() , (1.9)
, (1.9)
процесса принято считать квазистатическим.
Поскольку параметры состояния имеют различную физическую природу, то и характерных времен релаксации также может быть ююю, причем, они могут заметно отличаться друг от друга по величине.
Более того, для систем в различных временных масштабах используют различные способы описания. Так, выделяют:
- среднее время взаимодействия частиц ![]() ;
;
- среднее время свободного пробега ![]()
- время установления полного термодинамического равновесия.
Соответствующая физическая теория, адекватно описывающая физические процессы при этих временах, указано на рис. 1.6:
Далее нас будет интересовать время установления полного термодинамического равновесия. Эта величина существенным образом зависит от протекающего в термодинамической системе процесса. Так, время установления давления или плотности в газе определяется скоростью распространения в этой среде других волн, передающих возмущение. Характерной скоростью в этом случае является скорость звука. Тогда
![]() (1.10а)
(1.10а)
Если система является двух- или многокомпонентной, необходимо взять в качестве времени релаксации время установления равновесных концентраций:
![]() (1.10б)
(1.10б)
Здесь D – коэффициент диффузии одного из компонентов в другом. Очевидно, в многокомпонентной системе в качестве времени релаксации выбирается максимальное из времен вида (1.10б).
Время установления температуры в системе размеров L определяется из соотношения:
![]() , (1.10в)
, (1.10в)
где К – коэффициент температуропроводности.
Порядок этих величин ![]() для системы лабораторных размеров может варьироваться от долей секунды до многих часов. По этой причине при проведении эксперимента необходимо проверять выполнения условию квазистатичности исследуемых процессов.
для системы лабораторных размеров может варьироваться от долей секунды до многих часов. По этой причине при проведении эксперимента необходимо проверять выполнения условию квазистатичности исследуемых процессов.
Кроме того, из (1.10) видно, почему в системах больших размеров (масштабов) не наступает термодинамическое равновесие.
Помимо квазистатических процессов, происходящих с термодинамическими системами в целом, в ряде приложений рассматриваются неравновесные термодинамические системы, свойства которых можно характеризовать локальными значениями температуры ![]() , давления р, плотности
, давления р, плотности ![]() и т.д. Это, в первую очередь, относится к описанию стационарных явлений переноса методами макроскопической теории (величины
и т.д. Это, в первую очередь, относится к описанию стационарных явлений переноса методами макроскопической теории (величины ![]() , р,
, р, ![]() и т.д. зависят от координат
и т.д. зависят от координат ![]() ) и явлений, описываемых механикой сплошных сред, зависящих и от времени (
) и явлений, описываемых механикой сплошных сред, зависящих и от времени (![]() и т.д.)
и т.д.)
Локальные термодинамические характеристики вводятся как и для равновесных термодинамических систем, но они уже относятся к бесконечно малым (в физическом понимании) объемам системы и временем. При этом бесконечно малый размер локальной области ![]() и бесконечно малый промежуток времени
и бесконечно малый промежуток времени ![]() должны удовлетворять условиям:
должны удовлетворять условиям:
![]() ,
, ![]() (1.11)
(1.11)
Здесь ![]() - длина свободного пробега,
- длина свободного пробега, ![]() - время свободного пробега молекул.
- время свободного пробега молекул.
[1] Имеются попытки введения понятия информации и в другие разделы физики. См., в частности, Хазен А.М. Введение меры информации в аксиоматическую базу механики.
[2] Подробнее этот вопрос будет рассмотрен в теме № 2; также см. Бриллюэн Л. Наука и теория информации
Похожие работы
... возникновением, при некотором пороговом значении напряженности магнитного поля, вытянутых вдоль поля капельных структур авторами [63] связывается обнаруженный ими изгиб на кривой намагничивания магнитной жидкости на основе керосина с объемной концентрацией магнетита Q = 15%. Экспериментальному и теоретическому исследованию каплеподобных агрегатов посвящен ряд работ Бакри и др.[64,65]. В основном, ...
... объемы азота и водяного пара в продуктах сгорания ПГ. 1. ЦЕЛЬ РАБОТЫ 1.1 Ознакомиться с устройством котлов-утилизаторов 1.2 Получить практические навыки проведения термодинамического анализа эффективности агрегатов энерготехнологических систем и протекающих в них процессов. 2. СОДЕРЖАНИЕ РАБОТЫ 2.1 Проведение термодинамического анализа эффективности котла-утилизатора энергетическим и ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... и многое другое, без чего немыслима сама жизнь. Все человеческое тело – это мир частиц, находящихся в постоянном движении строго по определенным правилам, подчиняющимся физиологии человека. Коллоидные системы организмов обладают рядом биологических свойств, характеризующих то или иное коллоидное состояние: 2.2 Коллоидная система клеток. С точки зрения коллоидно-химической физиологии ...





0 комментариев