Навигация
Метод определения активности карбоксипептидазы Н
2.2.1. Метод определения активности карбоксипептидазы Н
Активность КП Н определяли флюорометрическим методом по Supattapone S., Fricker L.D., Snyder S.H. [262].
Для определения активности фермента смешивали 150 мкл (в случае контрольной пробы) или 140 мкл (в случае опытной пробы) вышеуказанного буфера с 50 мкл гомогената ткани. Опытные пробы содержали 1 мкМ ГЭМЯК. Пробы преинкубировались 8 мин при 37оС.
Реакцию начинали прибавлением 50 мкл 210 мкМ дансил-Phe-Ala-Arg на 50 мМ натрий-ацетатном буфере, pH 5,6 (конечная концентрация в реакционной смеси составляла 42 мкМ). Далее пробы инкубировали 60 мин при 37оС. Реакцию останавливали прибавлением 50 мкл 1М раствора соляной кислоты. Для экстракции продукта реакции – дансил-Phe-Ala – к пробам приливали 1,5 мл хлороформа и встряхивали в течение 60 сек. Для разделения фаз пробы центрифугировали 5 мин при 1000 g. Измерение флюоресценции хлороформной фазы проводили на флюориметре ФМЦ-2 в кювете толщиной 1 см при lex=360 нм и lem=530 нм. В качестве стандарта использовали 1 мкМ раствор дансил-Phe-Ala в хлороформе.
Активность КП Н определяли как разность в накоплении продукта реакции в пробах, несодержащих и содержащих ГЭМЯК, и выражали в нмоль дансил-Phe-Ala образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
2.2.2. Метод определения активности ФМСФ-ингибируемой карбоксипептидазы
Активность ФМСФ-ингибируемой карбоксипептидазы определяли флюориметрическим методом [7, 11]. К 150 мкл, в случае контрольной пробы, и к 140 мкл, в случае опытной пробы, вышеуказанного буфера прибавляли по 50 мкл гомогената.
В опытную пробу добавляли 10 мкл 25 мМ раствора ФМСФ, приготовленного на этиловом спирте (конечная концентрация ФМСФ в реакционной смеси составляла 1 мМ).
Дальнейшее определение активности ФМСФ-ингибируемой карбоксипептидазы проводилось так же, как и для КП Н, с той лишь разницей, что вместо дансил-Phe-Ala-Arg в качестве субстрата использовали 50 мкл 210 мкМ дансил-Phe-Leu-Arg на 50 мМ натрий-ацетатном буфере, pH 5,6.
Активность фермента определяли как разность в накоплении продукта дансил-Phe-Leu в пробах, несодержащих и содержащих ФМСФ. Активность выражали в нмоль дансил-Phe-Leu образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
2.2.3. Метод определения концентрации белка
Количество белка в пробах определяли по методу Lowry и соавт. [179].
2.2.4. Статистическая обработка результатов исследования
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента [31]. Корреляционный и дисперсионный анализы проводили с помощью программы Statgraphics (версия 3.0) (“STSC, Inc.” США) в режимах Simple Correlation, One-Way ANOVA и Multifactor ANOVA. Принадлежность подгрупп животных к разным гомогенным группам оценивали с помощью Multiple range analysis (Statgraphics (версия 3.0) (“STSC, Inc.” США)). Принадлежность экспериментальных (временных) подгрупп к разным гомогенным группам проводили только в случае достоверности критерия Фишера. При этом оценивали количество гомогенных групп, образуемых экспериментальными подгруппами, с уровнем достоверности р<0,05. Баллы подгруппам присваивали на основании их принадлежности к разным гомогенным группам по мере увеличения среднего. При этом минимальный балл получала временная подгруппа с минимальным средним, максимальный балл – временная подгруппа с максимальным средним, а дробный балл (1,5) получали подгруппы, входящие одновременно в две гомогенные группы. На основании присвоеных баллов судили о динамике изменения активности ферментов.
ГЛАВА 3. Результаты исследования
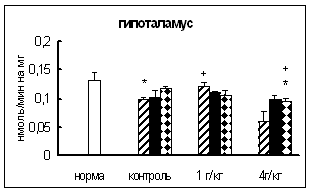
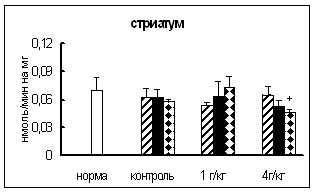
3.1. Тканевое распределение активности основных карбоксипептидаз у самцов и самок мышей
3.1.1. Распределение активности карбоксипептидазы Н в гипоталамо-гипофизарно-надпочечниково-гонадной системе самцов и самок мышей
Полученные данные о распределении активности КП Н в ГГНГС самцов и самок мышей представлены в таблице 3.1.1.
Таблица 3.1.1. Распределение активности (нмоль дансил-Phe-Ala в мин на мг белка) КП Н у самцов и самок мышей (n=5¸8).
| Пол животного | Отдел ГГНГС, M±m | |||
| Гипофиз | Гипоталамус | Надпочечники | Половые железы | |
| Самцы | 1,41±0,10 | 0,78±0,02 | 0,16±0,04 | 0,10±0,02 |
| Самки | 4,63±0,63 | 1,88±0,29 | 0,54±0,08 | 0,40±0,08 |
Максимальная активность фермента у самцов обнаружена в гипофизе. В гипоталамусе активность была примерно в 2 раза ниже, а в надпочечниках и семенниках – в 9-15 раз ниже, чем в гипофизе.
У самок в порядке снижения активности КП Н ткани можно расположить следующим образом: гипофиз (максимальная активность), гипоталамус (активность, примерно, в 2,5 раза ниже), надпочечники, яичники (минимальная активность). Таким образом, распределение активности КП Н в ГГНГС мышей сходно с таковым у других видов животных [12, 44, 117, 122, 165, 182, 256, 262]. Однако обнаружены некоторые отличия между распределением активности КП Н у мышей разного пола. У самцов разница между активностью этого фермента в надпочечниках и таковой в гонадах составляет, примерно, 67%, а у самок – только 35%. У самок активность КП Н, в целом, примерно в 3,3 раза выше, чем у самцов.
Похожие работы
... нервной и эндокринной регуляции в организме // Усп. совр. биол. – 1981. – 19, № 3. – С. 380-382. 23. Вернигора А.Н., Бардинова Ж.С., Сметанин В.А., Генгин М.Т. Активность основных карбоксипептидаз в тканях самок крыс на разных стадиях эстрального цикла // Укр. биохим. журн. – 2003. – 75, № 5. – С. 99-102 24. Вернигора А.Н. Карбоксипептидаза Н мозга животных в норме и при действии стресс- ...
... о динамике изменения активности ферментов. ГЛАВА 3. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ 3.1. Исследование активности основных карбоксипептидаз в тканях крыс разного возраста, испытавших пренатальное воздействие этанола 3.1.1. Исследование активности карбоксипептидазы Н в тканях пренатально алкоголизированных крыс разного возраста Согласно данным дисперсионного анализа пренатальное воздействие ...

0 комментариев