Навигация
Биотехнология глутамата натрия
Содержание
Применение продукта
Характеристика продукта
Характеристика продуцента
Состав питательной среды
Механизм биосинтеза
Условия биосинтеза
Описание процесса биосинтеза
Выделение продукта
Активаторы и ингибиторы процесса
Возможности генной инженерии
Выход продукта
Определение стехиометрических коэффициентов и теплового эффекта реакции
Список используемой литературы
Применение продукта
Глутамат натрия применяют для усиления природных вкусовых свойств пищевых продуктов, сохранения вкусовых качеств пищевых продуктов при длительном хранении, восстановления первоначального вкуса в продуктах, которые подвергаются термической обработке.
Она применяется при изготовлении блюд из мяса, рыбы, птицы, овощей, бобовых, усиливая их природные вкусовые особенности. Специфический "мясной" вкус глутамата натрия ощущается при концентрации от 0,03% и более. Его используют при приготовлении изделий из низкосортного и мороженого мяса, которое при хранении частично утратило свои первоначальные свойства, а также при применении соевых белков и других заменителей мяса.
Количество глутамата натрия при производстве колбасных изделий, продуктов из свинины, говядины, баранины, конины, полуфабрикатов и др. составляет 0,05-0,15% к массе сырья. Для консервированных море- и рыбопродуктов его расходуется больше - от 0,1 до 0, 5%. Глутамат натрия может добавляться в продукт вместе с солью. При этом дозировку соли уменьшают на 10%.
"Глутаминовый эффект" лучше всего проявляется в слабокислой среде - при рН 5 - 6, 5. В более кислой среде эффект усиления вкуса снижается, а при рН 4 теряется вовсе.
Глутамат натрия изобретен давно. В начале XX века японский ученый Кикунае Икеда, занимаясь изучением соевого соуса и других продуктов, характерных для Юго-Восточной Азии, пытался ответить на вопрос, почему пища, сдобренная некоторыми сушеными водорослями, становится более вкусной и аппетитной. Оказалось, такой эффект дает содержащаяся в них глутаминовая кислота. В 1909 году ученому был выдан патент на способ производства пищевых препаратов. По этому способу была получена соль глутаминовой кислоты - глутамат натрия. А в 50-х годах прошлого века выяснили, что глутамат мононатрия (на иностранных продуктах пишут - MSG) удивительным образом помогает производить запахи и вкусы, подобные мясу.
С тех пор усилитель вкуса - глутамат натрия - стал широко применяться и завоевал популярность во всем мире. Его ежегодное потребление на планете достигло 200 тысяч тонн.
Характеристика продукта
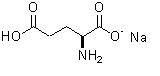
Глутамат натрия (monosodium glutamate - лат., сокращенное наименование - MSG) - мононатриевая соль глутаминовой кислоты. Широко используется в качестве дешевой пищевой добавки для усиления вкусовых ощущений. В наибольшей степени глутамат усиливает горький и соленый вкус, в то время как сладкий вкус усиливается в наименьшей степени. Усиление вкуса других продуктов происходит за счет воздействия на глутаматные рецепторы языка. Регистрационный номер - E621. Представляет собой хорошо растворимый в воде белый кристаллический порошок, по форме и вкусу напоминающий поваренную соль. Вкус глутамата называется "umami" ("умами", так называемый "пятый вкус" - вкус белковой пищи). Глутамат натрия получают как из натуральных ресурсов, так и посредством химических реакций.
Характеристики и свойства, которыми обладает глутамат натрия:
высокая растворимость в воде;
низкая гигроскопичность;
отличная стабильность при высоких температурах и свете;
не влияет на цвет и на структуру пищевых продуктов;
внешний вид: мелкие кристаллы;
вкус: слегка соленый;
цвет: белый;
содержание: мин. 94%;
pH: 6,7-7,2;
соль: максимум 0,4%;
содержание натрия: макс. 12,3%;
срок хранения: 5 лет;
упаковка: мешки по 25кг.
Глутамат натрия всасывается и метаболизируется как обычная аминокислота. Поэтому качественный глутамат натрия, используемый в регламентированных дозах, не может вызывать никаких болезненных симптомов. Употребление технического, недостаточно очищенного глутамата натрия, вызывает мигрени, тошноту, сонливость, нарушение пищеварения, ускоренное сердцебиения, астму, и даже — анафилактический шок. Отдельные исследователи убеждены, что патогенные примеси недоочищенного синтетического глутамата действуют непосредственно на кору головного мозга. Отсюда – ухудшение состояния больных бронхиальной астмой, заострение глаукомы и разрушение сетчатки глаз.
В сочетании с витамином Е глутамат натрия вызывает оксидативное повреждение клеток организма, при этом повреждая ДНК. При частом употреблении возможна постепенная утрата вкусовых ощущений из-за постепенного атрофирования вкусовых рецепторов.
Характеристика продуцента
В производстве соли монозамещенной глутаминовой кислоты используются штаммы бактерий, относящиеся к роду Coryn. Glutamicum. Принадлежит к группе аэробных бактерий с высоким содержанием гуанина и цитозина. Форма может быть разнообразной, но чаще встречаются вытянутые стержни с булавовидными концами. Быстрорастущая бактерия, не патогенная и не образует спор.
Царство: Bacteria
Тип:Actimobacteria
Класс:Actimobacteria
Семейство:Corynebacteriaceae
Род:Corynebacterium
Вид:C. glutamicum
Рис. 1: C. glutamicum под микроскопом
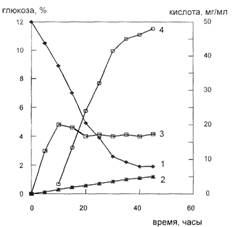
Рис. 2: Основные показатели культуры Corynebacterim glutamaticum при синтезе глутаминовой кислоты. 1-глюкоза, 2-кетоглутаровая кислота, 3-биомасса, 4-глутаминовая кислота.
Состав питательной среды
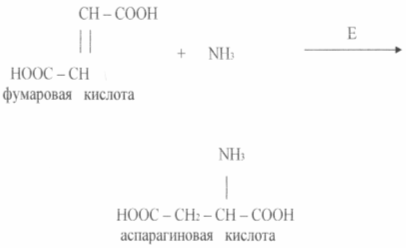
В качестве углеродного питания используют глюкозу, сахарозу, гидролизаты крахмала, мелассу, гирол. Кроме углеводов в качестве сырья могут быть использованы углеводороды (метан, этан, н-парафины нефти), а также уксусная, фумаровая кислоты и др.
В качестве источника азота используют мочевину в количестве 1,5 – 2,0%. Реже применяют как дополнительный к мочевине источник азота сульфат аммония (NH4)2SO4, хлорид аммония NH4Cl в количестве до 0,5% или водный раствор аммиака.
Для нормального роста культуры в среду необходимо вводить в десятых и сотых долях процента калий (в виде KH2PO4), магний (MgSO4*7Н2О), марганец (MnSO4*4H2O), а также мел.
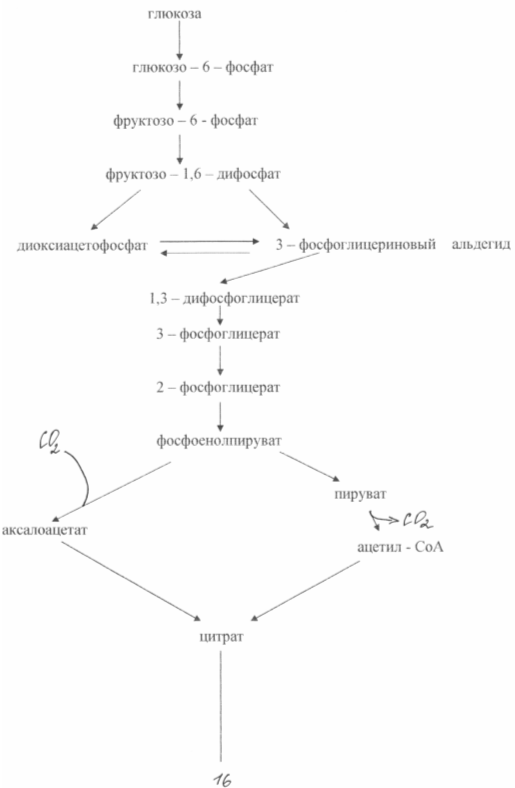
Механизм биосинтеза
Процесс начинается с гидролиза сахарозы:
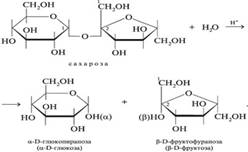
Фруктоза
Первой ферментативной реакцией гликолиза является фосфорилирование, т.е. перенос остатка ортофостфата на глюкозу за счет АТФ. Образование глюкозо-6-фосфата в гексокиназной реакции сопровождается освобождением значительного количества свободной энергии системы. Каталитическая активность фермента, гексокиназы, повышается в присутствии Mg2+. Переносчиком группы РО3Н2 является аденозинтрифосфат, который превращается в АДФ.
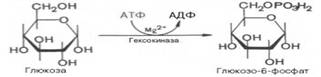
Второй рекцией является превращение глюкозо-6-фосфата под действием изомеразы во фруктозо-6-фосфат. Равновесная система состоит на 70-75% из фосфата глюкозы и на 30-25% из фосфата фруктозы.

Третья реакция катализируется ферментом фосфофруктокиназой; образовавшийся фруктозо-6-фосфат вновь фосфорилируется за счет второй молекулы АТФ:
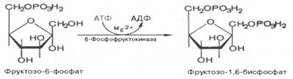
Четвертую реакцию гликолиза катализирует фермент альдолаза. Под влиянием этого фермента происходит расщепление на две фосфотриозы:
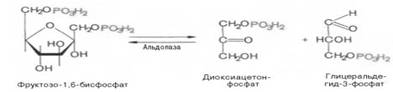
Эта реакция обратима. В зависимости от температуры равновесие устанавливается на различном уровне. При повышении температуры реакция сдвигается в сторону большего образования триозофосфатов.
Пятая реакция – это реакция изомеризации триозофосфатов. Катализируется ферментом триозофосфатизомеразой:
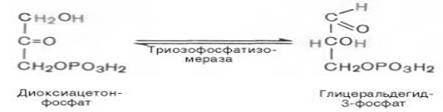
В результате шестой реакции глицеральдегид-3-фофат в присутствии фермента дегидрогеназы, кофермента НАД и неорганического фосфата подвергается своеобразному окислению с образованием 1,3-биофосфоглицериновой кислоты и восстановленной формы НАД (НАДН):
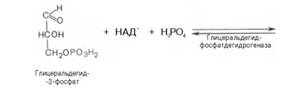
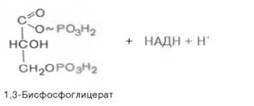
1,3-Биофосфоглицерат представляет собой высокоэнергетическое соединение. Механизм действия дегидрогеназы сводится к следующему: в присутствии неорганического фосфата НАД+ выступает как акцептор водорода, отщепляющегося от глицеральдегид-3-фосфата. В процессе образования НАДН глицеральдегид-3-фосфат связывается с молекулой фермента за счет SН-групп последнего. Образовавшаяся связь богата энергией, но она непрочная и расщепляется под влиянием неорганического фосфата, при этом образуется 1,3-биофосфоглицериновая кислота.
Седьмая реакция катализируется фосфоглицераткиназой, при этом происходит передача богатого энергией фосфатного остатка на АДФ с образованием АТФ и 3-фосфоглицериновой кислоты:

Т.о., благодяря действию двух ферментов (глицеральдегидфосфатдегидрогеназы и фосфоглицераткиназы) энергия, высвобождающаяся при окислении альдегидной группы глицеральдегид-3-фосфата до карбоксильной группы, запасается в форме энергии АТФ. В отличие от окислительного фосфорилирования образование АТФ из высокоэнергетических соединений называется субстратным фосфорилированием.
Восьмая реакция сопровождается внутримолекулярным переносом оставшейся фосфатной группы, и 3-фосфоглицериновая кислота превращается в 2-фосфоглицериновую кислоту. Реакция легкообратима, протекает в присутствии ионов магния:

Девятая реакция катализируется ферментом енолазой, при этом 2-фосфоглицериновая кислота в результате отщепления молекулы воды переходит в фосфоенолпировиноградную кислоту, а фосфатная связь в положении 2 становится высокоэргической. Енолаза активируется катионами Mg2+ и Mn2+ и ингибируется фторидом.

Десятая реакция характеризуется разрывом выскоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ. Катализируется ферментом пируваткиназой:

Для дествия пируваткиназы необходимы Mg2+ , а также одновалентные катионы щелочных металлов.
В результате одиннадцатой реакции пируват под влиянием пируваткарбоксилазы и при участии СО2 и АТФ карбоксилируется с образованием оксалоацетата:

Двенадцатая реакция катализируется ферментом цитрат-синтетазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:

Ацетил-КоА Оксалоацетат Цитрат
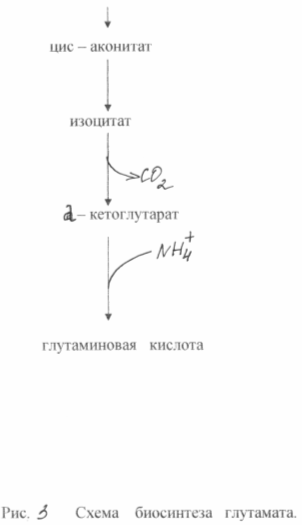
Тринадцатая реакция – дегидратация лимонной кислоты с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту. Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитатгидратаза. В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:
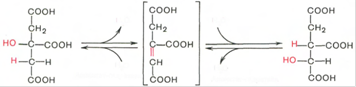
В результате четырнадцатой реакции происходит образование α-кетоглутарата. Изоцитрат дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы. В ходе реакции изоцитрат одновременно декарбоксилируется. НАД-зависимый фермент является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ и Mn2+. Происходит выделение CO2.

В ходе пятнадцатой реакции – ферментативного восстановительного аминирования α-кетоглутаровой кислоты НАДФ-зависимой глутаматдегидрогеназой – образуется глутаминовая кислота:
НООС – СН2 – СН2 – СО – СООН + НАД(Ф)Н2 + NН3 →
НООС – СН2 – СН2 – NН2СН – СООН + НАД(Ф).
В ходе рассмотренных реакций видно, что для нормального протекания синтеза глутамата необходимо наличие в субстрате неорганического фосфорного питания, а также макро- и микроэлементов К, Mg, Mn, активирующих ферменты.
Сверхсинтез кислоты у дикого штамма возможен в специальных физиологических условиях при торможении скорости роста и увеличении проницаемости клеточной мембраны для глутаминовой кислоты. Такие условия обеспечивает определенная концентрация биотина в среде (1 – 5 мкг/л), а также присутствие некоторых антибиотиков. Внутриклеточная концентрация глутамата снижается в результате экскреции продукта в околоклеточную среду, поэтому регуляция синтеза конечным продуктом ослабевает.
Также для осуществления процесса биосинтеза глутаминовой кислоты с высоким выходом используют мутанты с нарушенной ферментативной системой превращения кетоглутаровой кислоты в янтарную (отсутствие или дефект кетоглутаратдегидрогеназы).
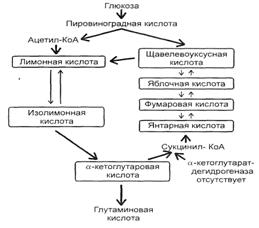
Рис. 3: Схема синтеза глутаминовой кислоты C. Glutamaticum.
Шестнадцатая реакция – образование глутамата натрия. Для этого раствор глутаминовой кислоты нейтрализуют 45-50% раствором едкого натра.
Условия биосинтеза
На биосинтез глутамата оказывают стимулирующее влияние биотин, тиамин и некоторые антибиотики (пенициллин, тетрациклин), спирты и ПАВ. Однако концентрацию биостимуляторов следует строго контролировать, так как при высокой концентрации, например, биотина, усиливается рост биомассы, но снижается выход глутаминовой кислоты (рис. 4). Также при избытке биотина и недостаточной аэрации образуются аланин и молочная кислота, что связано с потерями углеводов.
Процесс биосинтеза осуществляют в строго асептических усло-виях в ферментаторах объемом 50 м3 с коэффициентом заполнения аппарата 0,7 в течение 48-52ч интенсивной аэрации. Температуру культивирования на всех стадиях поддерживают постоянной на уровне 28-30оС. В течение всего процесса рН среды поддерживается на уровне 7,0-7,2.
Описание процесса биосинтеза
Синтез глутамата натрия осуществляется из глутаминовой кислоты, произведенной бактериями Coryn. Glutamicum.
Поскольку биосинтез глутаминовой кислоты предполагает высокую активность дегидрогеназ цикла трикарбоновых кислот, производственное культивирование должно проводится при интенсивной аэрации.
Воздух, подаваемый в ферментатор, выполняет несколько функций:
1) снабжает микроорганизмы кислородом
2) отводит газообразные продукты обмена
3) отводит теплоту, выделяемую микроорганизмами
4) создает однородность суспензии массы микроорганизмов
5) увеличивает скорость массопередачи и перемешивания жидкой среды.
На первом этапе происходит очистка атмосферного воздуха от пыли и его сжатие.
Атмосферный воздух поступает через фильтр предварительной очистки 1 в компрессор 2, где сжимается до необходимого давления (350-500кПа).
На втором этапе сжатый воздух необходимо поддерживать в оптимальном термодинамическом состоянии. При сжатии воздух нагревается до 100-200 градусов, поэтому его охлаждают в теплообменнике 3 до 25-30 градусов. При охлаждении сжатого воздуха конденсируется имеющаяся в атмосферном воздухе влага, которую отделяют во влагоотделителе 4. После отделения воды воздух нагревают до температуры культивирования микроорганизмов в теплообменнике-нагревателе 5. Далее воздух поступает в головной фильтр 6, где поддерживается его оптимальная температура и влажность. В этом фильтре происходит также и холодная стерилизация воздуха, так как вместе с частицами пыли отделяются и клетки микроорганизмов.
На третьем этапе осуществляется окончательная стерилизация воздуха в индивидуальном фильтре тонкой очистки.
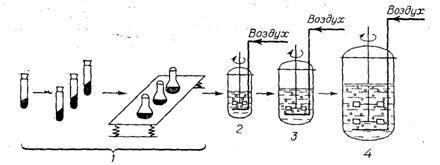
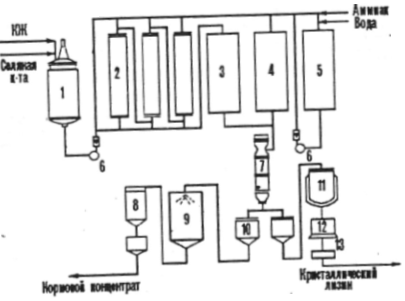
Рис. 6: Технологическая схема приготовления посевного материала: 1-выращивания посевного материала в заводской лаборатории; 2-выращивание в инокуляторах объемом 2м3; 3- выращивание в инокуляторах объемом 5м3; 4- выращивание в биореакторах объемом 50м3.
Первая стадия (рис.6) выращивания посевного материала осуществляется в заводской лаборатории. Исходную культуру размножают на скошенной агаризованной среде в пробирке в стерильных условиях при оптимальных составе питательной среды и режиме выращивания (рН, температура, длительность).
Выращенную культуру стерильно смывают водой с поверхности агаризованной среды в колбы Эрленмейера вместимостью 750 мл, содержащие 50-100 мл жидкой питательной среды. Для промышленных штаммов С. glutamicum питательные среды содержат следующие компоненты (в %):
Меласса 8
Кукурузный экстракт 0,3
Хлорид аммония 0,5
Калия фосфат двухзамещенный 0,05
Сульфат магния 0,03
Вода остальное
рН среды 7,0-7,2
Колбы с культурой помещают на качалку, которая находится в термостатируемом помещении. Продолжительность выращивания культуры в колбах на качалке составляет 24 ч. Эта стадия выращивания контролируется по морфологическим показателям микроорганизма. Наилучшие показатели дает культура, которая находится в стадии физиологической зрелости в конце логарифмической фазы роста.
На второй стадии выращивания посевного материала (рис.6) готовую культуру из колб стерильно переносят в посевной аппарат (инокулятор) объемом 2м3. Происходит накопление биомассы до 6-8 г АСВ на 1 л среды в аэробных условиях. Состав питательной среды такой же как и при выращивании в колбах Эрленмейера, но с добавление 0,1% стерильного синтетического пеногасителя. Посевную культуру выращивают при температуре 28-32С в течение 18-24 ч и расходе воздуха 1 объем на 1 объем жидкости в 1 мин. В течение всего процесса рН среды поддерживается на уровне 7,0-7,2.
Третья стадия (рис.6) культивирования посевного материала повторяет вторую стадию, но процесс уже осуществляется в инокуляторах объемом 5м3. Для этого все содержимое малого инокулятора перекачивается в аппарат большего объема, в котором находится пострерилизованная питательная среда того же состава, что и использовалась на предыдущей стадии. Посевную культуру выращивают при температуре 28-32С в течение 18-24 ч и расходе воздуха 1 объем на 1 объем жидкости в 1 мин. В течение всего процесса рН среды поддерживается на уровне 7,0-7,2. По завершении процесса ферментации в посевных аппаратах культура не должна содержать фагов, посторонней микрофлоры и иметь титр около 109 клеток на 1 мл. Полученный посевной материал в количестве 5-6% (от объема среды производственных аппаратов) стерильно передают в основные ферментаторы.
Посевные аппараты на второй и третьей стадии оснащены мешалкой, аэрирующим устройством, а также контрольно-измерительной аппаратурой для регулирования температуры, рН, уровня пены и т.д. Количество посевного материала, передаваемое в инокуляты, может варьировать в широких пределах от 1 до 20% по объему. Коэффициент заполнения посевного аппарата в зависимости от конструкции его отдельных узлов составляет 0,5-0,7. Перемешивание среды достигается либо в результате барботажа стерильного воздуха либо турбинной мешалкой со скоростью вращения 300об/мин.
Четвертая стадия (рис.6) процесса осуществляется в основных биореакторах (рис.7) объемом 50м3 в течение 48-52 ч и интенсивной аэрации (80-85 мг О2/(л*мин)). Температуру культивирования на всех стадиях поддерживают постоянной на уровне 28-30С. Такие аппараты должны обеспечить нормальный рост и развитие промышленного продуцента в асептических условиях; они снабжены необходимыми коммуникациями, теплообменниками, перемешивающими устройствами, штуцерами для подачи питательной среды и соответствующим оборудованием для ввода в нее стерильного воздуха, дополнительных питательных ингредиентов, растворов кислот и щелочей для поддержания рН среды на необходимом уровне, системами ввода стерильного пеногасителя и передачи культуральной жидкости на дальнейшую переработку. Перед началом культивирования ферментеры промывают и стерилизуют паром в течение 1 ч при 0,1 МПа.
Стерильная питательная среда (рис.8) в момент введения в биореактор имеет температуру, близкую к среде выращивания продуцента (28-30С), или около 80С. В последнем случае для достижения температуры проведения процесса культивирования жидкую фазу охлаждают подачей холодной воды в рубашку аппарата или в теплообменники, расположенные внутри самого ферментера.
Для промышленных штаммов С. glutamicum питательные среды на стадии биосинтеза содержат следующие компоненты (в %):
Меласса 20
Мочевина 2
Калия фосфат двухзамещенный 0,05
Сульфат магния 0,03
Вода остальное
рН 7,0-7,2
Дополнительно в питательную среду вводят мел до 1% и 0,1% синтетического пеногасителя. Мочевину вводят дробно, по мере потребления, чтобы содержание мочевины в среде не превышало 0,8%.
Посевной материал в количестве 5-10% от объема питательной среды поступает в ферментер. Коэффициент заполнения последнего составляет 0,7. Процесс ферментации продолжается при повышенном давлении 0,02-0,03 МПа, постоянной температуре 28-30С и контролируемом значении рН; периодически производится подача стерильного пеногасителя.
В первые сутки культивирования продуценты ассимилируют 25% углеводов и общего азота среды, в том числе почти все аминокислоты, в этот период образуется практически вся биомасса. Вторая стадия роста культуры сопровождается резким снижением скорости накопления биомассы и самыми высокими скоростями биосинтеза глутаминовой кислоты – 0,8-1,0 г/л*ч. Питательная среда сильно истощается, возможно значительное изменение рН раствора. На данном этапе осуществляют подтитровывание среды 25%-ным раствором аммиака. Последняя стадия культивирования может сопровождаться некоторой убылью биомассы за счет небольшого автолиза клеток и резким снижением скорости образования глутамата.
Контроль за ходом процесса биосинтеза осуществляют на разных этапах его проведения по оптической плотности раствора культуральной жидкости (по содержанию клеток продуцента), по содержанию субстрата в смеси или по сигналам датчиков рН и растворенного кислорода в ферментационной среде. К концу процесса биосинтеза готовая культуральная жидкость содержит до 50 г/л глутаминовой кислоты, концентрация оставшегося субстрата не более 0,5-1,0%. Выход глутаминовой кислоты по отношению к потребленным сахарам составляет 45-50%.
Количество накапливаемого глутамата удается повысить, если по мере исчерпания источников углерода и азота в среду по ходу процесса дополнительно вводить небольшие количества этих питательных веществ. Организация дробной «подпитки», общий объем которой не превышает 10% объема исходной жидкой фазы, приводит к активизации биосинтетической деятельности микроорганизмов. На мелассной среде осуществление дробной «подпитки» позволяет увеличить концентрацию образующегося в культуральной жидкости глутамата до 60/л.

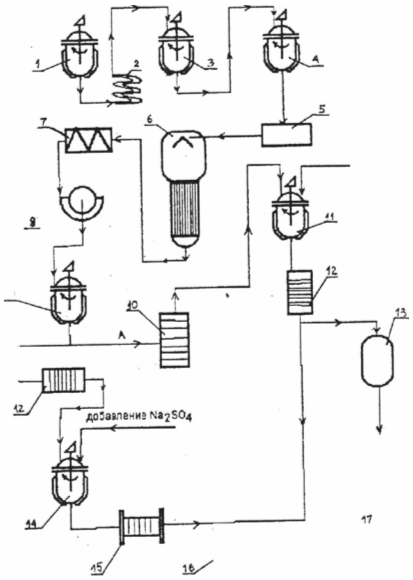
Рис. 7: Схема ферментатора со вспомогательными устройствами: 1 – корпус ферментатора, 2 – вал смесителя с турбинами, 3 – электродвигатель с коробкой передач, 4 – сальник вала смесителя, 5 – спираль теплообменника, 6 – перфорированный барботер, 7 – устройство для определения расходов воздуха, 8 – фильтр для стерилизации воздуха, 9 – воздушный клапан с регулировочным вентилем, 10 – уловитель, наполненный фенолом, 11 и 12 – резервуары для стерилизации пеногасителя и дополнительной подачи питательной среды во время ферментации, 13 – трубопровод для питательной среды, 14 – выводной вентиль, 15 – вентиль для отбора проб.
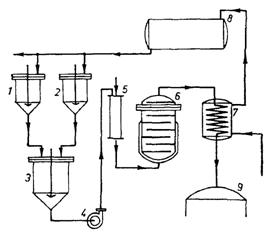
Рис. 8: Схема непрерывного приготовления питательной среды: 1 и 2 – резервуары для растворения исходных веществ, 3 – резервуар для смешивания растворов, 4 – насос для передачи среды, 5 – колонна или инжектор для нагрева среды паром, 6 – закрытый сосуд для стерилизации, 7 – охладитель, 8 – резервуар для спуска нагретой воды, 9 – ферментатор
Пятая стадия включает в себя предварительную обработку культуральной жидкости. Осуществляется в результате добавление к ней определенного количества негашеной извести с последующим осаждением избытка ионов кальция фосфорной кислотой. Образующийся при этом осадок способствует лучшему отделению клеток продуцента и других балластных примесей.
Шестая стадия – отделение осадка. Проводят центрифугированием или фильтрованием под давлением (рис.9). Осадок и отработанную биомассу – в отходы.
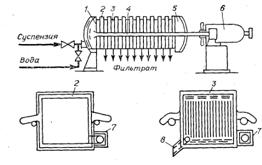
Рис. 9: Рамный фильтр-пресс: 1 – лобовина, 2 – рама, 3 – плита, 4 – брус, 5 – подвижная лобовина, 6 – гидравлическое устройство, 7 – прилив, 8 – кран.
Седьмая стадия – осветление фильтрата. Состоит в очистке его от пигментных примесей, окрашивающих нативный раствор в темный цвет. Для этого обрабатывают фильтрат активированным углем.
Восьмая стадия заключается в концентрировании осветленного раствора глутаминовой кислоты. Проводят путем его вакуум-выпаривания (рис.10) при температуре 40-60С, при этом из исходного раствора глутамата отгоняют от 50 до 80% воды.
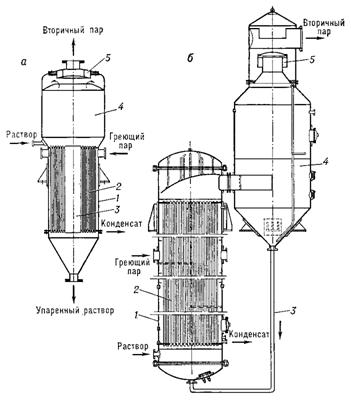
Рис. 10: Выпарные аппараты: а – с центральной циркуляционной трубой, б – с выносной нагревательной камерой, 1 – корпус, 2 – нагревательные трубки, 3 – циркуляционная труба, 4 – сепаратор, 5 – отбойник.
Девятая стадия – кристаллизация. Осаждение кристаллов глутаминовой кислоты происходит в изоэлектрической точке. Эта стадия осуществляется путем подкисления полученного на предыдущем этапе концентрата соляной кислотой до рН 3,2 и охлаждения раствора до 4С. После кристаллизации содержание глутамата в продукте составляет 99,6%.
Десятая стадия – получение глутамата натрия. Кристаллы глутаминовой кислоты растворяют в воде, обрабатывают водный раствор активированным углем до полного обесцвечивания при температуре 60-70С. Затем раствор глутаминовой кислоты нейтрализуют 45-50%-ным раствором NaOH до рН 6,8, после чего фильтруют. Фильтрат упаривают на вакуум-выпарной установке при 40-50С, а затем охлаждают. Кристаллизация проводится в течение 3 суток, при плавном снижении температуры. Кристаллы глутамата натрия отделяют от маточного раствора на центрифуге и высушивают нагретым воздухом. Содержание основного вещества в готовом продукте составляет 98%.
Выделение продукта
Упаренный фильтрат нейтрализованной глутаминовой кислоты постепенно охлаждают в течение 3 суток. Вследствие этого образуются кристаллы глутамата натрия. Их отделяют от маточного раствора на центрифуге и высушивают нагретым воздухом. Содержание основного вещества в готовом продукте составляет 98%.
Центрифуга периодического действия (рис. 11), в которых неоднородная смесь (например, суспензия) вводится в центральную часть полого ротора во время его вращения; твёрдые частицы оседают на внутренней поверхности ротора, а осветлённая жидкость (фугат) отводится из верхней его части. Образовавшийся осадок выгружается из ротора после его остановки (в некоторых случаях на ходу) через специальные сопла или через периодически открывающиеся щели (отверстия).
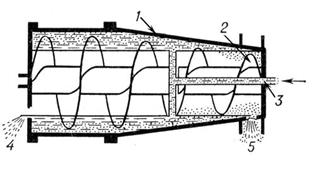
Рис. 11: Центрифуга: 1 – ротор, 2 – выгружающий шнек, 3 – подвод суспензии, 4 – отвод фугата, 5 – выгрузка осадка.
Основной частью сушилок являются медленно вращающиеся (2—10 об/мин) вальцы, в которые через полую цапфу поступает греющий пар и от них отводится конденсат. Высушиваемый материал поступает на вальцы, налипает на их поверхности тонким слоем, высушивается и срезается ножом.
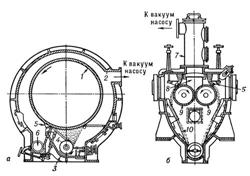
Рис. 12: Вакуум-сушилки: а – одновальцовая, б – двухвальцовая. 1 – полый барабан (валец), 2 – корпус, 3 – корыто, 4 – распределительный валик, 5 – нож, 6 – шнек, 7 – приемный колпак, 8 – сборник, 9 – вальцы, 10 – наклонные стенки.
Активаторы и ингибиторы процесса
Для получения глутаминовой кислоты и для интенсивного ее накопления необходим кислород, т.е. необходима аэрация питательной среды. В условиях недостаточной аэрации активируется аланиндегидрогеназа, катализирующая образование аланина из пировиноградной кислоты, и лактатдегидрогеназа, превращающая пируват в молочную кислоту. Аланин и лактат приводят к снижению выхода глутамата. Слишком интенсивная аэрация способствует усиленному росту биомассы, выход глутамата при этом также снижается. Поэтому количество растворенного в жидкой фазе кислорода необходимо поддерживать на оптимальном уровне.
Важным фактором является соблюдение температурного режима и режима рН среды для того, чтобы поддерживать оптимальные условия для всего процесса бисинтеза, а также для избавления от посторонней микрофлоры.
Большую роль играют витамины, они являются коферментами многих ферментов. Все продуценты глутаминовой кислоты биотинзависимые, однако содержание биотина регламентировано и не должно превышать 2-5 мкг на 1 л среды. Более высокая концентрация этого витамина излишне стимулирует рост клеток продуцента, способствует повышенному образованию аланина, молочной, янтарной, аспарагиновой кислот, а выход глутамата при этом значительно снижается.
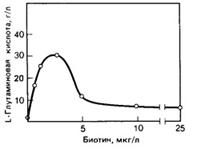
Рис.4: Зависимость между образование глутамата у C. Glutamicum и содержанием биотина в среде.
Ингибирующее влияние биотина удается снизить при включении в состав питательных сред различных добавок в виде некоторых спиртов, ПАВ, антибиотиков (пенициллинов, тетрациклинов). Добавки в среду ПАВ в количестве 0,01-0,2% или калиевой соли бензилпенициллина (4-6 тыс. ед. на 1 л среды) повышают биосинтетическую способность продуцента на 15-45%. Действие антибиотиков связано с ингибированием синтеза липогликопротеинового комплекса клеточной оболочки продуцента, что приводит к увеличению проницаемости клеточных мембран для глутаминовой кислоты.
Возможности генной инженерии
В последние годы для получения новых эффективных штаммов- продуцентов аминокислот стали применять новейшие методы биотехнологии. Методы генетической инженерии позволяют повышать количество генов биосинтеза путем их клонирования на плазмидах. Это приводит к увеличению количества ферментов, ответственных за синтез аминокислот, следовательно, повышает выход целевого продукта. Клонирование генов системы синтеза аминокислот в клетки микроорганизмов с иным, по сравнению с донорским организмом, типом питания позволяет расширять сырьевую базу и заменять дорогостоящие сахаросодержащие субстраты более дешевыми.
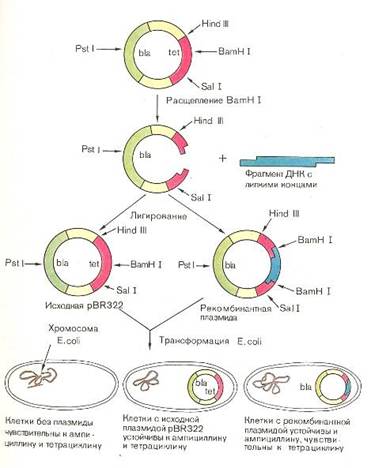
Технология рекомбинантных ДНК представляет собой изменение с помощью биохимических и генетических методик хромосомного материала - основного наследственного вещества клеток. Хромосомный материал состоит из дезоксирибонуклеиновой кислоты (ДНК). Биологи изолируют те или иные участки ДНК, соединяют их в новых комбинациях и переносят из одной клетки в другую. В результате удается осуществить такие изменения генома, которые естественным путем вряд ли могли бы возникнуть.
Эта технология основана на следующем принципе: помимо своей собственной кольцевой хромосомы, бактерии часто содержат дополнительные маленькие кольцевидные молекулы двух цепочной ДНК, называемые плазмидами.
Плазмиды реплицируются автономо и сами могут содержать гены, определяющие устойчивость бактерий к антибиотикам или контролирующие синтез веществ.
Плазмидную ДНК можно выделить и ращепить подходящей рестриктазой только в одном сайте, превратив кольцевую молекулу в линейную с липкими концами.
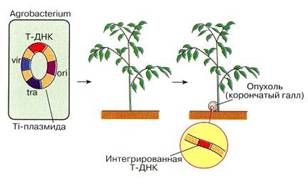
Фрагменты любой чужеродной ДНК с такими же липкими концами (полученными после разрезания аналогичной рестриктазой) можно сшить с плазмидой ДНК с помощью лигазы. Рекомбинантную конструкцию вводят затем в бактерию, где она реплицируется (рис. 5).
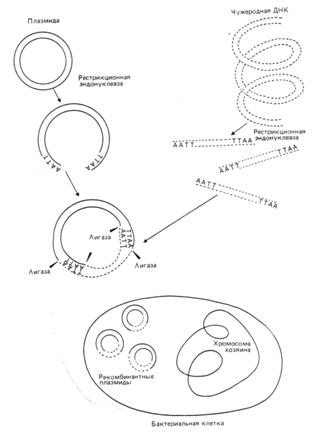
Рис. 5: Принцип введения чужеродной ДНК в бактериальную плазмиду с использованием эндонуклеазы.
Штаммы – суперпродуценты, используемые в производстве, как правило, получены с использованием методов селекции и генетики. Получены микробы – суперпродуценты из родов Brevibacterium, Corynebacterium, Microccocus и другие,с помощью которых освоено крупнотоннажное производство глутамата и других аминокислот.
Известны продуценты L-глютаминовой кислоты Corynebacterium glutamicum с высокой супероксидисмутазной активностью (патент Японии 5-29436 C 12 P 13/14), продуцирующие до 100 г/л глютаминовой кислоты, получен мутант Corynebacterium glutamicum, содержащий рекомбинантную ДНК с фрагментом, несущим ген, кодирующий фосфоенолпируваткарбоксилазу из Escherichia coli (патент Японии 4-17639 C 12 P 13/14). Основным недостатком всех вышеперечисленных штаммов и мутантов является непродуктивный расход углеродсодержащих субстратов на биосинтез молочной кислоты, при этом при культивировании всех приведенных штаммов выход глютаминовой кислоты от субстратов составлял не более 56%.
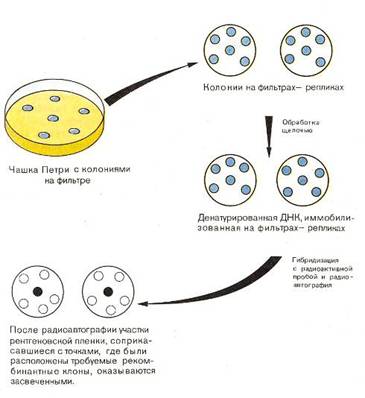
Новый штамм бактерий Corynebacterium glutamicum был получен мутацией штамма АТСС 4128. Клетки исходного штамма подвергали УФ-мутагенному воздействию. Отбор проводили с помощью биоавтографического метода. Бактериальные клетки, выросшие на чашках, убивали УФ-облучением, после этого чашки заливали агаризованной средой, содержащей суспензию клеток штамма, нуждающегося в L-глутаминовой кислоте. Рост такой индикаторной бактерии подтверждал выделение исследуемым штаммом L-глютаминовой кислоты. Прямой отбор среди 100 вариантов, полученных после обработки клеток исходного штамма АТСС 4128, позволил выявить 8 штаммов, обладающих способностью к синтезу L-глютаминовой кислоты, далее мутанты отбирались по двум признакам: резистентности к Na-триевой соли ампициллина и выходу от поданного углеродсодержащего субстрата более 60%. При выращивании на жидкой синтетической питательной среде с добавлением источников N, P, K, Na, Mg, биотина, тиамина, содержащей сахарозу в количестве 40 г/л, был отобран штамм ВСБ-206л, способный к сверхсинтезу L-глютаминовой кислоты с выходом от потребленной сахарозы 63%. Штамм Corynebacterium glutamicum (ВСБ-206л) депонирован во Всероссийской коллекции промышленных микроорганизмов Государственного научно-исследовательского института генетики под номером B-7198. Физиолого-биохимические признаки: ассимилирует глюкозу, сахарозу, ацетат, этиловый спирт. Нуждается в добавках биотина, тиамина, способны к сверхсинтезу L-глютаминовой кислоты, обладает пониженной активностью лактатдегидрогеназы, что снижает затраты углерода субстрата на жизнедеятельность бактерий, уменьшает непродуктивный расход углерода на биосинтез молочной кислоты.
Технологические усовершенствования
К эффективным методам улучшения процесса относится метод подпитки. К периодической культуре добавляются компоненты питания - обычно соединения углерода, по мере его исчерпывания. Культура не страдает от избытка углерода в начале роста, что неизбежно в периодической культуре. Поэтому после подпитки сразу начинается бурный рост культуры, который идет с постоянной скоростью до полного исчерпывания всех компонентов питания.
Технологические усовершенствования могут касаться и конструкций используемого оборудования. Следует заменить внутренние змеевиковые теплообменники на плоские ламельные теплообменники, выполняющие одновременно роль отражательных перегородок, либо на высокоэффективные внешние. Возможно осуществить возврат к уплотнениям вала мешалки сальникового типа. Это обусловлено сложностью эксплуатации торцевых уплотнений, с другой стороны, появлением новых уплотняющих материалов, позволяющих создать более грамотные сальниковые уплотнения. Необходимо использование перемешивающих устройств большой мощности с плавным или ступенчатым регулированием числа оборотов. Наиболее эффективный привод с мощностью 2,5 кВт/м3. Во время культивирования меняются реологические свойства и потребность продуцента в кислороде, поэтому очень важно иметь привод с регулируемым числом оборотов мешалки. Максимальный расход мощности требуется в первые двое суток культивирования. При проектировании новых предприятий нужно предусматривать возможность понижения расхода снижением числа оборотов мешалки, а также изменения геометрии самой мешалки за счет сдвига лопастей к диску. Этим достигается экономия энергии, максимально обеспечиваются потребности культуры в кислороде. Для эффективности перемешивания среды кислород следует подавать через барботеры.
3)В промышленности глутаминовую кислоту можно получить и другими способами: многостадийным химическим синтезом из акрилонитрила и микробиологическим по двухступенчатой технологии, выделением из свекловичной мелассы или из белковых гидролизатов.
Двухступенчатый способ получения. Его можно осуществить из α-кетоглутаровой кислоты с помощью ферментов трансамилазы или глутаматдегидрогеназы в результате следующих превращений:
Похожие работы
... инженерию. Необходимо отметить, что если базовый стандарт по химии не предусматривает изучение вопросов биотехнологии, то таковой по биологии содержит наиболее общие её аспекты: достижения генной инженерии и перспективы биотехнологии. 2.2 Межпредметные связи по изучению аспектов биотехнологии в средней школе По программе Р.Г. Ивановой и Л.А. Цветкова в 10 классе предусмотрено изучение темы ...
... изолейцин, лейцин, лизин, метионин, треонин, триптофан, валин, фенилаланин. Аминокислоты — это не только питательные вещества, но также ароматические и вкусовые агенты, и потому они широко используются в пищевой промышленности. Как питательную добавку в пищу чаще всего вносят лизин и метионин. Глутамат натрия и глицин употребляют как ароматические вещества для усиления и улучшения вкуса пищи. У ...
... обществ по защите прав потребителей (КонфОП), например, заверяет, что у них уже на протяжении пяти лет нет претензий к производителям. "Пищевые добавки - это технические составляющие продуктов, необходимые на данном этапе развития пищевой промышленности. Опасного в них ничего нет", - официальное заверение высокого чиновника вице-президента КонфОПа Дмитрия Янина. Однако с ним согласны далеко не ...
... микроб - продуцент культивируют в среде, где он получается и синтезирует все необходимые ингредиенты для последующего синтеза ( в идиофазу ) целевого продукта. Если ферменты биосинтеза аминокислоты накапливаются внутриклеточно, но после 1 - ой ступени клетки сепарируют, дезинтегрируют и применяют клеточный сок. В других случаях для целей биосинтеза целевых продуктов применяют непосредственно ...
0 комментариев