Навигация
Механизмы влияния производных адамантана на индуцируемую агрегацию тромбоцитов человека in vitro
3.2. Механизмы влияния производных адамантана на индуцируемую агрегацию тромбоцитов человека in vitro
К настоящему моменту в литературе отсутствует информация о возможных механизмах влияния подобных соединений на функционирование тромбоцитарных рецепторов. Влияние веществ на скорость агрегации тромбоцитов может быть обусловлено их способностью усиливать сродство серотонина к рецепторам (синергисты) или каким-либо образом блокировать доступ лиганда к своему рецептору. Также возможным является агонистическое влияние на рецептор с малой константой ассоциации агониста с рецепторной молекулой. Для проверки данных предположений были поставлены эксперименты с веществами без индуцирования агрегации известными агрегантами. Исследования показали, что вещества не способны самостоятельно индуцировать агрегацию (табл. 21, рис 10).
Таблица 21.
Влияние производных адамантана на не индуцированную агрегацию тромбоцитов человека in vitro
| № изучаемого соединения | Интенсивность агрегации тромбоцитов, у. е. | |
| Опыт, n=10 | Контроль, n=6 | |
| 2 | 22,7±1,1 | 19,8±1,0 |
| 9 | 45,5±3,5 | 43,3±4,1 |
| 12 | 30,6±4,5 | 28,7±6,2 |
| 13 | 20,1±1,2 | 16,2±4,3 |
| 14 | 41,7±3,5 | 47,8±2,6 |
а.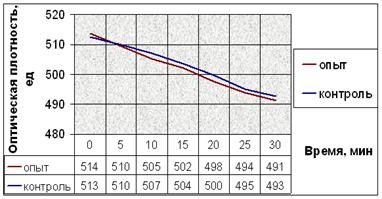
б.
в.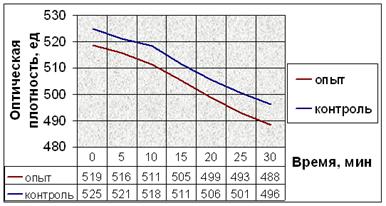
г.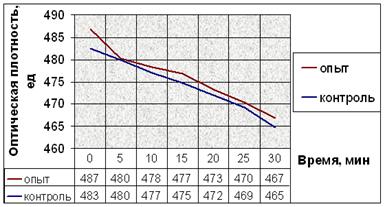
д.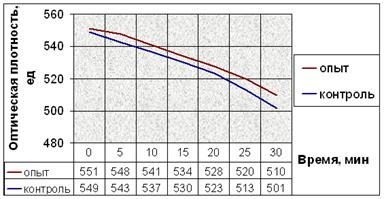
Рис. 10. Динамика снижения оптической плотности проб при не индуцируемой агрегации тромбоцитов человека: (а) В опытные пробы добавляли соединение № 2. (б) В опытные пробы добавляли соединение № 9. (в) В опытные пробы добавляли соединение № 12. (г) В опытные пробы добавляли соединение № 13. (д) В опытные пробы добавляли соединение № 14. Интенсивность агрегации в опытных пробах почти не отличается от таковой в контрольных пробах.
Полученные данные свидетельствует о том, что исследуемые производные не способны самостоятельно проводить сигнал, а влияют лишь на сродство серотонина к рецептору тромбоцита, модулируя эффективность проведения сигнала активации (рис. 8).
Из результатов экспериментов с добавлением веществ при индукции агрегации тромбоцитов АДФ, представленных в таблице 22, видно, что 4-адамантанкарбоксамидо-этилбензоат (соединение № 14) способен значительно замедлять АДФ-индуцированную агрегацию тромбоцитов. Возможно, эта его способность обусловливает незначительное замедление и серотонин-индуцированной агрегации.
Таблица 22.
Влияние производных адамантана на АДФ-индуцированную агрегацию тромбоцитов человека in vitro
| № изучаемого соединения | Интенсивность агрегации тромбоцитов, у. е. | |
| Опыт | Контроль | |
| 2, nоп=11 nк=8 | 47,2±0,8* | 43,5±1,7 |
| 9, nоп=11 nк=8 | 62,5±2,9** | 47,9±3,2 |
| 12, nоп=10 nк=5 | 62,6±2,8* | 45,7±6,3 |
| 13, nоп=11 nк=7 | 43,4±4,1 | 39,7±3,4 |
| 14, nоп=10 nк=8 | 22,8±1,2** | 32,2±3,3 |
П р и м е ч а н и е: уровни достоверности результатов ٭- р<0,05; ٭٭- p<0,01 к контролю.
Очевидно, производное № 14 влияет на рецепторы тромбоцитов, сопряжённые с G-белками, блокируя проведение сигнала активации агрегации. А N-(1-адамантилацетил)-4-аминопиридин (производное № 9), напротив, интенсивно ускоряет проведение сигнала и усиливает АДФ-индуцированную агрегацию тромбоцитов. 2-[N-(1-адамантоил)амино]-1-метилпиридиний иодид (производное № 2) здесь тоже усиливает агрегацию, но не так интенсивно. Вещество № 13 не влияет на АДФ-индуцированную агрегацию тромбоцитов. Результат действия индольного производного (№ 12) несколько размыт высокой ошибкой среднего значения из-за индивидуальных колебаний показателей плазмы разных людей. Но ускорение агрегации тромбоцитов в пробах с веществом № 12 по сравнению с контролем достоверно (табл. 22).
Результаты экспериментов с добавлением веществ при индукции агрегации тромбоцитов АДФ показаны на рисунке 11.
а.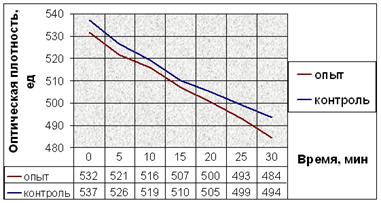
б.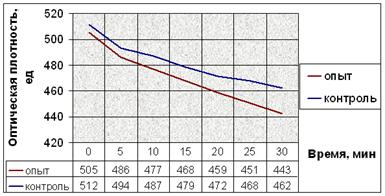
в.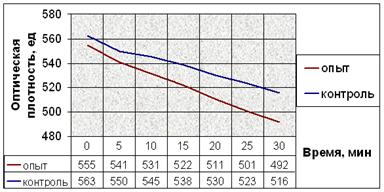
г.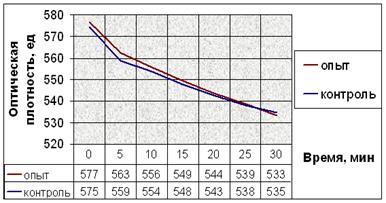
д.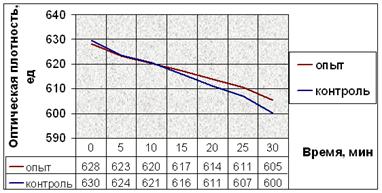
Рис. 11. Динамика снижения оптической плотности проб при АДФ-индуцируемой агрегации тромбоцитов человека. (а) В опытные пробы добавляли соединение № 2. (б) В опытные пробы добавляли соединение № 9. (в) В опытные пробы добавляли соединение № 12. (г) В опытные пробы добавляли соединение № 13. (д) В опытные пробы добавляли соединение № 14.
Заметим, что влияние исследуемых соединений на АДФ-индуцируемую агрегацию тромбоцитов наблюдается не сразу после их добавления в пробы (как в эксперименте с серотонином), а лишь после определённого латентного периода (рис. 11). Это значит, что соединения начинают влиять на рецепторы для АДФ только после внедрения в плазматическую мембрану, изменяя их сродство к лиганду.
Снижение оптической плотности в опытных пробах с соединением № 2 в течение первых 20 минут мало отличается от такового в контрольных, но за последующие 10 минут оно более интенсивно и достоверно отличается от контроля. После пяти минут экспозиции падение оптической плотности в пробах с добавлением вещества № 9 интенсивнее. Отличия динамики снижения оптической плотности опытных и контрольных проб в эксперименте с веществом № 12 также начинаются после пяти минут экспозиции. Интенсивность снижения оптической плотности в опытных пробах в эксперименте с веществом № 13 почти не отличается от таковой в контрольных. Соединение № 14 способствует замедлению падения оптической плотности опытных проб после 10 минут от начала агрегации (рис. 11).
Полученные данные говорят о том, что, скорее всего, производне № 2 и 13 изменяют сродство серотонина к рецепторам-ионным каналам, а производные № 9, 12 и 14 способны влиять на сродство лиганда к своим гликопротеиновым рецепторам (табл. 22).
К гликопротеиновым рецепторам, функционирующим посредством G-белков, относится большинство из множества всех рецепторов клеток (в данном случае тромбоцитов). Возникает вопрос о специфичности влияния исследуемых производных адамантана. Возможно, среди данных соединений присутствуют синергисты других агрегантов, также проводящих сигнал активации посредством ассоциации с гликопротеиновыми рецепторами. Действительно, предположение подтверждено экспериментом с добавлением веществ при индукции агрегации тромбоцитов адреналином: вещества № 9 и № 12 ускоряют проведение сигнала и через сопряжённые с G-белком адренорецепторы, а вещества № 2, 13 и 14 не способны модулировать функционирование тромбоцитарных адренорецепторов (табл. 23, рис. 12).
Таблица 23.
Влияние производных адамантана на адреналин-индуцированную агрегацию тромбоцитов человека in vitro
| № изучаемого соединения | Интенсивность агрегации тромбоцитов, у. е. | |
| Опыт, n=10 | Контроль, n=6 | |
| 2 | 39,4±1,8 | 41,5±3,5 |
| 9 | 48,7±5,1* | 33,6±4,6 |
| 12 | 46,0±1,2*** | 30,3±3,2 |
| 13 | 40,5±3,4 | 40,2±4,0 |
| 14 | 27,4±1,8 | 30,2±1,1 |
П р и м е ч а н и е: уровни достоверности результатов ٭- р<0,05; ٭٭٭- p<0,001 к контролю.
Динамика снижения оптической плотности в пробах с добавлением соединения № 2 не отличается от таковой в контрольных (так же и в эксперименте с соединениями № 13 и № 14). Значит, эти соединения не способны влиять на проведение сигнала активации через адренорецепторы. Добавление в опытные пробы соединения № 9 значительно ускоряло падение их оптической плотности по сравнению с контролем, то же наблюдалось и при добавлении соединения № 12.
Совершенно очевидно, что под влиянием соединений № 9 и 12 увеличивается эффективность того этапа (или нескольких этапов) функционирования гликопротеиновых рецепторов, который является общим для всех типов этих рецепторов, не зависимо от их специфичности (рис. 12, б, в).
Таким образом, доказанная предыдущими исследованиями [13] биологическая активность аминопиридиновых производных адамантана подтверждается и в нашем эксперименте: N-(1-адамантилацетил)-4-аминопиридин (№ 9) значительно увеличивает сродство тромбоцитарных рецепторов ко всем используемым в эксперименте агрегантам (табл. 10, 22, 23). Причём это, скорее всего, свидетельствует о его способности к модуляции функционирования гликопротеиновых рецепторов. Модификация аминопиридинового заместителя в составе производного адамантана приводит к изменению его активности: 2-[N-(1-адамантоил)амино]-1-метилпиридиний иодид (№ 2) усиливает, видимо, сродство серотонина к своим рецепторам со свойствами ионных каналов, почти не влияя на сродство к гликопротеиновым рецепторам (табл. 3, 22, 23).
Исследованиями [55] показана способность объёмных заместителей, вносимых в молекулу адамантана, изменять сродство серотонина к своим рецепторам. Существуют также экспериментально подтверждённые данные о том, что введение в молекулу производного высоколипофильного радикала усиливает его взаимодействие с гидрофобными областями рецепторных молекул [27]. Эти данные подтверждаются и в нашем эксперименте: 4-адамантанкарбоксамидо-этилбензоат (№ 14) действительно имеет подобную активность (табл. 15, 22), способствуя замедлению проведения сигнала активации АДФ и серотонином. Причём некоторое блокирование проведения сигнала под действием 4-адамантанкарбоксамидо-этилбензоата наблюдается через 10 минут. На адреналин-индуцируемую агрегацию он почти не влияет, и причину этого явления ещё предстоит выяснить.
Аминокислотные производные адамантана – 3-(1-адамантанкарбоксамидо-этил)индол (№ 12) и N-(1-адамантоил)-D,L-гистидин (табл. 1, № 13), – тоже имеют интересную активность. N-(1-адамантоил)-D,L-гистидин, вероятно, антагонистически действует только на серотониновые ионные каналы тромбоцитов, а 3-(1-адамантанкарбоксамидо-этил)индол весьма эффективно ускоряет агрегацию тромбоцитов, индуцированную и серотонином, и АДФ, и адреналином (табл. 13, 22, 23), т. е. его активность направлена на рецепторы гликопротеинового типа. Вещество № 12 интересно ещё и тем, что его структура очень похожа на структуру самого серотонина (рис. 7). Несмотря на то, что вещество № 12, как и серотонин, является производным триптофана, оно не является его агонистом (табл. 21).
Заключение
Влияние производных адамантана на способность тромбоцитов человека к агрегации – одно из многих проявлений их биологической активности. Высокая липофильность и мембранотропность адамантана, а так же возможность внесения в его структуру разнообразных заместителей, позволяют синтезировать соединения с заданной биологической активностью. Но, как и все высоко активные вещества, производные адамантана токсичны, так как даже соединения с хорошо изученным биохимическим механизмом действия способны вызывать побочные реакции организма. Поскольку в фармакологическую практику всё чаще стали внедряться лекарственные препараты на основе производных адамантана, детальное изучение их биохимических свойств становится необходимым. Результаты исследований, приведённые в данной работе, возможно, являются первыми шагами на пути к созданию высокоэффективных лекарств, позволяющих решить проблемы многих людей, страдающих патологиями системы гемостаза.
Скорее всего, биологическая активность производных адамантана по отношению к серотониновым рецепторам – ионным каналам – обусловлена способностью изменять их конформацию за счёт изменения структуры плазматической мембраны. Тем более это вероятно, если принять во внимание мембранотропность адамантанового ядра и канальное строение серотониновых рецепторов. Поскольку другие серотониновые рецепторы как и рецепторы для АДФ и для адреналина являются гликопротеинами, и их строение более сложно и менее зависит от ориентации фосфолипидных слоёв мембраны, здесь более вероятен механизм модуляции функционирования самого рецептора, в результате чего активация G-белков происходит эффективнее.
Проведённые исследования позволили сделать новые выводы относительно зависимости влияния производных адамантана на агрегацию тромбоцитов человека от химической структуры адамантильных заместителей. Прояснились некоторые вопросы, связанные с механизмами воздействия вновь синтезированных соединений на рецепторы тромбоцитов человека: очевидна их способность изменять сродство лигандов не только к рецепторам – ионным каналам, но и к рецепторам, сопряжённым с G-белком, что определяет направление дальнейших исследований.
Выводы
1.Влияние производных адамантана на серотонин-индуцируемую агрегацию тромбоцитов человека определяется их структурой и взаимным расположением атомов в молекуле.
2.Производные адамантана оказывают различное действие на индуцируемую агрегацию тромбоцитов человека, что является следствием их способности влиять на функционирование разных тромбоцитарных рецепторов, но ни одно из исследуемых соединений не способно самостоятельно индуцировать агрегацию тромбоцитов (не имеют свойств агонистов).
3.Усиливающее влияние 2-[N-(1-адамантоил)амино]-1-метилпиридиний иодида наиболее выражено при серотонин-индуцируемой агрегации тромбоцитов, что обусловлено его способностью усиливать сродство серотонина к своим рецепторам со свойствами ионных каналов, почти не влияя на сродство к гликопротеиновым рецепторам (синергист серотонина).
4.N-(1-адамантилацетил)-4-аминопиридин и 3-(1-адамантанкарбоксамидо-этил)индол усиливают агрегацию тромбоцитов, индуцируемую и серотонином, и адреналином, и АДФ, увеличивая эффективность одного из этапов функционирования гликопротеиновых рецепторов, общего для всех типов этих рецепторов.
5.N-(1-адамантоил)-D,L-гистидин, напротив, эффективно замедляет серотонин-индуцируемую агрегацию тромбоцитов, блокируя проведение сигнала активации серотонином (антагонист серотонина).
6.4-адамантанкарбоксамидо-этилбензоат способствует замедлению агрегации тромбоцитов, индуцируемой и АДФ, и серотонином, не влияя при этом на адреналин-индуцируемую агрегацию.
Литература
1.Андронова В. Л. Противовирусная активность препаратов ряда адамантана. //Антибиотики и химиотерапия. - 1996. - 41, № 718. - С. 26-30.
2.Антоников И. М. Форма тромбоцитов крысы на различных этапах процесса их агрегации. // Вестн. Акад. мед. наук. - 1981. - 55, № 6. С. 78-79.
3.Багрий Е. И. Адамантаны: получение, свойства, применение. - М.: Наука, 1989. - 264 с.
4.Балуда В. П., Баркаган З. С., Гольдберг Е. Д. и др. Лабораторные методы исследования системы гемостаза. - Томск, 1980. - 84 с.
5.Балуда В. П., Лукоянова Т. И. Простациклин-генерирующая система стенки сосудов и тромбогенез. // 1 Всесоюзная конференция, Поражение сосудистой стенки и гемостаз. (Полтава, 1981). - С. 20.
6.Белушкина Н. Н., Северина И. С. Торможение АДФ-индуцируемой агрегации тромбоцитов гуанидинотиолами – новым классом активаторов гуанилатциклазы и субстратов NO-синтазы. // Биохимия. - 1996. - 61, № 12. - С. 2140-2146.
7.Вотяков В. И., Бореко Е. И., Владыко Г. В., Карако Н. И., Коробченко Л. В. Поиск соединений, активных в отношении вирусов гриппа и возбудителей других ОРВИ. // Химиотерапия и химиопрофилактика гриппа и ОРЗ. (Сб. науч. трудов). - Л., 1990. - С. 150.
8.Воробьёв В. Б. Физиология гемостаза. - Ростов-на-Дону: Изд. дом Профф. Пресс, 2004. - 192 с.
9.Врынчану Н. А. Острая токсичность новых производных адамантана и норборнана. // Токсикология лекарств. – Киев: Институт фармакологии и токсикологии АМН Украины, 2001. – С. 20-25.
10. Голубева М. Г. Роль адренорецепторов в регуляции системы свёртывания крови. // Физиология человека. - 1989. - 15, № 6. С. 127-137.
11. Даниленко Г. И., Мохорт М. А., Триус Ф. П. Синтез и биологическая активность производных адамантана. N-(адамантоил-1)антраниловые кислоты. // Хим.-фарм. Журн. - 1973. - 17, № 10. С. 15-17.
12. Даниленко Г. I., Рибалко С. Л., Максимов Ю. М. та інш. Пошук інгібіторів ВІЛ та герпесу серед похідних каркасних сполук та піридинкарбонових кислот // Биополимеры и клетка. - 1999. - 15, № 3 – С. 207-212.
13. Ермохин В. А. Синтез и биологическая активность адаманитлпроизводных гетерофункциональных ароматических аминов и азотсодержащих гетероциклов: Автореф. дис. ... канд. химич. наук. – Самара, 2007. - 22 с.
14. Ермохин В. А., Зарубин Ю. П., Пурыгин П. П., Золотарёв П. Н. Синтез и антибактериальная активность N-(нитрофенил)-адамантил-1-карбоксамидов и адамантансодержаших иодидов N-метилпиридиния. // Вестник СамГУ. Естественнонаучная серия. – 2007. – 56, № 6. – С. 378-384.
15. Ермохин В. А., Пурыгин П. П., Зарубин Ю. П. Адамантановые производные эфиров и амидов 4-аминобензойной кислоты. // Вестник СамГУ. Естественнонаучная серия. – 2006. – 49, № 9. – С. 92-96.
16. Ермохин В. А., Пурыгин П. П., Клёнова Н. А. Синтез и гемолитическая активность N-адамантоилзамещённых гетероциклических аминов и анилинов. // Вестник СамГУ. Естественнонаучная серия. – 2004. – 34, № 4. – С. 138-144.
17. Зинченко В. П., Долгачева Л. П. Внутриклеточная сигнализация. – Пущино: Электронное издательство «Аналитическая микроскопия», 2003. – 84 с.
18. Индулен М. К., Колнина В. А., Рязанцева Г. М., Бубович В. И. Механизмы антивирусного действия производных адамантана. Под ред. М. К. Индулен. - Рига: Знание, 1981. – 168 с.
19. Исаев С. Д., Новикова М. И., Коробенко Л. В. Синтез и биологическая активность адамантилсодержащих оксазолов и имидозолов. // Физиологически активные вещества: Республиканский межведомственный сборник. – 1991. – 125, № 23. – С. 26-31.
20. Касьян Л. И., Касьян А. О., Голодаева Е. А. // Журнал органической химии. – 2000. – 36, № 12. - С. 1776-1779.
21. Ковалёв И. Е., Щипулина Н. В. // Доклады Российской академии наук. - 2001. - 378, № 6. - С. 819-822.
22. Козинец Г. И., Сарычева Т. Г. и др. Атлас клеток крови и костного мозга. Под ред. Г. И. Козинца. – М.: «Триада-Х», 1998. - 160 с.
23. Колосова Е. А., Курбатова С. В., Соловова Н. В., Финкельштейн Е. Е., Яшкин С. Н. Топология полиэдрических молекул на примере производных адамантана. // Вестник СамГУ. Естественнонаучная серия. – 2001. – 20, № 2. – С. 178-188.
24. Красуцкий П. А., Семёнов И. П., Новикова М. Н., Весёлова Т. В. Аминокислоты ряда адамантана. Синтез и противовирусная активность α-аминокислот ряда адамантана и их производных. // Хим-фарм. Журнал. - 1985. - 57, № 7. - С. 17-25.
25. Кубарь О. И. Анализ побочных реакций, вызываемых противовирусными препаратами // Безопасность лекарств. – 1997. – 78, № 1. - С. 5-7.
26. Кульберг А. Я. Рецепторы клеточных мембран. Биохимия мембран. Под ред. А. А. Болдырева. Кн. 4. – М.: Высш. шк., 1987. – 103 с.
27. Курбатова С. В., Шумская Н. Ю. Исследование взаимосвязи между структурой и хроматографическим поведением карбонильных производных адамантана в условиях обращённо-фазовой ВЭЖХ. // Вестник СамГУ. Естественнонаучная серия. - 2004. –34, № 6. – С. 158-168.
28. Литвинов В. П. Биологическая активность производных адамантана. // Химия гетероциклических соединений. - 2002. - 50, № 1. - С. 12-39.
29. Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: в 2-х томах. Т. 2. Пер. с англ.: - М.: Мир, 1993. – 415 с.
30. Морозов И. С., Петров В. И., Сергеева С. А. Фармакология адамантанов. - Волгоград: Волгоградская мед. академия, 2001. - 320 с.
31. Ноздрачев А. Д., Баженов Ю. И., Баранникова И. А., Батуев А. С. и др. Начала физиологии: Учебник для ВУЗов. Под ред. Акад. А. Д. Ноздрачева. - СПб.: «Лань», 2001. – 1088 с.
32. Панченко Е. П., Добровольский А. Б. Тромбозы в кардиологии. Механизмы развития и возможности терапии. – М.: Спорт и культура, 1999. – 464 с.
33. Пархоменко А. Н. Патофизиология острого тромбоза в венечных артериях сердца: представления о патогенезе острого коронарного синдрома. – Киев: Инст. кардиологии им. Н. Д. Стражеско АМН Украины, 2004. – 25 с.
34. Покровский В. М., Коротько Г. Ф., Наточин Ю. В. и др. Физиология человека. Учебник в 2-х томах. Под ред. В. М. Покровского, Г. Ф. Коротько. – М.: Медицина, 1997. – 368 с.
35. Русяев В. А., Вотяков В. И., Федоров А. Н. Сравнительная оценка фармакотерапевтического эффекта соединения Д-84 и ремантадина при экспериментальной гриппозной инфекции белых мышей // Антивирусная активность и механизм действия различных химических соединений (под ред. Р. А. Кукайн). - Рига: Зинатне, 1979. - С. 49-53.
36. Самаль А. Б., Черенкевич С. И., Хмара Н. Ф. Агрегация тромбоцитов: методы изучения и механизмы. – М.: Университетское, 1990. - 104 с.
37. Севастьянова В. В., Краюшкин М. М., Юрченко А. Г. Успехи химии адамантана. // Успехи химии. – 1970. – 39, № 10. – С. 1721-1754.
38. Сергеев П. В., Сейфулла Р. Д, Майский А. И Физико-химические механизмы и гормональная регуляция свёртывания крови. – М: Высш. шк., 1974. - 145 с.
39. Столяров З. Е., Лященко К. П. Аминопроизводные адамантана и иммунный ответ // Хим-фарм. журнал. – 1995. – 8, № 3. – С. 9-10.
40. Трифонов Е. В. Психофизиология человека. – М.: Высш. шк., 2004. – 130 с.
41. Фролов Ю. П. Математические методы в биологии. ЭВМ и Программирование. - Самара: «Самарский университет», 1997. - 265 с.
42. Циммерман М., Ениг В., Вутке В. и др. Физиология человека. В 3-х томах. Т. 2. Пер. с англ. Под ред. Р. Шмидта и Г. Тевса. – М.: Мир, 1996. – 313 с.
43. Чирков Ю. Ю., Белушкина Н. Н., Тыщук И. А., Северина И. С. Изменения в активности гуанилатциклазы тромбоцитов человека при АДФ-индуцируемой агрегации. // Бюллетень экспериментальной биол. и медицины. – 1991. – 52, № 2. – С. 152-154.
44. Bojarski A. J., Mokrosz M. J. et al. The influence of substitution at aromatic part of 1,2,3,4-tetrahydroisoquinoline on in vitro and in vivo 5-HT1A/5-HT2A receptor activities of its 1-adamantoyloaminoalkyl derivatives. // J. Bioorganic and Med. Chem. – 2002. – 10, N 5. Р. 87-95.
45. Bonaventure P., Nepomuceno D., Miller K., Chen J., Kuei C., Kamme F., and oth. Molecular and pharmacological characterization of seretonin 5-HT2A and 5- HT2B receptor subtypes in dog. // Europen Journal of Pharmacology. - 2005. - 513, N 3. Р. 181-192.
46. Cerrito E., Lazzaro M. P., Gaudio E., Arminio P. and Aloisi G. 5HT2-receptors and serotonin release: Their role in human platelet aggregation. // Life Sciences. - 1993. -53, N 3. Р. 209-215.
47. Clerck F., Xhonneux B., Wiele r. Biochemical mechanisms in 5-hydroxytriptamine-induced human platelet aggregation // Agents Actions.- 1985. - 17, N 2. Р. 220-228.
48. Cohen M. L., Robertson D. W., Bloomquist W. E. and Wilson H. C. LY215840, a potent 5-hydroxytryptamine (5-HT)2 receptor antagonist, blocks vascular and platelet 5-HT2 receptors and delays occlusion in a rabbit model of thrombosis. // J. Pharmacol. Exp. Ther. - 1992.- 261, N 5. Р. 202-208.
49. Crawford N., Castle A. Microtudule and contractile submit proteins of blood platelets. Role in haemostatic activities. // Microtubules and microtubule inhibitors. – 1975. – 305, N 6. Р. 229-246.
50. Dahl M., Puusten T., Uotila P. The effect of arachidonic acid on the aggregability of human platelet rich plasma. // Prostaglandins leicotriens Med. – 1982. – 8, N 2. Р. 133-139.
51. F. F. De Clerk and A. G. Herman. 5-hydroxyryptamine and platelet aggregation. // Fed. Proc. – 1983. – 42, N 3. Р. 228-232.
52. Fred De Clerck, Benoit Xhonneux, Josée Leysen and Paul A. J. Janssen. The involvement of 5-HT2-receptor sites in the activation of cat platelets. // Thrombosis Research. – 1984. – 33, N 1. Р. 305-321.
53. Frojmovic M. M., Milton J. C. Human platelet size, shape and related functions in health and diasease. // Physol. Rev. – 1982. – 62, N 2. Р. 185-201.
54. Frojmovic M. M., Milton J. C. Physical. Chemical and functional changes following platelet activation in normal and “giant” platelet. // Blood Cells. - 1983. - 9, N 5. Р. 359-382.
55. Fujio M., Kuroita T. et. al. N-[1-(Phenylethyl)pyrrolidin-3-yl]-1-adamantanecarboxamides as Novel 5-HT2 Receptor Antagonists. // Bioorganic and Med. Chem. Lett. – 2000. – 4, N 10. Р. 2457-2461.
56. Fujio M., Togo Y., Tomozane H., Kuroita T., Morio Y., Katayama J. and Matsumoto Y. N-{[1-(2-Phenylethyl)pyrrolidin-2-yl]methyl}cyclohexane-carboxamides as selective 5-HT1A receptor agonists. // Bioorganic and Medicinal Chemistry Lett. – 2000. - 10, N 6. Р. 509-512.
57. Gear A., R. L. Preaggregation reactions of platelets. // Blood. – 1981. – 58, N 3. Р. 477-490.
58. Hoyer D., Clarke D.E. and Fozard J.R. et al.International Union of Pharmacology classification of receptors for 5-hydroxytryptamine (Serotonin). // Pharmacol Rev. – 1994. – 10, N 46. Р. 157.
59. Jacobs K. H. Determination of the turn-off reaction for the epinefrine-ingibited human platelet adenylate cyclase. // Eur. J. Biochem. – 1983. – 132, № 1. Р. 125-130.
60. Komiotis D., Pananookooln S. J., Zaw K., Dieter J. P., G. C. Le Breton and D. L. Venton. Synthesis of dl-cis- and (4R,5R)-trans-7-[2,2-dimethyl-4-(phenylsulfonyl)-aminomethyl-1,3-dioxolan-5-yl]-5(Z)-heptenoic acid analogues as platelet thromboxane A2 receptor antagonist. // European Journal of Medicinal Chemistry. – 1995. – 30, N 4. Р. 321-326.
61. Kroll M. H., Schafer A. I. Biochemical mechanisms of platelet activation. // Blood. – 1989. – 74, N 9. Р. 1181-1195.
62. Li Hui Yang, Demetra Callas, Jean Marc Herbert and Jawed Fareed. Modulation of platelet function and vascular smooth muscle contractile actions by a novel, selective, highly potent 5-HT2 antagonist (SR46349). //
Thrombosis Research. - 81, N 5. P. 555-567.
63. Li N., Wallen N.H., Ladjevardi M. and Hjemdahl P. Effects of serotonin on platelet activation in whole blood. // Blood Coagul. Fibrinolysis. – 1997. - 8, N 27. Р. 517-523.
64. Mahaut-Smith M. P.; Ennion S. J.; Rolf M. G.; Evans R. J. ADP is not an agonist at P2X(1) receptors: evidence for separate receptors stimulated by ATP and ADP on human platelets. // Br. J. Pharmacol. – 2000. – 131, N 1. Р. 10-14.
65. Marlar R. A., Kleiss A. J., Griffin J. H. An alternative extrinsic pathway of human blood coagulation. // Blood. – 1982. – 15, N 60. Р. 13-53.
66. Maurer-Spurej E., Pittendreigh C. and Solomons K. The influence of selective serotonin reuptake inhibitors on human platelet serotonin. // Thromb. Haemost. – 2004. – 12, N 91. Р. 119-128.
67. Nagatomo T., Rashid M., Abul Muntasir H. and Komiyama T. Functions of 5-HT2A receptor and its antagonists in the cardiovascular system. // Pharmacology and Therapeutics. – 2004. – 104, N 1. Р. 59-81.
68. Niewiarowski S. Platelet release reaction and secreted platelet proteins. // Haemostasis and trombosis. – 1981. – 11, N 18. Р. 73-83.
69. Ogawa T., Sugidachi A., Tanaka N., Fujimoto K. and Asai F. Pharmacological profiles of R-96544, the active form of a novel 5-HT2A receptor antagonist R-102444. // European Journal of Pharmacology. – 2002. – 457, N 20. P. 107-114.
70. P. Anne McBride, J. John Mann, Margaret J. Polley, Amy J. Wiley and John A. Sweeney. Assessment of binding indices and physiological responsiveness of the 5-HT2 receptor on human platelets. //
Life Sciences. - 1987. - 40, N 4. Р. 1799-1809.
71. Pauwels P. J. 5-HT receptors and their ligands. // Tocris. Rev. – 2003. – 27, N 25. Р. 1-7.
72. Perri T., Pasini F. L., Frigerio C. et al. Pharmacodynamics of ticlopidine in man in relation to plasma and blood cell concentration. // Europ. J. Clin. Pharmacology. – 1991. – 41, N 20. Р. 429-434.
73. Rao G. H. R., White J. C. Epinephrine potentiation of arachidonate-induce aggregation of cyclooxygenase-deficient platelets. // J. Biol. Chem. – 1980. – 255, N 8. Р. 355-366.
74. Rivail L. et al. Large-scale molecular dynamics of a G protein-coupled receptor, the human 5-HT4 serotonin receptor, in a lipid bilayer. // Journal of Molecular Structure, Theochem. – 2007. – 31, N 48. P. 1-8.
75. Rudnick G., Fishkes H., Nelson P. J., Schuldiner S. Evidence for two dittinct serotonin transport systems in platelets. // J. Biol. Chem. – 1980. – 17, N 2. Р. 3638-3641.
76. Rupprecht H.-J. Adenosine diphosphate receptor antagonists: from pharmacology to clinical practice. // Europ. Heart J. – 2000. – 2, N 7. Р. 1-5.
77. Savi P., Herbert J.-M. ADP receptors on platelets and ADP-selective antiaggregating agents. // Medical Research reviews. – 1996. – 16, N 2. Р. 159-179.
78. Savi P., Heilmann E., Nurden P. et al. Clopidogrel: an antithrombotic drug acting on the ADP-dependent activation pathway of human platelets. // Clin. Appl. Thrombosis. Hemostasis. – 1996. – 2, N 3. Р. 35-42.
79. Smith S. K., Limbird L. E. Solibilization of human platelet α-adrenogetic receptors: evidence that agonist occupancy of the receptor stabilizes receptor-effector interactions. // Proc. Nat. Acad. Sci. USA. 1981. – 78, N 7. Р. 4026-4030.
0 комментариев