Навигация
Картування генів за допомогою ДНК-зондів
2.5 Картування генів за допомогою ДНК-зондів
Методи картування генів, які обговорювалися в попередніх розділах, були засновані на експресії досліджуваних генів у культурах клітин. Гени, які кодують ферменти клітинного метаболізму і гени, які кодують поверхневі антигени, такі, як білки головного комплексу гістосумісності або антигени групи крові, задовольняють цій умові. Гени, які не володіють подібним фенотипічним проявом, не можуть бути картовані лише з використанням описаних методів. Це обмеження вдається перебороти за допомогою методів генної інженерії. При цьому стає можливим картування будь-яких послідовностей ДНК, для яких можна одержати відповідний ДНК-зонд. Ці методи внесли воістину революційний переворот у генетичний аналіз гібридів соматичних кліток.
Перше застосування методів роботи з рекомбінантними ДНК для картування генів людини включало ДНК-гібридизацію в розчині. Таким чином, вдалося картувати гени α- і β-глобінів. Зонди, які представляють собою комплементарні ДНК (кднк) цих генів, були отримані за допомогою зворотної транскрипції очищених α- і β-глобінових матриць. Ці зонди у певних умовах не взаємодіють один з одним або з глобіновими генами миші, але утворять стабільні дуплекси при обжизі з відповідними послідовностями ДНК людини. Глобінові кДНК-зонди використовували для тестування в розчині препаратів ДНК, виділених з різних гібридних клонів. Утворення стабільного дуплекса між кДНК-зондом і ДНК досліджуваного препарату свідчило про присутність людських глобінових генів у геномі відповідної гібридної лінії. Каріологічний аналіз виявлених у такий спосіб гібридних клонів дозволив зробити висновки, що гени β-глобінової родини розташовані в хромосомі 11, а α-глобінові в хромосомі 16.
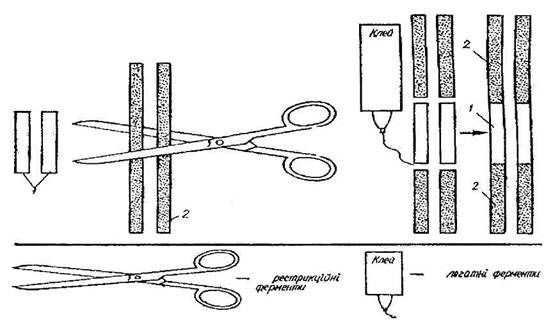
Для проведення гібридизаційного аналізу в розчині потрібно велика кількість ДНК. Додаткові труднощі пов'язані також з можливістю перехресної гібридизації між гомологічними генами людини і миші. Більшість цих труднощів можуть бути подолані за допомогою блот-гібридизації за Саузерном. На першому етапі відповідний ДНК-зонд мітять радіоактивними ізотопами (такими, як 32Р або 3Н) за допомогою нік-трансляції. Потім з гібридних ліній клітин, які несуть визначені хромосоми людини, виділяють препарати тотальної ДНК. Препарати ДНК обробляють рестрикуючими ендонуклеазами, а отримані фрагменти ДНК розділяють гель-електрофорезом, денатурують і переносять на нітроцелюлозні мембранні фільтри. На фільтрах здійснюється гібридизація з тим або іншими міченими ДНК-зондами. Для більшої ефективності можна розділяти ампліфіковані фрагменти хромосомної ДНК. Для цього використовують їхнє попереднє клонування на фагових векторах.
Після гібридизації фільтри накладають на рентгенівську плівку, на якій після прояву виявляються смуги, які відповідають рестрикційним фрагментам, які містять послідовності ДНК, гомологічні даному зондові . Гени співвідносять з певними хромосомами людини на підставі кореляції між присутністю даної хромосоми в гібридній клітинній лінії і наявністю фрагмента людської ДНК, який гібридизується на радіоавтограмі. Даний метод більш чуттєвий, ніж гібридизація ДНК у розчині і, головне, більш специфічний.
Метод гібридизації по Саузерну, поєднаний з підходами, розробленими для генетичного аналізу соматичних клітин, з успіхом застосовувався не тільки для картування визначених генів, але і для локалізації послідовностей ДНК із невідомими функціям, знайденими в бібліотеках генів людини.
РОЗДІЛ ІІІ. МЕДИЧНІ ТА ЕТИЧНІ АСПЕКТИ ДОСЛІДЖЕННЯ ГЕНОМУ ЛЮДИНИ
3.1 Пошкодження генів і спадкові хвороби
Варто також звернути увагу на питання, зв'язані з діагностикою, профілактикою і лікуванням спадкоємних захворювань, де аналіз генома стає усе більш діючим і надійним способом визначення хвороби.
Якщо існує тест, що з достатнім ступенем точності дає можливість виявити те або інше захворювання, то чи буде цей тест обов'язковим для всіх, або тестування буде залежати від бажання пацієнта?
З 10 тис. відомих захворювань людини близько 3 тис. спадкові хвороби. Вони необов'язково успадковуються (передаються нащадкам). Просто викликані вони порушеннями спадкоємного апарата, тобто генів (у тому числі в соматичних клітинах, а не тільки в статевих). Виявлення молекулярних причин "поломки" генів найважливіший результат проекту.
Спадковість безпосередньо зв'язана з продовженням роду, але і тут виникає питання про бажання і готовність чоловіка і жінки пройти обстеження перед тим, як завести дитини. Якщо, скажемо, обоє дружина є носіями гена спадкоємного захворювання, то з 25% імовірністю патологічний ген проявиться в дитини. У такому випадку проведення пренетальної діагностики, зв'язаної з виділенням кліток плоду з крові матері, просто необхідно, але тоді, у випадку виявлення патології плоду в свою чергу встає питання про можливості і навіть обов'язковості аборту.
Число вивчених хвороботворних генів швидко росте, і через 34 роки ми пізнаємо всі 3 тис. генів, відповідальних за ті або інші патології. Це допоможе розібратися в генетичних програмах розвитку і функціонування людського організму, зокрема, зрозуміти причини раку і старіння. Знання молекулярних основ захворювань допоможе їхній ранній діагностиці, а виходить, і більш успішному лікуванню. Адресне постачання ліками уражених кліток, заміна хворих генів здоровими, керування обміном речовин і багато інших мрій фантастів на наших очах перетворюються в реальні методи сучасної медицини. Одним з таких є генотерапія.
Основна частина робіт з генотерапії спадкових і інших захворювань орієнтована на одержання коригуючих послідовностей і векторів, їхній перенос і вбудовування в клітини-реципієнти. Для цієї мети випробуються плазмідні і вірусні вектори, балістичні мікроінфузії, трансплантація клітин, оскільки за наявним даним відомо, що для терапевтичного ефекту досить всього 5 - 10% нормально функціонуючих клітин. Серед можливих векторів для доставки коригуючих ДНК до клітин і тканин-мішеней при гемотерапії муковісцидозу розглядаються вірусні, плазмідні, ліпосомні і пептидні конструкції. Однак до клінічних іспитів потрібно ще вирішити непрості питання взаємодії генетичних препаратів з клітинами, стійкості ефекту.
Перспективним методом генотерапії вважається технологія ex vivo, коли клітинний матеріал, взятий від пацієнта, реплантується йому після екстракорпоральної генокорекції. Уже є приклад успішного лікування сімейної форми гіперхолестеринемії з використанням такого підходу.
Похожие работы
... і всіх розв'язних документів, необхідна певна законодавча база, що дозволяє у випадках появи негативних наслідків з юридичної точки зору вирішити проблему, що створилася. 1. Теоретичні основи генно-модифікованих продуктів Генетична інженерія - це нова галузь молекулярної біології, яка розробляє методи перенесення генетичного матеріалу від одного живого організму до іншого з метою ...
... – ПЛР аналіз ДНК трансфікованих клітин; виявлення АРОА1 людини в плазмі крові піддослідних кролів та культуральному середовищі трансфікованих клітин. АНОТАЦІЯ Гільчук Ю. М. Ефекти, обумовлені введенням у клітини ссавців трансгена аполіпопротеїну А-1 людини. – Рукопис. Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 03.00.22 – молекулярна генетика. – І ...
... "IQ"), що відображає серед іншого і здатність логічно мислити, у жінок значно вище, ніж у чоловіків. Досліджуючи роль статі у феномені геніальності, не можна не сказати і про ще одне типове уявлення. Існує думка, що геніальність пов'язана з гомосексуальністю, і існують численні приклади геніїв-гомосексуалістів (Мікеланджело, О.Уайльд, П.Чайковський). Однак вважати гомосексуальність істотною ...
алізовані, він так поставив свої досліди й опрацював результати, що міг дати точний кількісний аналіз успадкування і перекомбінування елементарних спадкових ознак в ряді поколінь. З одержаних таким чином експериментальних даних він зміг сформулювати ймовірнісно-ствтисичні комбінаторні закономірності успадкування і побудувати гіпотезу спадкових факторів і чистоти гамет. У цьому Мендель випередив ...
0 комментариев