Навигация
Осаждаемая и гравиметрическая формы
1.3 Осаждаемая и гравиметрическая формы
При осаждении форма осадка может быть различной в зависимости от условий, в которых оно проводится. Важно подобрать такие условия, при которых не происходит потери вещества. Поэтому осаждение считают важнейшей операцией гравиметрического анализа. При его выполнении необходимо правильно выбрать осадитель, рассчитать его количество, соблюсти определенные условия осаждения, убедиться в полноте осаждения иона из раствора.
Осадок в процессе анализа приходится доводить до постоянной массы. Поэтому в гравиметрическом анализе различают две формы: осаждаемую и гравиметрическую.
Осаждаемая форма – тот осадок, который получается в результате химической реакции между осаждаемым ионом и осадителем.
Например: Ba2+ + SO42– → BaSO4
К осаждаемой форме предъявляются следующие требования:
· малая величина растворимости, около 1•10–6 моль/л,
· осадок должен быть крупнокристаллическим,
· осаждаемая форма должна легко и полно превращаться в гравиметрическую форму.
Гравиметрическая форма – то вещество, которое получается после прокаливания осаждаемой формы.
В некоторых случаях осаждаемая и гравиметрическая формы одинаковы (например, BaSO4). В других случаях их состав отличается друг от друга:
| Осаждаемая форма | Гравиметрическая форма |
| CaCO3 | CaO |
| Fe(OH)3 | Fe2O3 |
| Al(OH)3 | Al2O3 |
Требования, предъявляемые к гравиметрической форме:
1. Состав гравиметрической формы должен точно соответствовать определенной стехиометрической формуле.
2. Она не должна менять своей массы на воздухе из-за поглощения паров H2O и CO2 или частичного разложения.
3. Содержание определяемого элемента в гравиметрической форме должно быть как можно меньше, т. к. в таком случае погрешности взвешивания в меньшей степени сказываются на результате.
Перечисленные требования к осадкам в свою очередь определяют требования к осадителям:
1. Осадитель должен образовывать с исследуемым компонентом осадок, обладающий наименьшей растворимостью.
2. Осадитель должен быть летуч, чтобы примеси его можно было удалить при прокаливании.
3. Осадитель должен быть специфичным, т. е. осаждать избирательно.
1.4 Растворимость осадков
Влияние ионной силы раствора. В аналитической практике образование и растворение осадка всегда происходит в присутствии посторонних электролитов. Так, при взаимодействии, например, растворов, содержащих стехиометрические количества BaCl2 и Na2SO4, в системе наряду с образовавшимся BaSO4 и одноименными с осадком ионами Ba2+ и SO42– будут находиться разноименные с осадком ионы Na+ и Cl–. Нахождение в растворе электролита, содержащего разноименные с осадком ионы, увеличивает ионную силу раствора I. При этом существенное влияние оказывают как концентрация ионов, находящихся в растворе, так и их заряд:
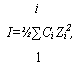
где Ci – молярная концентрация i-го иона; Z – заряд i-го иона.
Таким образом, введение в насыщенный раствор малорастворимого вещества раствора электролита, не содержащего одноименных с малорастворимым веществом ионов, вызывает увеличение растворимости малорастворимого вещества.
Влияние одноименных ионов. Введение в раствор одноименных с осадком ионов приводит к сдвигу равновесия и, соответственно, к уменьшению растворимости осадка.
Следует отметить, что в некоторых случаях при введении в раствор избыточного количества ионов, одноименных с осадком, растворимость осадка может увеличиваться вследствие образования растворимых комплексов.
Влияние pH среды. Если осадок представляет собой соль слабой кислоты, то при добавлении более сильной кислоты анионы осадка, находящиеся в растворе, будут взаимодействовать с ионами водорода с образованием слабой кислоты. При этом равновесие сдвигается вправо за счет протекания реакций и растворимость осадка увеличивается.
Влияние комплексообразующих реагентов. При введении в систему раствор – осадок соединений, образующих устойчивые комплексы с катионами малорастворимого электролита, растворимость осадка увеличивается.
Следует отметить, что на растворимость осадков помимо перечисленных выше факторов также оказывают влияние: 1) температура; 2) применяемый растворитель; 3) конкурирующие окислительно-восстановительные реакции.
Таким образом, для удовлетворения основного требования, предъявляемого к осадку в гравиметрическом анализе, – его малой растворимости – необходимо вести осаждение в присутствии одноименных ионов, при строго определенном pH среды, в отсутствие мешающих комплексообразующих реагентов, окислителей или восстановителей, необходимо контролировать температуру, при которой проводится осаждение.
Похожие работы
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...
... . разделением и концентрированием экстракцией, дистилляцией, ионным обменом, хроматографией, что в ряде случаев позволяет косвенно определять некоторые неметаллы и органические соединения. Методы атомно-абсорбционного анализа применяют также для измерения некоторых физических и физико-химических величин – коэффициент диффузии атомов в газах, температур газовой среды, теплот испарения элементов; ...
... каждый процесс уникален, и требуются некоторые усилия, для того чтобы точно характеризовать образец и его свойства посредством турбидиметрических (нефелометрических) измерений. 2.5.7 Мутность и содержание взвешенных веществ (твердых частиц) Традиционный анализ содержания взвешенных веществ обычно заканчивается гравиметрией, которая требует много времени и чувствительна к методике эксперимента. ...
... «Анализ смеси катионов 1 аналитической группы (Na+, K +, NH4+)». Цель работы: закрепление знаний, полученных при изучении свойств катионов; выработка навыков и умений систематического анализа катионов. Оборудование: пробирки, держатель, спиртовка, фильтровальная бумага, индикаторная бумага, стеклянные палочки, анализируемый раствор, реактив Несслера, гидротартрат натрия, дигидроантимонат ...





0 комментариев