Навигация
Механизм перегруппировки гидроксил амина
3. Механизм перегруппировки гидроксил амина.
Рассмотрим механизм данной перегруппировки:

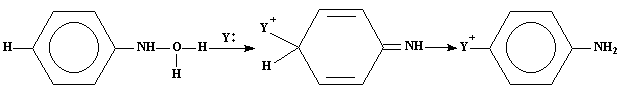
1.На первой стадии реакции к гидроксиламину присоединяется протон и образуется оксониевый катион(1)
2.Так как вода хорошая уходящая группа, она отщепляется и образует катион (2),у которого углеродный атом в п - положении имеет частичный положительный заряд.
3.Катион (2) реагирует с молекулой нуклеофильного реагента с образованием неустойчивого соединения (3). Продукт представленный формулой (3), имеет заряд карбониевого иона, который может находиться не только п-положении, как показано на схеме, но и орто-положении, так что, используя для карбониевого иона различные валентные структуры, можно объяснить в общем случае образование орто- и пара- продуктов.
4.В соединении (3) путем перехода протона от п-углеродного атома к атому азота получается изомерный конечный продукт.
4. Побочные реакции в перегрупировке в присутствии различных нуклиафильных реагентов.
В качестве нуклеофила может выступать не только отщепившаяся молекула воды, но и другие нуклеофильные реагенты, находящиеся в реакционной смеси. Например

Появление в конечном веществе вместо гидроксила других групп показывает, что перегруппировка является интермолекулярным процессом. Так как источником этих групп служат нуклеофильные молекулы – этиловый спирт, метиловый спирт, анион хлора, фенол, анилин – то, необходимо предположить, что в ходе перегруппировки образуется электрофильное промежуточное соединение (2), что и было доказано Бамбергером.
Вторая и третья стадия схемы отображают образование карбониевого иона, которое затем присоединяет нуклеофильный реагент в положение отличное от первоначального. Это форма мономолекулярного нуклеофильного замещения с перегруппировкой SN1. Допустимо, что при некоторых обстоятельствах обе стадии сливаются в одну, что соответствует SN2 механизму. Механизм в этом случае можно выразить так:
Наиболее вероятен механизм SN1
5. Варианты протекания перегрупировки в случае когда пара-положение занято.
Если пара-положение занято, то в присутствии соляной кислоты получаются хиноидные структуры:

Которые при гидролизе дают хиноны:
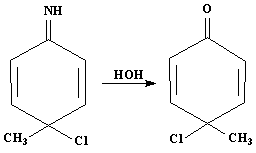
Образование соединения (4) не возможно, так как вместо водорода в пара-положении стоит метильная группа.
Перегруппировка нитроаминов.
1.Общие сведения о перегруппировке.
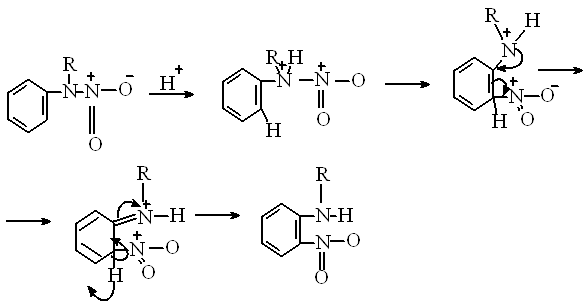
Перегруппировка арилнитроаминов, протекает при их обработке водными растворами сильных кислот или соляной кислоты в сред органического растворителя и приводит к образованию главным образом о-нитроанилина (34).
Перегруппировка является нуклеофильной, может протекать как по интрамолекулярному, так и по интермолекулярному механизму, протекает с миграцией от атома азота к атому углерода.
2.Механизм перегруппировки.
Были высказаны три предположения о механизме реакции. Согласно первому предположению перегруппировка протекает по интрамолекулярному механизму- реакция 2. Согласно второму предположению по интемолекулярному механизму- реакция 1.Согласно третьей гипотезе все три реакции протекают одновременно и независимо друг от друга.

Механизм перегруппировки, ели учитывать только интермолекулярную реакцию(3), можно представить следующей схемой
Бензидиновая перегруппировка.
1.Общие сведения о пергруппировке.
Превращение гидразобензола в 4, 4- диаминобифенил, названный бензидином, под действием сильных кислот было открыто в 1845 году Н.Н. Зининым.
Это превращение впоследствии получило название бензидиновой перегруппировки. В настоящее время этим термином объединяют целую группу родственных перегруппировок, приводящих к образованию смеси орто- и пара-изомерных производных диаминодифенила.
При перегруппировке самого гидразобензола получается смесь диаминов, содержащая 70 % бензидина и 30% 2, 4- диаминобифенила.
2.Механизм перегруппировки.
Значительное влияние на направление перегруппировки гидрозобензола оказывает заместитель, они играли бы еще большую роль, если бы эти перегруппировки не были очень жесткими, в них часто происходит отщепление заместителя, препятствующие перегруппировке.
H2CO3, СО2Н – легко отщепляются, хуже – Cl, CH3 – COO, аклоксильный радикал OR , а также - NRCOC3 , NR2, алкильные радикалы не относящиеся вообще.
Вопросами о механизме бензидиновой перегруппировки стали интересоваться в начале нашего столетия. Необходимо было объяснить каким образом молекула гидробензола может «вывернуться на изнанку»,не распадаясь на части:
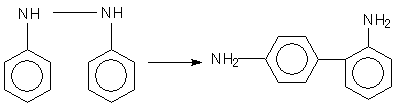
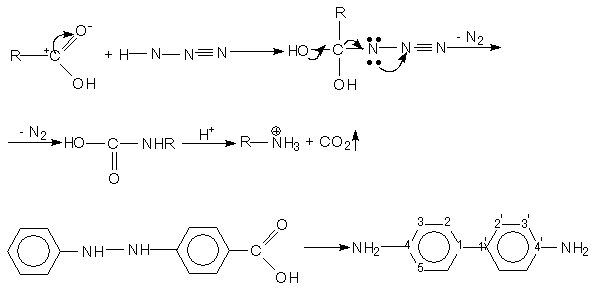
Одновременно в результате орто –миграции образуется 2,4 диаминодифенил:
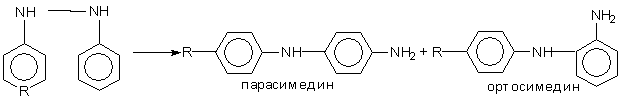
Если в молекуле исходного гидразобензола одно или обе пара положения заняты заместителями, то образуется орто и пара семидины.
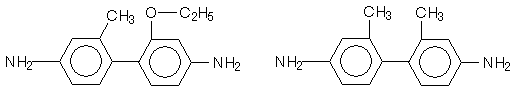
Сначала перегруппировка бензидиновая предполагала, что она протекает с разрывом связи N-N и образованием2-х радикалов или ионов.
3.Доказательства интрамолекулярности.
В настоящее время точно установлено, что перегруппировка носит интра характер (внутренний). Доказательством послужило то, что при перегруппировки 2–метил–2'-этоксигидразобензола, содержащего радиактивный углерод С* в метильной, группе не образуется свободный радикал, О- CH3C6 H4-NH, т.к. иначе они могли бы реагировать друг с другом давая радиохимически активных ортотолидин.
На самом деле реакция не протекает таким образом.
При изучении перегруппировки 2,2-диметоксигидразобензола и 2,2’- диэтоксигидразобензола образуются соединения следующего строения:
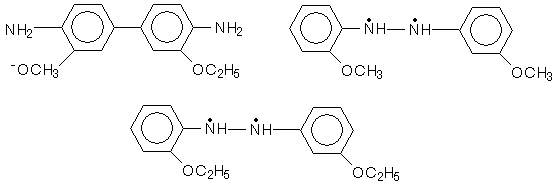
Скорость бензидиновой перегруппировки пропорциональна концентрации С6H5 –NH-NH-C6H5 и пропорционально квадрату концентрации Н + :
V= ![]() [C6 H5 NH –NH- C6 H 5 ] * [H+]2
[C6 H5 NH –NH- C6 H 5 ] * [H+]2
Таким образом механизм бензидиновой перегруппировки можно представить следующим образом :
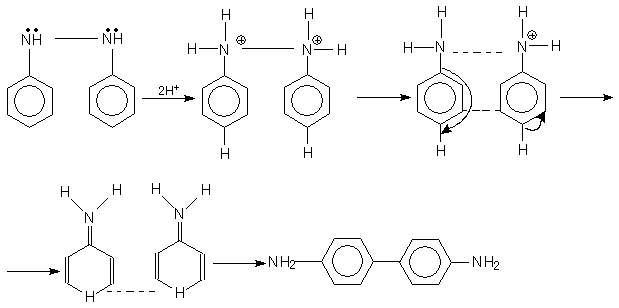
После присоединения 2-х протонов к молекуле гидразобензола (I) и образование катиона (II) связь между N-N начинает разрываться, е- пара смещается в сторону одного из атомов азота, одновременно образуется связь между пара углеродными атомами бензольных ядер (III), затем связь N-N разрывается с одновременным образованием связи С-С и последующим удалением 2-х протонов через хиноиндную структуру, таким образом получается бензидин (V)
Обобщающая таблица по теме «Молекулярные перегруппировки»
| Перегруппировки | |||||||
| В ароматическом ряду | В алифатическом ряду | ||||||
| Нуклеофильные | Изомеризация | ||||||
| Миграция от атома | Интермолекуляр. | Интрамолекул. | Интрамолекул. | ||||
| С-С | 1.Ацилоиновая | 1.Наметкина 2.Изомеризация парафиновых у.в. | 1.Альдегидо-кетонная | с изомери-зацией | |||
|
| 1.Соммелета | 3.Пинаколиновая 4.Бензильная 5.Демьянова 6.Вольфа | 2.Ретропинако-линовая 3.Вагнера | Без изомери-зации | |||
| N-С | 1.Семидиновая 2.Гидроксиламинов | 1.Бензидиновая 2.Нитроаминов | 1.Бекмена | ||||
| С-N | 1.Гофмана* 2.Лосеня 3.Курциуса 4.Шмидта | ||||||
| Электрофильные | |||||||
| О-С | 1.Фриса |
|
|
|
| ||
| N-C | 1.Диазоамино- Аминоазо 2.Алкилкиланилинов 3.Нитрозаминовая 4.Ортона |
|
|
| 1.Стивенса | ||
| С-С |
| 1.Фаворского 2.Кляйзена |
|
| 1.Виттига | ||
| С-О |
|
|
| 1.Арбузова |
| ||
| Не стереоспецифические | Стереоспецифические | ||||||
.
Знак *означает, что данные перегруппировки могут протекать как в алифатических, так и в ароматических системах.
Похожие работы
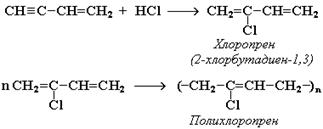
... которых можно осуществить превращения:→ 3.1. этанол → бутадиен-1,3 → бутадиеновый каучук 3.2. 2-метилбутан → изопрен → цис-полиизопрен ГЛАВА IV. ТЕСТЫ И ЗАДАЧИ ПО ТЕМЕ «НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ» Задачи 1. При пропускании 11,2 л (н.у.) смеси этана, этилена и ацетилена через склянку с бромной водой масса склянки увеличилась на 10,9 г. При пропускании исходной ...
... в химию магнитные взаимодействия. Будучи пренебрежимо малыми по энергии, магнитные взаимодействия контролируют химическую реакционную способность и пишут новый, магнитный «сценарий» реакции. Дизайн молекулярных магнетиков — одно из новых научных направлений современной химии, связанное с синтезом систем высокой размерности. Сегодня достижения современной химии таковы, что химики могут ставить ...
... новые возможности, которые возникали с появлением новых методов исследования, позволяли делать открытия, радикально менявшие взгляды на патологию, начинать качественно новые этапы её развития. Патологическая анатомия использует три основных метода исследования — вскрытие трупов людей, умерших от болезней (1); микроскопические методы изучения тканей (2); эксперимент, позволяющий моделировать на ...
... М., 1976; Система, структура и процесс развития международных отношений / Отв. ред. В.И. Ганпман. — М., 1984. 17. См., например: Антюхчна-Московченко В.И., Злобин А.А., Хруста-лев М.А. Основы теории международных отношений. — М., 1988, с. 68. 18. Возе К. 5осю1ое1е (1е 1а ра1х. — Рапа, 1965, р. 47—48. 19. ВгаШаг<1 РН., Д/аИН М.-К. Ьех ге1аиоп5 т1етайопа1е&. — Рапа, 1988, р. 65-71. 20. ...

0 комментариев