Навигация
Контрольный синтез Mg(NO3)2 – MgO – MgCl2
Кафедра химии
Контрольный синтез
Mg(NO3)2 – MgO – MgCl2
Киров 2007
Цель работы: Изучить цепочку синтеза Mg(NO3)2 - MgO - MgCl2, и осуществить ее на практике. Рассмотреть физико-химические характеристики веществ, участвующих в химических реакциях при синтезе MgCl2 из Mg(NO3)2 , их химические свойства, и методы качественного и количественного анализа соединений магния.
1). Химический синтез оксида магния (MgO) из нитрата магния Mg(NO3)2
Mg(NO3)2 → MgO
Физико – химическая характеристика Mg(NO3)2 :
1. Встречается в природе в небольших количествах в виде нитромагнезита (гидрат), или магнезиевой селитры.
2. Нитрат магния при обычных условиях кристаллогидрат состава Mg(NO3)2·nH2O, где n- 2, 6, 9, n зависит от способа выделения нитрата магния и температурного режима.
3. Соединение Mg(NO3)2 · 2H2O представляет собой бесцветные кристаллы с плотностью 2,025 г/см3, плавятся при 129,5 °С, растворимы в воде, спирте и концентрированной азотной кислоте.
4. Mg(NO3)2 · 6H2O – бесцветные призматические кристаллы моноклинной формы с плотностью 1,464 г/см3; они плавятся при температуре 95°С, кипят при 143°С, также растворимы в воде, спирте и концентрированной азотной кислоте.
5. Mg(NO3)2 · 9H2O бесцветные кристаллы с плотностью 1,356 г/см3 плавятся при 74°С, плотность 1,302 г/см3
6. Растворимость безводной соли в воде (на 100 г) при 20°С 73,3 г (42,3 %), при повышении температуры растворимость повышается и при 80°С она составляет 110,1 г (52,4 %).
7. Выделен также неустойчивый кристаллогидрат состава Mg(NO3)2 · 4H2O плавящийся при температуре 52 °С.
8. Легко теряет кристаллизационную воду по следующей схеме:
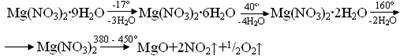
При температуре выше 380° разлагается.
9. При неполном разложении кристаллогидратов получаются продукты различного состава 2Mg(NO3)2· MgO, Mg(NO3)2· Mg(OН)2, Mg(NO3)2·3Mg(OН)2·8H2O, Mg(NO3)2·2Mg(OН)2·4H2O и т. д.
10. Растворяется в безводном жидком аммиаке и абсолютизированном спирте, образуя аддукты различного состава:
Mg(NO3)2 + nNH3 = Mg(NO3)2 · nNH3 (n=1, 2, 4, 6)
Mg(NO3)2 + 6CH3OH = Mg(NO3)2 · 6CH3OH
Mg(NO3)2 + 6C2H5OH = Mg(NO3)2 · 6C2H5OH.
11. Водный раствор Mg(NO3)2 имеет кислую среду раствора вследствие гидролиза по катиону: Mg(NO3)2 + H2O ↔MgOHNO3 + 2HNO3
Mg2+ + H2O ↔ MgOH+ + H+ (гидролиз по первой ступени)
MgOHNO3 + H2O ↔ Mg(OH)2↓+ HNO3
MgOH+ + H2O ↔ Mg(OH)2↓+ H+ (гидролиз по второй ступени)
12. При взаимодействии с растворами щелочей выпадает белый осадок гидроксида магния Mg(OH)2.
Mg(NO3)2 +2NaOH = Mg(OH)2↓+ 2Na NO3.
13. Не растворяется в растворах плавиковой, фосфорной, угольной, кремниевой кислот, химически взаимодействует с ними с образованием нерастворимых в воде солей:
Mg(NO3)2 + 2HF = MgF2↓+ 2HNO3;
3Mg(NO3)2 + 2H3PO4 = Mg3(PO4)2↓+ 6HNO3;
Mg(NO3)2 + CO2 + H2O = MgCO3↓+2HNO3;
Mg(NO3)2 + H2SiO3 = MgSiO3↓+2HNO3
Сильно (все выпавшие осадки белого цвета). разбавленная
Физико – химическая характеристика MgO
1. Белая или жженая магнезия - MgO белый рыхлый порошок (кристаллы октаэдрической формы) плавится при температуре 2800°С, кипит при t = 3600°С;
2. В электрической печи сублимируется при температуре 1600 - 1800°С, а затем вновь осаждается в виде кристаллов уже кубической формы с кристаллической решеткой подобной NaCl с межионным расстоянием 2,11А, плотностью 3,58 г/см3 и твердостью 4 по шкале Мооса.;
3. Плотность 3,67 г/см3, твердость по шкале Мооса равна 6.
4. MgO плохо проводит тепло и электричество, трудно растворим в воде, но легко в метиловом спирте, разбавленных кислотах, расплавленном криолите Na3[AlF6];
5. MgO очень медленно взаимодействует с водой при нагревании:
MgO + H2O ![]() Mg(OH)2↓ ,
Mg(OH)2↓ ,
(Белый порошок)
6. Хорошо растворяется в кислотах и метиловом спирте:
MgO + 2HCl = MgCl2 + H2O,
MgO + 2CH3OH = (CH3O)2Mg + H2O.
Метилат магния
7. На воздухе при действии углекислого газа и влаги легко переходит в основной карбонат магния:
2MgO + CO2 + H2O = (MgOH)2CO3.
8. При высоких температурах восстанавливается калием, кальцием, кремнием, карбидом калия и др:
MgO + 2K = K2O + Mg,
MgO + Сa = CaO + Mg,
2MgO + K4C = 2K2O + Mg +C.
Физико – химическая характеристика MgCl2
1. Безводная соль MgCl2 кристаллизуется в виде бесцветных очень гигроскопичных гексагональных кристаллов со слоистой структурой и горьким вкусом;
2. Плотность кристаллов безводного MgCl2 2,32 г/см3, плавится при температуре 715°С, кипит при 1412°С;
3. MgCl2 хорошо растворима в воде (54,5 г на 100 г воды) и ацетоне;
4. При выделения из раствора в зависимости от температуры кристаллизуется стабильный при обычных условиях гексагидрат MgCl2·6H2O или при быстром выпаривании — продукт, содержащий меньшее количество молекул воды (1, 2, 4); известны также кристаллогидраты хлорида магния с 8 и 12 молекулами воды;
5. MgCl2·6H2O существует в интервале температур от —3,4 до 116,7°. Он образует расплывающиеся на воздухе моноклинные кристаллы с плотностью 1,56 г/см3;
6. Воду из хлорида магния нельзя полностью удалить без разложения соли, так как при нагревании отщепляется хлористый водород и образуется основной хлорид (оксохлорид) переменного состава
2MgCl2 + Н2О = Mg2OCI2 + 2HC1.
7. Водный раствор MgCl2 имеет слабокислую реакцию:
MgСl2 + H2O ↔MgOHCl+ 2HCl
Mg2+ + H2O ↔ MgOH+ + H+ (гидролиз по первой ступени)
MgOHCl+ H2O ↔ Mg(OH)2↓+ HCl
MgOH+ + H2O ↔ Mg(OH)2↓+ H+ (гидролиз по второй ступени)
8. Если в концентрированный раствор MgCl2 внести сильно прокаленный оксид магния, то получившееся тесто через несколько часов застывает в твердую массу, образуя так называемый магнезиальный цемент (цемент Сореля), причем происходит соединение окисла с хлоридом с образованием основных хлоридов MgCl2·5Mg(OH)2·8H2O, MgCl2·3Mg(OH)2·8H2O, MgCl2·2Mg(OH)2·4H2O и т.д.
9. При действии паров воды на нагретый безводный хлорид магния может образоваться основной хлорид магния или оксид магния:
MgCl2 + H2O ![]() Mg(OH)Cl + 2HCl,
Mg(OH)Cl + 2HCl,
MgCl2 + H2O ![]() MgO + 2HCl.
MgO + 2HCl.
10. Растворяется в спиртах с образованием аддуктов:
MgCl2 + 6C2H5OH = MgCl2·6C2H5OH,
11. При нагревании кристаллогидраты теряют воду по следующей схеме:
MgCl2·12 H2O ![]() MgCl2·8H2O
MgCl2·8H2O![]() MgCl2·6H2O
MgCl2·6H2O![]() MgCl2·4H2O
MgCl2·4H2O![]() MgCl2·2H2O
MgCl2·2H2O![]() MgCl2·H2O
MgCl2·H2O![]() MgO + 2HCl.
MgO + 2HCl.
Физико – химическая характеристика HCl
Похожие работы
... рунтових вод, а також вод наземних водоймищ із впливом на екотоксикологічний стан водних екосистем. Характер впливу мінеральних добрив на агроекосистеми, передусім, зумовлений їхнім хімічним складом, що, у свою чергу, залежить від особливостей сировини та промислових технологій виробництва. Мінеральні добрива є джерелом надходження багатьох хімічних елементів (ХЕ) та сполук у довкілля. При їхній ...

0 комментариев